Đề ôn tập Chương 6: Kim loại kiềm, kiềm thổ, nhôm - Hóa học 12
Bạn đang xem tài liệu "Đề ôn tập Chương 6: Kim loại kiềm, kiềm thổ, nhôm - Hóa học 12", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
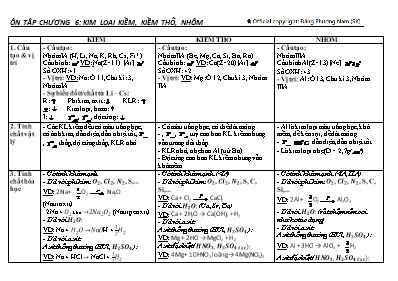
ÔN TẬP CHƯƠNG 6: KIM LOẠI KIỀM, KIỀM THỔ, NHÔM KIỀM KIỀM THỔ NHÔM 1. Cấu tạo & vị trí - Cấu tạo: Nhóm IA (H, Li, Na, K, Rb, Cs, Fr*) Cấu hình: VD: Na(Z=11) [Ar] Số OXH: +1 - Vị trí: VD: Na: Ô 11, Chu kì: 3, Nhóm IA - Sự biến đổi t/chất từ Li – Cs: R: Phi kim, axit: KLR: : Kim loại, bazo: I: , , độ cứng: - Cấu tạo: Nhóm IIA (Be, Mg, Ca, Sr, Ba, Ra) Cấu hình: VD: Ca(Z=20) [Ar] Số OXH: +2 - Vị trí: VD: Mg: Ô 12, Chu kì 3, Nhóm IIA - Cấu tạo: Nhóm IIIA Cấu hình Al(Z=13) [Ne] Số OXH: +3 - Vị trí: Al: Ô 13, Chu kì 3, Nhóm IIIA 2. Tính chất vật lý - Các KL kiềm đều có màu trắng bạc, có ánh kim, dẫn điện, dẫn nhiệt tốt, , thấp, độ cứng thấp, KLR nhỏ - Có màu trắng bạc, có thể dát mỏng. - , , tuy cao hơn KL kiềm nhưng vẫn tương đối thấp. - KLR nhỏ, nhẹ hơn Al (trừ Ba). - Độ cứng cao hơn KL kiềm nhưng vẫn khá mềm. - Al là kim loại màu trắng bạc, khá mềm, dễ kéo sợi, dễ dát mỏng. - , dẫn điện, dẫn nhiệt tốt. - Là kim loại nhẹ (D = 2,7g/). 3. Tính chất hóa học - Có tính khử mạnh. - T/d với phi kim: O2, Cl2, N2, S,... VD: 2Na + O2 Na2O (Natrioxit) 2Na + O2 khô →2Na2O2 (Natripeoxit) - T/d với H2O: VD: Na + H2O →NaOH + 12H2 - T/d với axit: Axit thông thường (HCl, H2SO4 ): VD: Na + HCl → NaCl + 12H2 Axit đặc biệt (HNO3, H2SO4 đặc): VD: K + HNO3 → KNO3 + spk (NO2, NO, N2O, NH4NO3) + H2O 2 K + H2SO4 đặc → K2SO4 + spk (SO2, S, H2S) + H2O - T/d với dd muối: VD: Na + H2O →NaOH + 12H2 2NaOH + CuSO4 → Na2SO4 + Cu(OH)2¯ - T/d với Bazo: (gián tiếp) VD: Na + dd NaOH → Na + H2O →NaOH + 12H2 - Có tính khử mạnh.(<IA) - T/d với phi kim: O2, Cl2, N2, S, C, Si,... VD: Ca + Cl2 CaCl2 - T/d với H2O: (Ca, Sr, Ba) VD: Ca + 2H2O → Ca(OH)2 + H2 - T/d với axit: Axit thông thường (HCl, H2SO4 ): VD: Mg + 2HCl → MgCl2 + H2 Axit đặc biệt (HNO3, H2SO4 đặc): VD: 4Mg + 10HNO3 loãng → 4Mg(NO3)2 + spk NH4NO3 + 3H2O - T/d với dd muối: Trực tiếp (Mg, Be) VD: Mg + CuSO4 → MgSO4 + Cu Gián tiếp (Ba, Ca, Sr) VD: Ca + 2H2O → Ca(OH)2 + H2 Ca(OH)2 + Na2CO3 → 2NaOH + CaCO3 - T/d với Bazo: Trực tiếp (Be) VD: Be + NaOH → Na2BeO2 + H2 Gián tiếp (Ba, Ca, Sr) VD: Ba + dd NaOH → Ba + 2H2O → Ba(OH)2 + H2 - Có tính khử mạnh.(<IA, IIA) - T/d với phi kim: O2, Cl2, N2, S, C, Si,... VD: 2Al + O2 Al2O3 - T/d với H2O: (rất chậm nên coi như ko tác dụng) - T/d với axit: Axit thông thường (HCl, H2SO4 ): VD: Al + 3HCl → AlCl3 + H2 Axit đặc biệt (HNO3, H2SO4 đặc): VD: 2Al + 6H2SO4 đặc Al2(SO4)3 + spk 3SO2 + 6H2O Nhôm bị thụ động trong HNO3 đăc nguội - T/d với dd muối (trực tiếp): VD: 2Al + 3CuSO4 → Al2(SO4)3 + 3Cu - T/d với oxit của KL sau Al (nhiệt phân): VD: 2Al + Fe2O3 Al2O3 + 2Fe - T/d với bazo: VD: 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2 4. Điều chế - Chỉ bằng phương pháp điện phân nóng chảy muối Halogen hoặc Bazo của chúng trong điều kiện ko có không khí. VD: NaCl, NaOH,... 2NaCl 2Na + Cl2 2NaOH 2Na + O2 + H2O - Chỉ bằng phương pháp điện phân nóng chảy muối Halogen của chúng. VD: MgCl2,... MgCl2 Mg + Cl2 2Al2O3 4Al + 3O2 Vai trò của xúc tác criolit: + Tạo hỗn hợp có nhiệt độ nóng chảy thấp + Làm tăng độ dẫn điện + Tạo lớp chất điện li rắn che đậy cho nhôm nóng chảy khỏi bị oxi hóa 5. Ứng dụng - Chế tạo hợp kim có nhiệt độ nóng chảy thấp dùng trong thiết bị báo cháy, - Các kim lọai Na và K dùng làm chất trao đổi nhiệt trong 1 vài lọai lò phản ứng hạt nhân. - Kim lọai xesi dùng chế tạo tế bào quang điện. - Điều chế 1 số kim lọai hiếm bằng phương pháp nhiệt luyện. - Dùng nhiều trong tổng hợp hữu cơ. - Kim loại Be: làm chất phụ gia để chế tạo hợp kim có tính đàn hồi cao, bền, chắc, không bị ăn mòn. - Kim loại Ca: dùng làm chất khử để tách oxi, lưu huỳnh ra khỏi thép, làm khô 1 số hợp chất hữu cơ. - Kim loại Mg có nhiều ứng dụng hơn cả: tạo hợp kim có tính cứng, nhẹ, bền để chế tạo máy bay, tên lửa, ôtô Mg còn được dùng để tổng hợp nhiều hợp chất hữu cơ. Bột Mg trộn với chất oxi hóa dùng để chế tạo chất chiếu sáng ban đêm dùng trong pháo sáng, máy ảnh. - Al và hợp kim của Al nhẹ, bền -> Dùng làm vật liệu chế tạo máy bay, ô tô, tên lửa,... - Al và hợp kim của Al có màu trắng bạc, đẹp -> XD nhà cửa, trang trí nội thất. - Al nhẹ, dẫn điện tốt -> Làm dây dẫn thay cho đồng. - Al và hợp kim của Al dẫn nhiệt tốt, ít bị gỉ và không độc nên được dùng làm dụng cụ nhà bếp. CÁC HỢP CHẤT QUAN TRỌNG CỦA KL KIỀM, KIỀM THỔ, NHÔM: KIỀM KIỀM THỔ NHÔM ① Oxit: Na2O, K2O - Là chất rắn, tan tốt trong nước: Na2O + H2O →2NaOH - T/d gián tiếp với muối: Na2O + H2O →2NaOH 2NaOH + CuSO4 → Na2SO4 + Cu(OH)2¯ ①Canxi Hidroxit Ca(OH)2 - Tính chất: + Ca(OH)2 gọi là vôi tôi. + dd Ca(OH)2 được gọi là nước vôi trong (nhận biết CO2 và SO2 ) Vì: Ca(OH)2 + CO2 → CaCO3¯ (trắng) + H2O + dd là một bazo mạnh (Làm quỳ tím hóa xanh, pp hóa đỏ. T/d Axit, Oxit Axit, chất lưỡng tính, dd Muối) VD: Tự viết nha - Điều chế: CaO + H2O → Ca(OH)2 - Ứng dụng: + Đ/chế NH3 :2NH4Cl + Ca(OH)2 à CaCl2 + 2NH3 + 2H2O + Đ/chế Clorua Vôi: Ca(OH)2 + Cl2 à CaOCl2 + H2O + Làm VLXD. ① Nhôm Oxit Al2O3 - Al2O3 là chất rắn màu trắng, ko tan trong nước và ko t/d với nước, nhiệt độ nc: 2050oC - Al2O3 là oxit lưỡng tính: VD: Al2O3 + 6HCl → 2AlCl3 + 3H2O Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4] - Ứng dụng: trong tự nhiên, Al2O3 tồn tại ử dạng ngậm nước và dạng khan: + Oxit ngậm nước à Thành phần chủ yếu của quặng Boxit () à SX Al. + Oxit khan có cấu tạo tinh thể. Coridon ở dạng tinh thể trong suốt à Đá mài,... ② Hidroxit: NaOH, KOH - T/chất: NaOH được gọi là xút, là bazo mạnh nên có đầy đủ t/chất của một bazo mạnh (Làm quỳ tím hóa xanh, pp hóa hồng, t/dụng Axit, Oxit Axit, Oxit lưỡng tính) VD: Tự viết nha - Điều chế: 2NaCl + 2H2O 2NaOH + H2 + Cl2 - Ứng dụng: + NaOH là hóa chất quan trọng, đứng hàng thứ hai sau H2SO4 + NaOH -> Nấu xà phòng, chế phẩm nhuộm, tơ nhân tạo, tinh chế quặng nhôm trong CN luyện nhôm và dùng trong công nghiệp chế biến dầu mỏ. ② Canxi Cacbonat CaCO3 - Tính chất: + CaCO3 được gọi là đá vôi + CaCO3 Tồn tại trong các loại ốc, hến, trai,...đá phấn, đá hoa,... + CaCO3 dễ bị nhiệt phân ở 900oC CaCO3 + H2O + CO2 Ca(HCO3)2 (1) Giải thích sự hình thành thạch nhũ trong đá vôi (2) Giải thích sự hình thành lớp cặn trong ấm nước - CaCO3 là muối của axit yếu nên t/d được với axit mạnh: VD: CaCO3 + 2HCl → CaCl2 + H2O + CO2 - Ứng dụng: + Làm VLXD, SX vôi, xi măng, thủy tinh. + Đá hoa dùng trong công trình mĩ thuật + Đá phấn dễ nghiền thành bột mịn làm phụ gia thuốc đánh răng. ② Nhôm Oxit Al(OH)3 - Al(OH)3 là chất rắn màu trắng, kết tủa ở dạng keo nên t/d được với Axit mạnh, bazo mạnh. - Điều chế: AlCl3 + 3NH3 + 3H2O → Al(OH)3 + 3NH4Cl ③ Muối Hidrocacbonat NaHCO3, KHCO3 - Là chất rắn ít tan trong nước, khi tan phân li hoàn toàn ra ion. - Là chất lưỡng tính: VD: NaHCO3 + HCl → NaCl + CO2 + H2O NaHCO3 + NaOH → Na2CO3 + H2O - Dễ bị nhiệt phân: VD: 2NaHCO3 Na2CO3 + CO2 + H2O - Ứng dụng: NaHCO3 dùng làm thuốc dạ dày; Trong CN dùng làm bột nở. ③ Canxi Sunfat CaSO4 - Thạch cao sống: CaSO4.2 H2O - Thạch cao nung: CaSO4.H2O 350oC - Thạch cao khan: CaSO4 à Thạch cao nung dùng để bó bột, đúc tượng và đông cứng xi măng. ③ Nhôm Sunfat Al2(SO4)3 - Muối nhôm sunfat khan tan trong nước tỏa nhiệt làm dd nóng lên do bị hidrat hóa. - Phèn chua: KAl(SO₄)₂·12H₂O à Dùng trong CN giấy, chất cầm màu trong ngành nhuộm vải, chất làm trong nước. - Phèn chua Nhôm: Thay K bằng Li, Na, NH4 ④ Muối Cacbonat Na2CO3 - Tính chất: + Na2CO3 là chất rắn màu trắng, tan nhiều trong nước + Ở nhiệt độ thường, Na2CO3 tồn tại ở dạng muối ngậm nước + Na2CO3 là muối của axit yếu và có tính chất chung của muối - Ứng dụng: CN thủy tinh, bột giặt, phẩm nhuộm, giấy, sợi,... ④ Cách nhận biết ion Al3+ trong dd: - Cho từ từ NaOH đến dư vào dd thí nghiệm, nếu thấy có kết tủa keo xuất hiện rồi tan trong NaOH dư thì chứng tỏ có ion Al3+ ⑤ Muối Nitrat KNO3 - KNO3 là những tinh thể ko màu, bền trong không khí, tan nhiều trong nước. Khi đun nóng ở nhiệt độ cao hơn nhiệt độ nóng chảy bắt đầu bị phân hủy thành KNO2 và O2 VD: 2KNO3 2KNO2 + O2 - Ứng dụng: Làm phân bón, thuốc nổ - PƯ cháy của thuốc súng: 2KNO3 + 3C + S N2 + 3CO2 + K2S NƯỚC CỨNG 1. Định nghĩa: - Nước cứng là loại nước tự nhiên chứa nhiều ion (Ca2+) và (Mg2+) - Nước chức ít hoặc không chức ion (Ca2+) và (Mg2+) à Nước mềm 2. Phân loại: + Nước cứng tạm thời (là loại nước cứng khi đun sôi thì mất tính cứng do muối hiđrocacbonat bị nhiệt phân thành muối không tan). Tính cứng tạm thời do các muối Ca(HCO3)2 và Mg(HCO3)2 gây ra. + Nước cứng vĩnh cửu. Tính cứng vĩnh cửu của nước do các loại muối MgCl2, CaCl2, MgSO4, CaSO4 gây ra. + Nước cứng toàn phần là nước cứng có cả tính cứng tạm thời và tính cứng vĩnh cửu. 3. Tác hại: - Hình thành lớp cặn trong nồi hơi à Tốn nhiên liệu thâm chí gây nổ. - Ống dẫn nước lâu ngày bị đóng cặn à Giảm lưu lượng nước - Quần áo giặt bằng nước cứng thì xà phòng ko ra bọt à Tốn xà phòng, quần áo có thể bị hư hỏng - Pha trà à Làm giảm hương vị. - Nấu ăn à Lâu chín, giảm mùi vị. 4. Làm mềm nước cứng (loại bỏ ion Ca2+ và Mg2+) a/ Nước cứng tạm thời - Đun sôi: Ca(HCO3)2 CaCO3 + CO2 + H2O - Dùng Na2CO3, Na3PO4 - Dùng dd bazo vừa đủ - Dùng pp trao đổi ionit (giữ lại ion Ca2+ và Mg2+ thay bằng H+ , Na+ ) à Tốt nhất b/ Nước cứng vĩnh cửu & toàn phần: - Dùng Na2CO3, Na3PO4 - Dùng pp trao đổi ionit (giữ lại ion Ca2+ và Mg2+ thay bằng H+ , Na+ ) à Tốt nhất NHẬN BIẾT ION Ca2+ và Mg2+ trong dd: Dùng muối CO3 tạo kết tủa trắng: Na2CO3 + MgCl2 à MgCO3 + 2NaCl
Tài liệu đính kèm:
 de_on_tap_chuong_6_kim_loai_kiem_kiem_tho_nhom_hoa_hoc_12.docx
de_on_tap_chuong_6_kim_loai_kiem_kiem_tho_nhom_hoa_hoc_12.docx





