Đề ôn tập Chương 5, 6 môn Hóa học 10
Bạn đang xem tài liệu "Đề ôn tập Chương 5, 6 môn Hóa học 10", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
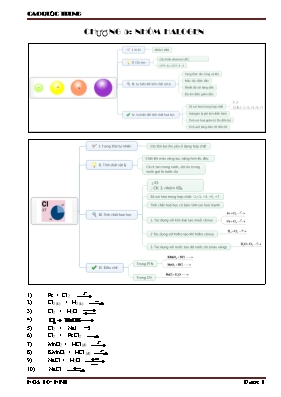
CHƯƠNG 5: NHÓM HALOGEN Fe + Cl2 Cl2 (k) + H2 (k) Cl2 + H2O Cl2 + NaI Cl2 + FeCl2 MnO2 + HCl (đ) KMnO4 + HCl (đ) NaCl + H2O NaCl Al + HCl Fe + HCl CuO + HCl Cu(OH)2 + HCl Na2CO3 + HCl KClO3 + HCl NaCl (r) + H2SO4 (đ) NaCl (r) + H2SO4 (đ) FLO BROM IOT Trạng thái tự nhiên - Dạng hợp chất: CaF2, Na3AlF6 - Lá mộ số cây, men răng - Hợp chất - Trong nước biển có chứa NaBr, NaI Lý tính Chất khí màu lục nhạt, độc Chất lỏng màu đỏ nâu, dễ bay hơi, độc Chất rắn màu đen tím, có hiện tượng thăng hoa Hoá tính Tính oxi hoá giảm dần từ Flo đến Iot Với KL Tác dụng với tất cả KL tạo muối florua Tác dụng với nhiều KL tạo muối bromua, iotua Với hiđro Phản ứng nổ ngay trong bóng tối Axit HF (axit yếu) có khả năng ăn mòn thuỷ tinh Với H2O Với dung dịch muối Flo không đẩy được halogen đứng sau vì: Nhận biết iot: Cl2 + NaOH Cl2 + Ca(OH)2 (r) F2 + H2 F2 + H2O HF + SiO2 Br2 + NaI Br2 + H2 Al + I2 I2 (r) + H2 (k) Cl2 + NaI CHƯƠNG 6: OXI – LƯU HUỲNH C + O2 S + O2 C2H5OH + O2 KMnO4 KClO3 H2O S + Fe S + Al S + H2 S + F2 H2S + NaOH H2S + NaOH H2S + O2 (dư) H2S + O2 (thiếu) H2 S + SO2 H2S + Cl2 + H2O FeS + HCl SO2 + H2O SO2 + NaOH SO2 + NaOH SO2 + O2 SO2 + Br2 + H2O SO2 + KMnO4 + H2O FeS2 + O2 Na2SO3 + H2SO4 Fe + H2SO4 (loãng) FeO + H2SO4 (loãng) Fe(OH)3 + H2SO4 Na2CO3 + H2SO4 BaCl2 + H2SO4 Fe + H2SO4 (đ) Cu + H2SO4 (đ) C + H2SO4 (đ) S + H2SO4 (đ) Fe3O4 + H2SO4 (đặc) FeO + H2SO4 (đặc) C12H2O11 CÁC PHƯƠNG PHÁP GIẢI BÀI TẬP 1. KIM LOẠI TÁC DỤNG VỚI PHI KIM Các phản ứng: (n: số oxi hóa cao nhất của KL) Đặc biệt: (n: số oxi hóa thấp của KL) Áp dụng: + Bảo toàn electron (hay bảo toàn điện tích) hoặc hoặc + Bảo toàn khối lượng: mKL + mPK = m sản phẩm (oxit hoặc muối) 2. KIM LOẠI TÁC DỤNG VỚI DUNG DỊCH AXIT HCl, H2SO4 loãng: Kim loại tác dụng với dung dịch HCl hoặc H2SO4 loãng tạo muối và giải phóng H2 - Các quá trình oxi hóa và khử n là số oxi hóa thấp của kim loại - Sơ đồ phản ứng: a. Kim loại (đứng trước H) + 2HCl Muối clorua + H2 b. Kim loại (đứng trước H) + H2SO4 loãng Muối sunfat + H2 3. KIM LOẠI TÁC DỤNG VỚI AXIT H2SO4 đặc: Kim loại tác dụng với H2SO4 đặc tạo muối sunfat và sản phẩm khử (SO2, S hoặc H2S) và nước - Các quá trình oxi hóa và khử M là kim loại (trừ Au, Pt) Nếu H2SO4 đặc, nguội trừ Al, Fe, Cr Hoặc + Biểu thức bảo toàn electron: nKL.hóa trị = + Tính khối lượng muối sunfat: Nếu sp khử là SO2: m muối = mKL + 96. 4. BÀI TOÁN SO2 TÁC DỤNG VỚI DUNG DỊCH NaOH HOẶC KOH SO2 + NaOH ® NaHSO3 (1) SO2 + 2NaOH ® Na2SO3 + H2O (2) - Nếu : Tạo muối NaHSO3 (và SO2 dư) (Viết phương trình 1, từ số mol NaOH tính số mol muối) - Nếu : Tạo 2 muối NaHSO3 + Na2SO3 (Viết 2 phương trình, lập hệ phương trình 2 ẩn, tính số mol muối) - Nếu : Tạo muối Na2SO3 (và NaOH dư) (Viết phương trình 2, từ số mol NaOH tính số mol muối) SO2 + Ca(OH)2 ® CaSO3 + H2O (SO2 làm vẩn đục nước vôi trong) 5. BÀI TOÁN H2S TÁC DỤNG VỚI DUNG DỊCH NaOH HOẶC KOH (TƯƠNG TỰ) 6. BÀI TOÁN CÓ HIỆU SUẤT PHẢN ỨNG a. Công thức tính: b. Tính khối lượng sản phẩm thu được khi có hiệu suất: mB = mB (theo ptpư) c. Tính khối lượng chất tham gia phản ứng khi có hiệu suất: mA = mA (theo ptpư)
Tài liệu đính kèm:
 de_on_tap_chuong_5_6_mon_hoa_hoc_10.docx
de_on_tap_chuong_5_6_mon_hoa_hoc_10.docx






