Đề kiểm tra một tiết số 2 – Năm học: 2014 môn hóa khối 11 thời gian : 45 phút
Bạn đang xem tài liệu "Đề kiểm tra một tiết số 2 – Năm học: 2014 môn hóa khối 11 thời gian : 45 phút", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
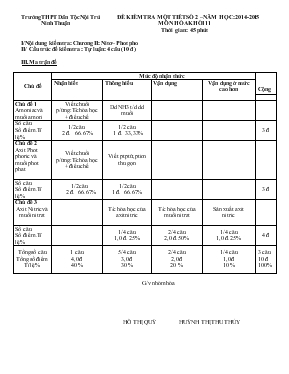
Trường THPT Dân Tộc Nội Trú ĐỀ KIỂM TRA MỘT TIÉT SỐ 2 –NĂM HỌC:2014-2015 Ninh Thuận MÔN HÓA KHỐI 11 Thời gian : 45 phút I/Nội dung kiểm tra: Chương II: Nitơ– Phot pho II/ Cấu trúc đề kiểm tra : Tự luận: 4 câu (10 đ ) III.Ma trận đề Chủ đề Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng Vận dụng ở mức cao hơn Chủ đề 1 Amoniac và muối amoni Viết chuổi p/ứng:T/c hóa học + điều chế Dd NH3 t/d dd muối Số câu Số điểm.Tỉ lệ% 1/2 câu 2 đ. 66.67% 1/2 câu 1 đ. 33,33% 3 đ Chủ đề 2 Axit Phot phoric và muối phot phat Viết chuổi p/ứng:T/c hóa học + điều chế Viết ptptử,ption thu gọn Số câu Số điểm.Tỉ lệ% 1/2 câu 2 đ. 66.67% 1/2 câu 1 đ. 66.67% 3 đ Chủ đề 3 Axit Nitric và muối nitrat T/c hóa học cúa axit nitric T/c hóa học cúa muối nitrat Sản xuất axit nitric Số câu Số điểm.Tỉ lệ% 1/4 câu 1,0 đ. 25% 2/4 câu 2,0 đ. 50% 1/4 câu 1,0 đ. 25% 4 đ Tổng số câu Tổng số điểm Tỉ lệ % 1 câu 4,0 đ 40 % 5/4 câu 3,0 đ 30 % 2/4 câu 2,0 đ 20 % 1/4 câu 1,0 đ 10 % 3 câu 10 đ 100% G/v nhóm hóa HỒ THỊ QUÝ HUỲNH THỊ THU THỦY Trường THPT Nội trú ĐỀ KIỂM TRA MỘT TIẾT SỐ 2 KHỐI 11 ( 2014- 2015) Họ và tên H/s:. MÔN : HÓA Lớp:. Thời gian: 45 phút ĐỀ 1 Câu 1.(4 đ) Viết các phương trình hóa học theo sơ đồ (ghi đầy đủ điều kiện, nếu có): (NH2)2CO (NH4)2CO3 NH3 NO NO2 HNO3 Fe(NO3)3 Fe(OH)3 Fe(NO3)3 Câu 2.( 2 đ ) : Hãy viết các phương trình phản ứng minh họa cho các nhận xét sau: a) Axit HNO3 loãng có tính oxi hoá mạnh. (viết 2 phương trình ) (1 đ ) b) Dung dịch NH3 tác dụng được với một số dung dịch muối. (viết 2 phương trình) (1 đ ) Câu 3.(4 đ) Cho 11 gam hỗn hợp kim loại gồm Fe và Al tác dụng vừa đủ với dung dịch HNO3 thu được 6,72 lít khí NO (sản phẩm khử duy nhất, đo ở đktc) và dung dịch A. Cô cạn dung dịch A thu được m1 gam hỗn hợp muối khan. a/Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu.(1 đ ) b/Tính m1 (1 đ ) c/Nhiệt phân hoàn toàn m1 gam hỗn hợp muối khan thu được V (lít) hỗn hợp khí X đo ở đktc. Cho hỗn hợp X hấp thụ hoàn toàn vào nước được 900 lit dung dịch Y. Tính pH dung dịch Y (1 đ ) d/Cho 500 ml dung dịch KOH 2M vào dung dịch A thu được m2 gam kết tủa. Tính m2.(1 đ ) (Cho Fe = 56; Al = 27; ; H = 1;; O = 16) ĐỀ 2 Câu 1.(4 đ) Viết các phương trình hóa học theo sơ đồ (ghi đầy đủ điều kiện, nếu có): NH3 N2 NO NO2 HNO3 H3PO4 Ca(H2PO4)2 CaHPO4 Ca3PO4 Câu 2.(2 đ) Viết phương trình hóa học dưới dạng phân tử và ion thu gọn cho các phản ứng xảy ra trong các trường hợp sau: a) Cho Al tác dụng với dung dịch HNO3 thu được dung dịch, không tạo khí. (1 đ ) b) Cho dung dịch HNO3 tác dụng với Cu sinh ra một khí duy nhất, khí này không màu hóa nâu trong không khí. (1 đ ) Câu 3.(4 đ) Cho 16,5 gam hỗn hợp kim loại gồm Fe và Al tác dụng vừa đủ với dung dịch HNO3 thu được 10,08 lít khí NO (sản phẩm khử duy nhất, đo ở đktc) và dung dịch A. Cô cạn dung dịch A thu được m1 gam hỗn hợp muối khan. a/Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu.(1 đ ) b/Tính m1 (1 đ ) c/Nhiệt phân hoàn toàn m1 gam hỗn hợp muối khan thu được V (lít) hỗn hợp khí X đo ở đktc. Cho hỗn hợp X hấp thụ hoàn toàn vào nước được 1350 lit dung dịch Y. Tính pH dung dịch Y (1 đ ) d/Cho 600 ml dung dịch KOH 2,5 M vào dung dịch A thu được m2 gam kết tủa. Tính m2.(1 đ ) (Cho Fe = 56; Al = 27; ; H = 1; O = 16) ĐÁP ÁN, BIỂU ĐIỂM BÀI KIỂM TRA MỘT TIẾT SỐ 2 ĐỀ 1 Câu Đáp án-Hướng dẫn chấm Biểu điểm 1(4đ) Viết đúng mỗi phản ứng phân tử (đk nếu có) 0, 5 đ x 8 = 4đ Viết đúng phương trình nhưng cân bằng sai 0, 25 đ/1 câu Viết sai chất Không có điểm 2(2đ) a/Viết chất đúng , cân bằng đúng kim loại t/d HNO3 0,5 đ/1p/ứng 0,5 x2 = 1đ a/Viết chất đúng , cân bằng đúng Dd NH3 t/d dd muối 0,5 đ/1p/ứng 0,5 x2 = 1đ 3a(1đ) A/Tính k/lượng từng kim 56a + 27 b = 11 a + b = 0,3 giải pt: a = 0,1; b =0,2 mFe = 5,6 gam mAl = 5,4 gam 0,25đ 0,25 đ 0,25 đ 0,25 đ 3(b,c,d) b/ Tính m1 (1 đ ) +nFe(NO3)3 = nFe =0,1 (mol) + nAl(NO3)3 = nAl =0,2 (mol) +m1 = 0,1 x 242 + 0,2 x 213 = 66,8 c/ Tính pH dung dịch Y (1 đ ) 2Fe(NO3)3 → Fe2O3 + 6 NO2 + 3/2O2 0,1 0,3 0,075 2Al(NO3)3 → Al2O3 + 6 NO2 + 3/2O2 0,2 0,6 0,15 2 NO2 + 1/2O2 + H2O → 2HNO3 0,9 0,9 [HNO3 ] = 0,9900 = 0,001 M= 10-3M pH = 3 0,25 đ 0,25 đ 0,5 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ d/ Tính m2.(1 đ ) Fe(NO3)3 + 3KOH → Fe(OH)3 + 3KNO3 0,1 0,3 0,1 Al(NO3)3 + 3KOH → Al(OH)3 + 3KNO3 0,2 0,6 0,2 nKOH dư = 1- 0,9= 0,1 (mol) KOH + Al(OH)3 → KAlO2 + 2H2O 0,1 0,1 0,2 M2 = 0,1 x 107 + 0,1 x 78 = 18,5 g 0,25 đ 0,25 đ 0,25 đ 0,25 đ ĐÁP ÁN, BIỂU ĐIỂM BÀI KIỂM TRA MỘT TIẾT SỐ 2 ĐỀ 2 Câu Đáp án-Hướng dẫn chấm Biểu điểm 1(4đ) Viết đúng mỗi phản ứng phân tử (đk nếu có) 0, 5 đ x 8 = 4đ Viết đúng phương trình nhưng cân bằng sai 0, 25 đ/1 câu Viết sai chất Không có điểm 2(2đ) a/8Al + 30HNO3 → 8 Al(NO3)3 + 3NH4NO3 + 9H2O 8Al + 30H + + 3NO3- → 8 Al3+ + 3NH4+ + 9H2O 0,5 đ 0,5 đ b/3Cu + 8HNO3 → 3 Cu(NO3)2 + 2NO + 4H2O 3Cu + 8H + + 2NO3- → 3 Cu2+ + 2NO + 4H2O 0,5 đ 0,5 đ 3a(1đ) A/Tính k/lượng từng kim 56a + 27 b = 16,5 a + b = 0,45 giải pt: a = 0,15; b =0,3 mFe = 8,4 gam mAl = 8,1 gam 0,25đ 0,25 đ 0,25 đ 0,25 đ 3(b,c,d) b/ Tính m1 (1 đ ) +nFe(NO3)3 = nFe =0,15 (mol) + nAl(NO3)3 = nAl =0,3 (mol) +m1 = 0,15 x 242 + 0,3 x 213 = 100,2 c/ Tính pH dung dịch Y (1 đ ) 2Fe(NO3)3 → Fe2O3 + 6 NO2 + 3/2O2 0,15 0,45 0,1125 2Al(NO3)3 → Al2O3 + 6 NO2 + 3/2O2 0,3 0,9 0,225 2 NO2 + 1/2O2 + H2O → 2HNO3 1,35 1,35 [HNO3 ] = 1,351350 = 0,001 M= 10-3M pH = 3 0,25 đ 0,25 đ 0,5 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ d/ Tính m2.(1 đ ) Fe(NO3)3 + 3KOH → Fe(OH)3 + 3KNO3 0,15 0,45 0,15 Al(NO3)3 + 3KOH → Al(OH)3 + 3KNO3 0,3 0,9 0,3 nKOH dư = 1,35- 1,5= 0,15 (mol) KOH + Al(OH)3 → KAlO2 + 2H2O 0,15 0,15 M2 = 0,15 x 107 + (0,3 – 0,15 ) x78 = 27,75 g 0,25 đ 0,25 đ 0,25 đ 0,25 đ Bài làm
Tài liệu đính kèm:
 Hoa_Ch_(DTNT)_2_11.doc
Hoa_Ch_(DTNT)_2_11.doc





