Đề kiểm tra học kỳ I - Năm học 2014 - 2015 môn: Hoá học 9 thời gian: 45 phút (không kể thời gian phát đề)
Bạn đang xem tài liệu "Đề kiểm tra học kỳ I - Năm học 2014 - 2015 môn: Hoá học 9 thời gian: 45 phút (không kể thời gian phát đề)", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
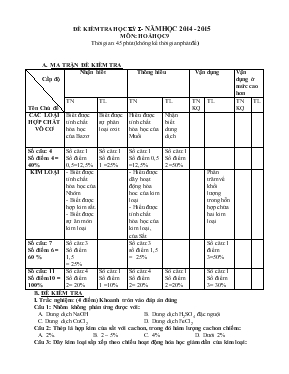
ĐỀ KIỂM TRA HỌC KỲ I - NĂM HỌC 2014 - 2015 MÔN: HOÁ HỌC 9 Thời gian: 45 phút (không kể thời gian phát đề) A. MA TRẬN ĐỀ KIỂM TRA Cấp độ Tên Chủ đề Nhận biết Thông hiểu Vận dụng Vận dụng ở mức cao hơn TN TL TN TL TNKQ TL TNKQ TL CÁC LOẠI HỢP CHẤT VÔ CƠ Biết được tính chất hóa học của Bazơ Biết được sự phân loại oxit Hiểu được tính chất hóa học của Muối Nhận biết dung dịch Số câu: 4 Số điểm 4 = 40% Số câu:1 Số điểm 0,5=12,5% Số câu:1 Số điểm 1 =25% Số câu:1 Số điểm 0,5 =12,5% Số câu:1 Số điểm 2 =50% KIM LOẠI - Biết được tính chất hóa học của Nhôm - Biết được hợp kim sắt. - Biết được sự ăn mòn kim loại - Hiểu được dãy hoạt động hóa hoc của kim loại - Hiểu được tính chất hóa học của kim loại, của Sắt Phần trăm về khối lượng trong hỗn hợp chứa hai kim loại Số câu: 7 Số điểm 6 = 60 % Số câu:3 Số điểm 1,5 = 25% Số câu:3 số điểm 1,5 = 25% Số câu: 1 điểm 3=50% Số câu: 11 Số điểm10 = 100% Số câu:4 Số điểm 2= 20% Số câu:1 Số điểm 1 =10% Số câu:4 Số điểm 2= 20% Số câu:1 Số điểm 2 =20% Số câu:1 Số điểm 3= 30% B. ĐỀ KIỂM TRA I. Trắc nghiệm: (4 điểm) Khoanh tròn vào đáp án đúng Câu 1: Nhôm không phản ứng được với: A. Dung dịch NaOH B. Dung dịch H2SO4 đặc nguội C. Dung dịch CuCl2 D. Dung dịch FeCl2 Câu 2: Thép là hợp kim của sắt với cacbon, trong đó hàm lượng cacbon chiếm: A. 2%. B. 2 – 5% C. 4% D. Dưới 2% Câu 3: Dãy kim loại sắp xếp theo chiều hoạt động hóa học giảm dần của kim loại: A. Na, Mg, Fe, Cu, Ag B. Ag, Cu, Fe, Mg, Na C. K, Ag, Fe, Hg, Cu D. Cu, Hg, Fe, Ag, K Câu 4: Cho các bazơ sau: Cu(OH)2 , NaOH, Ba(OH)2. Hãy cho biết bazơ nào bị nhiệt phân hủy: A. Cu(OH)2 , NaOH B. NaOH, Ba(OH)2 C. Ba(OH)2 D. Cu(OH)2 Câu 5: Đinh sắt ngâm trong môi trường nào sau đây là nhanh bị ăn mòn nhất: A. Cốc nước cất B. Cốc nước có hòa tan oxi C. Dung dịch muối ăn D. Dung dịch muối ăn có nhiệt độ cao Câu 6: Điều kiện để phản ứng giữa muối và axit xảy ra khi: A. Sản phẩm phải có chất kết tủa hoặc bay hơi. B. Sản phẩm phải là bazơ mới. C. Chất tham gia phải có chất kết tủa hoặc bay hơi. D. Sản phẩm phải là muối mới. t0 t0 Câu 7: Phương trình nào đúng: t0 t0 A. Fe + Cl2 FeCl2 B. 2Fe + 3Cl2 2FeCl3 C. 4Fe + 3Cl2 2Fe2Cl3 D. 2Fe + Cl2 2FeCl Câu 8: Kim loại tác dụng với nhiều phi kim thì sản phẩm: A. Tạo thành kim loại mới B. Tạo thành muối hoặc oxit C. Tạo thành axit D. Tạo thành bazơ ...................................................... II. Tự luận: (6 điểm) Câu 1: (1 điểm) Em hãy phân loại oxit căn cứ vào tính chất hóa học của oxit. Câu 2: (2 điểm) Hãy dùng một thuốc thử để nhận biết các dung dịch mất nhãn sau: HCl, AgNO3, Ca(OH)2, NaNO3. Câu 3: (3 điểm) Cho 40g hỗn hợp 2 kim loại Fe và Cu vào dd HCl dư. Thu được 11,2 lít khí (đktc) a) Viết phương trình phản ứng xảy ra. b) Tính phần trăm khối lượng mỗi kim loại trong hỗn hợp đầu. ( Biết: Zn = 65, Cu = 64, Fe = 56, K = 39, Cl = 35,5, O =16, H = 2, Al = 27, Na =23) C. ĐÁP ÁN VÀ THANG ĐIỂM I. Trắc nghiệm: (4 điểm) Mỗi câu trả lời đúng được 0,5 điểm Câu 1 2 3 4 5 6 7 8 Đáp án B D A D D A B B II. Tự luận: ( 6 điểm) Câu Đáp án Thang điểm 1 (1 điểm) Phân loại oxit: - Oxit bazơ - Oxit axit - Oxit lưỡng tính - Oxit trung tính 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm 2 (2 điểm) - Đánh số thứ tự từ 1 đến 4 trên mỗi lọ mất nhãn - Trích mỗi chất một ít ra làm mẫu thử + Dùng quì tím nhúng vào mỗi lọ: - Lọ làm quì tím chuyển sang màu xanh là Ca(OH)2 - Lọ làm quì tím chuyển sang màu đỏ là HCl + Cho một ít mẫu thử của lọ HCL vừa nhận được vào hai lọ còn lại: - Lọ xuất hiện kết tủa trắng là AgNO3 - Lọ không hiện tượng là NaNO3 + Phương trình phản ứng: 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm 0,5 điểm 3 (3 điểm) a) PTPƯ: Fe + 2HCl à FeCl2 + H2 b) Số mol của H2 thu được là: = V / 22,4 = 11,2/ 22,4= 0.5mol Fe + 2HCl à FeCl2 + H2 1 : 2 : 1 : 1 0.5mol 0.5mol Khối lượng của Fe là: mFe = n. M = 0,5. 56 = 28g Khối lượng của Cu là : mCu = 40 – 28 = 12g Phần trăm về khối lượng của mỗi kim loại là: %mFe = = 70% % mCu = = 30% Ghi chú: HS có cách giải khác đúng vẫn cho điểm tối đa 0,5 điểm 0,5 điểm 0,5 điểm 0,5 điểm 0,5 điểm 0,5 điểm Ba Cụm Bắc, ngày 12 tháng 12 năm 2014 DUYỆT CỦA BGH DUYỆT CỦA TỔ CM Giáo viên ra đề Cao Văn Mai
Tài liệu đính kèm:
 kt_hoa_9_hk_1_pvd.doc
kt_hoa_9_hk_1_pvd.doc





