Đề kiểm tra học kì ii môn : hóa học 8
Bạn đang xem tài liệu "Đề kiểm tra học kì ii môn : hóa học 8", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
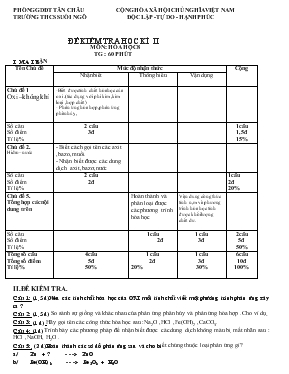
PHỊNG GDĐT TÂN CHÂU CỘNG HỊA XÃ HỘI CHỦ NGHĨA VIỆT NAM TRƯỜNG THCS SUỐI NGƠ ĐỘC LẬP -TỰ DO - HẠNH PHÚC ĐỀ KIỂM TRA HỌC KÌ II MƠN : HĨA HỌC 8 TG : 60 PHÚT I. MA TRẬN Tên Chủ đề Mức độ nhận thức Cộng Nhận biết Thơng hiểu Vận dụng Chủ đề 1 Oxi –khơng khí -Biết được tính chất hĩa học của oxi .(tác dụng với phi kim ,kim loại ,hợp chất ) - Phản ứng hĩa hợp ,phản ứng phân hủy , Số câu Số điểm Tỉ lệ % 2 câu 3đ 1câu 1,5đ 15% Chủ đề 2. Hidro –nước - Biết cách gọi tên các axit ,bazo,muối. - Nhận biết được các dung dịch axit,bazơ,nước Số câu Số điểm Tỉ lệ % 2 câu 2đ 1câu 2đ 20% Chủ đề 5. Tổng hợp các nội dung trên Hồn thành và phân loại được các phương trình hĩa học Vận dung cơng thức tính n,m và phương trình hĩa học tính được khối lượng chất dư. Số câu Số điểm Tỉ lệ % 1câu 2đ 1 câu 3đ 2câu 5đ 50% Tổng số câu Tổng số điểm Tỉ lệ% 4câu 5đ 50% 1 câu 2đ 20% 1 câu 3đ 30% 6câu 10đ 100% II.ĐỀ KIỂM TRA . Câu 1: (1,5 đ)Nêu các tính chất hóa học của OXI mổi tính chất viết một phương trình phản ứng xảy ra ? Câu 2: (1,5 đ) So sánh sự giống và khác nhau của phản ứng phân hủy và phản ứng hĩa hợp .Cho ví dụ. Câu 3: (1 đ) Hãy gọi tên các cơng thức hĩa học sau :Na2O ,HCl ,Fe(OH)2 ,CaCO3. Câu 4: (1đ)Trình bày các phương pháp để nhận biết được các dung dịch khơng màu bị mất nhãn sau : HCl ,NaOH, H2O . Câu 5:. (2 đ)Hoàn thành các sơ đồ phản ứng sau và cho biết chúng thuộc loại phản ứng gì? a/ Zn + ? - - -> ZnO b/ Fe(OH)3 - - -> Fe2O3 + H2O c/ K2O + H2O - - -> KOH d/ ? + HCl - - -> AlCl3 + H2 Câu 6: (3 đ) Cho 22,4 gam sắt vào dung dịch có chứa 24,5 gam axit sunfuric. a.Viết phương trình hóa học phản ứng xảy ra ? b.Khi phản ứng kết thúc, chất nào còn dư khối lượng là bao nhiêu ? c. Tính thể tích khí H2 tạo thành ở (đktc) III .ĐÁP ÁN Câu Nội dung bài giải Điểm Câu 1 (1,5đ) Tính chất hóa học ; - Tác dụng với phi kim : S+ O2 à SO2 - Tác dụng với kim loại Zn + O2 à ZnO - Tác dụng với hợp chất CH4 + 2O2 à CO2 + 2H2O 0,5 điểm 0,5 điểm 0,5 điểm . Câu 2 (1,5đ) Giống nhau : Đều là phản ứng hóa học . Khác nhau : + phản ứng phân hủy từ 1 chất ban đầu sinh ra 2 hay nhiều chất mới CaCO3 à CaO + CO2 + phản ứng hĩa hợp từ hai hay nhiều chất ban đầu sinh ra 1 chất mới CaO + H2O à Ca(OH)2 0,5 điểm 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm Câu 3 (1đ) Na2O Natri oxit HCl Axit clohidric Fe(OH)2 Săt(II)hidroxit CaCO3. Canxicacbonat 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm Câu 4 (1đ) Dung quỳ tím để nhận biết . Lần lượt nhỏ các dung dịch trên vào mẩu quỳ tím ,nếu quỳ tím chuyển sang màu đỏ là HCl, nếu quỳ tím chuyển sang màu xanh là NaOH nếu quỳ tím khơng chuyển màu là H2O 0,25 điểm 0,75 điểm Câu 5 (2đ) a/ 2Zn + O2 à 2ZnO pư hóa hợp b/ 2Fe(OH)3 à Fe2O3 +3H2O pư phân hủy c/ K2O + H2O - - -> 2 KOH pư hóa hợp d/ Al + HCl - - -> AlCl3 + H2 Pư thế 0,5 điểm 0,5 điểm 0,5 điểm 0,5 điểm Câu 6 (3đ) Số mol sắt: n = = = 0.4 mol, Số mol axit sunfuric. n = = = 0.25 mol, PTHH: Fe + H2SO4 à FeSO4 + H2 1 1 1 1 X 0,25 Chất dư là Fe :số mol chất dư là 0,4 – 0,25 = 0,15 mol Khối lượng Fe dư là : 0,15.56 = 8,4 g. Thể tích khí H2 là : V= n.22,4 = 0,25.22,4 = 5,6 lit 0,5 điểm 0,5 điểm 0,5 điểm 0,5 điểm 0,5 điểm 0,5 điểm **************************************************************** PHỊNG GDĐT TÂN CHÂU CỘNG HỊA XÃ HỘI CHỦ NGHĨA VIỆT NAM TRƯỜNG THCS SUỐI NGƠ ĐỘC LẬP -TỰ DO - HẠNH PHÚC ĐỀ KIỂM TRA HỌC KÌ II MƠN : HĨA HỌC 8 TG : 60 PHÚT I. MA TRẬN Tên Chủ đề Mức độ nhận thức Cộng Nhận biết Thơng hiểu Vận dụng Chủ đề 1 Oxi –khơng khí - Khái niệm về oxit. - Biết so sánh được sự cháy và sự oxi hĩa chậm Số câu Số điểm Tỉ lệ % 2 câu 2,5đ 1câu 2,5đ 25% Chủ đề 2. Hidro –nước - Biết cách gọi tên các axit ,bazo,muối. - Tính chất hĩa học của nước . Số câu Số điểm Tỉ lệ % 2 câu 2,5đ 1câu 2,5đ 25% Chủ đề 5. Tổng hợp các nội dung trên Hồn thành và phân loại được các phương trình hĩa học Vận dung cơng thức tính n,m và phương trình hĩa học tính được khối lượng chất dư. Số câu Số điểm Tỉ lệ % 1câu 2đ 1 câu 3đ 2câu 5đ 50% Tổng số câu Tổng số điểm Tỉ lệ% 4câu 5đ 50% 1 câu 2đ 20% 1 câu 3đ 30% 6câu 10đ 100% II.ĐỀ KIỂM TRA . Câu 1: (1,5 đ) Nêu các tính chất hóa học của Nước mổi tính chất viết một phương trình phản ứng xảy ra ? Câu 2: (1 đ) Hãy gọi tên các cơng thức hĩa học sau : SO2 ,H2SO 4 , NaOH , K2CO3 Câu 3: (1,5 đ) Nêu khái niệm về OXIT , cĩ mấy loại oxit ?Cho ví dụ. Câu 4: (1 đ) So sánh sự giống và khác nhau của sự cháy và sự oxi hĩa chậm .cho ví dụ Câu 5:. (2 đ) Hoàn thành các phương trình phản ứng sau và cho biết chúng thuộc loại phản ứng hĩa học nào? a. Fe + ? Fe3O4 b. KClO3 KCl + ? c. Na + O2 Na2O d. Al + H2SO4 Al2(SO4)3 + H2 Câu 6: (3 đ) Cho 22,4 gam sắt vào dung dịch có chứa 24,5 gam axit sunfuric. a.Viết phương trình hóa học phản ứng xảy ra ? b.Khi phản ứng kết thúc, chất nào còn dư khối lượng là bao nhiêu ? c. Tính thể tích khí H2 tạo thành ở (đktc) .. III .ĐÁP ÁN Câu Nội dung bài giải Điểm Câu 1 (1,5đ) Tính chất hóa học ; - Tác dụng với kim loại 2Na + 2H2O à 2NaOH + H2á - Tác dụng với oxit bazơ CaO + H2O à Ca(OH)2 - Tác dụng với oxit axit P2O5+ 3H2O à 2H3PO4 0,5 điểm 0,5 điểm 0,5 điểm . Câu 2 (1đ) SO2 Lưu huỳnh đioxit H2SO 4 axit sunfuric NaOH , natri hidroxit K2CO3 kali cacbonat 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm Câu 3 (1,5đ) Oxít là hợp chất của 2 nguyên tố, trong đó có 1 nguyên tố là oxi Có 2 loại chính: 1.Oxít axit: VD: SO3, CO2, P2O5 2.Oxít bazơ. VD: Na2O, CaO, CuO 0,5 điểm 0,5 điểm 0,5 điểm Câu 4 (1đ) Giống nhau : đều là sự oxi hĩa và cĩ tỏa nhiệt Khác nhau : Sự cháy cĩ phát sang . VD than ,củi cháy Sự oxi hĩa chậm khơng phát sang Vd kim loại sắt để ngồi khơng khí bị rỉ sét 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm Câu 5 (2đ) a. 3Fe + 2 02 Fe3O4 pư hóa hợp b. 2 KClO3 2 KCl + 302 pư phân hủy c. 4 Na + O2 2 Na2O pư hóa hợp d. 2 Al + 3H2SO4 Al2(SO4)3 + 3H2 Pư thế 0,5 điểm 0,5 điểm 0,5 điểm 0,5 điểm Câu 6 (3đ) Số mol sắt: n = = = 0.4 mol, Số mol axit sunfuric. n = = = 0.25 mol, PTHH: Fe + H2SO4 à FeSO4 + H2 1 1 1 1 X 0,25 Chất dư là Fe :số mol chất dư là 0,4 – 0,25 = 0,15 mol Khối lượng Fe dư là : 0,15.56 = 8,4 g. Thể tích khí H2 là : V= n.22,4 = 0,25.22,4 = 5,6 lit 0,5 điểm 0,5 điểm 0,5 điểm 0,5 điểm 0,5 điểm 0,5 điểm PHỊNG GDĐT TÂN CHÂU CỘNG HỊA XÃ HỘI CHỦ NGHĨA VIỆT NAM TRƯỜNG THCS SUỐI NGƠ ĐỘC LẬP -TỰ DO - HẠNH PHÚC ĐỀ KIỂM TRA HỌC KÌ II MƠN : HĨA HỌC 8 TG : 60 PHÚT I. MA TRẬN Tên Chủ đề Mức độ nhận thức Cộng Nhận biết Thơng hiểu Vận dụng Chủ đề 1 Oxi –khơng khí -Biết được tính chất hĩa học của oxi .(tác dụng với phi kim ,kim loại ,hợp chất ) - Phản ứng hĩa hợp ,phản ứng phân hủy , Số câu Số điểm Tỉ lệ % 2 câu 3đ 1câu 1,5đ 15% Chủ đề 2. Hidro –nước - Biết cách gọi tên các axit ,bazo,muối. - Nhận biết được các dung dịch axit,bazơ,nước Số câu Số điểm Tỉ lệ % 2 câu 2đ 1câu 2đ 20% Chủ đề 5. Tổng hợp các nội dung trên Hồn thành và phân loại được các phương trình hĩa học Vận dung cơng thức tính n,m và phương trình hĩa học tính được khối lượng chất dư. Số câu Số điểm Tỉ lệ % 1câu 2đ 1 câu 3đ 2câu 5đ 50% Tổng số câu Tổng số điểm Tỉ lệ% 4câu 5đ 50% 1 câu 2đ 20% 1 câu 3đ 30% 6câu 10đ 100% II.ĐỀ KIỂM TRA . Câu 1: (1,5 đ)Nêu các tính chất hóa học của OXI mổi tính chất viết một phương trình phản ứng xảy ra ? Câu 2: (1,5 đ) So sánh sự giống và khác nhau của phản ứng phân hủy và phản ứng hĩa hợp .Cho ví dụ. Câu 3: (1 đ) Hãy gọi tên các cơng thức hĩa học sau :Na2O ,HCl ,Fe(OH)2 ,CaCO3. Câu 4: (1đ)Trình bày các phương pháp để nhận biết được các dung dịch khơng màu bị mất nhãn sau : HCl ,NaOH, H2O . Câu 5:. (2 đ)Hoàn thành các sơ đồ phản ứng sau và cho biết chúng thuộc loại phản ứng gì? a/ Zn O + HCl - - -> ? + ? b/ Fe(OH)3 - - -> Fe2O3 + H2O c/ K2O + ? - - -> KOH d/ ? + HCl - - -> AlCl3 + H2 Câu 6: (3 đ) Cho 22,4 gam sắt vào dung dịch có chứa 24,5 gam axit sunfuric. a.Viết phương trình hóa học phản ứng xảy ra ? b.Khi phản ứng kết thúc, chất nào còn dư khối lượng là bao nhiêu ? c. Tính thể tích khí H2 tạo thành ở (đktc) III .ĐÁP ÁN Câu Nội dung bài giải Điểm Câu 1 (1,5đ) Tính chất hóa học ; - Tác dụng với phi kim : S+ O2 à SO2 - Tác dụng với kim loại Zn + O2 à ZnO - Tác dụng với hợp chất CH4 + 2O2 à CO2 + 2H2O 0,5 điểm 0,5 điểm 0,5 điểm . Câu 2 (1,5đ) Giống nhau : Đều là phản ứng hóa học . Khác nhau : + phản ứng phân hủy từ 1 chất ban đầu sinh ra 2 hay nhiều chất mới CaCO3 à CaO + CO2 + phản ứng hĩa hợp từ hai hay nhiều chất ban đầu sinh ra 1 chất mới CaO + H2O à Ca(OH)2 0,5 điểm 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm Câu 3 (1đ) Na2O Natri oxit HCl Axit clohidric Fe(OH)2 Săt(II)hidroxit CaCO3. Canxicacbonat 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm Câu 4 (1đ) Dung quỳ tím để nhận biết . Lần lượt nhỏ các dung dịch trên vào mẩu quỳ tím ,nếu quỳ tím chuyển sang màu đỏ là HCl, nếu quỳ tím chuyển sang màu xanh là NaOH nếu quỳ tím khơng chuyển màu là H2O 0,25 điểm 0,75 điểm Câu 5 (2đ) a/ 2Zn + O2 à 2ZnO pư hóa hợp b/ 2Fe(OH)3 à Fe2O3 +3H2O pư phân hủy c/ K2O + H2O - - -> 2 KOH pư hóa hợp d/ Al + HCl - - -> AlCl3 + H2 Pư thế 0,5 điểm 0,5 điểm 0,5 điểm 0,5 điểm Câu 6 (3đ) Số mol sắt: n = = = 0.4 mol, Số mol axit sunfuric. n = = = 0.25 mol, PTHH: Fe + H2SO4 à FeSO4 + H2 1 1 1 1 X 0,25 Chất dư là Fe :số mol chất dư là 0,4 – 0,25 = 0,15 mol Khối lượng Fe dư là : 0,15.56 = 8,4 g. Thể tích khí H2 là : V= n.22,4 = 0,25.22,4 = 5,6 lit 0,5 điểm 0,5 điểm 0,5 điểm 0,5 điểm 0,5 điểm 0,5 điểm PHỊNG GDĐT TÂN CHÂU CỘNG HỊA XÃ HỘI CHỦ NGHĨA VIỆT NAM TRƯỜNG THCS SUỐI NGƠ ĐỘC LẬP -TỰ DO - HẠNH PHÚC ĐỀ KHẢO SÁT CHẤT LƯỢNG ĐẦU NĂM MƠN : HĨA HỌC 9 TG : 45 PHÚT I. MA TRẬN Tên Chủ đề Mức độ nhận thức Cộng Nhận biết Thơng hiểu Vận dụng Chủ đề 1 Oxit –Axit –Bazo-Muối -Viết và phân loại được các cơng thức của Oxit –Axit –Bazo-Muối Số câu Số điểm Tỉ lệ % 1câu 2đ 1câu 1,5đ 15% Chủ đề 2. Tính chất hĩa học của oxit - Nêu được các tính chất hĩa học của oxit bazơ,oxitaxit - Nhận biết được các oxit bazo,oxitaxit Số câu Số điểm Tỉ lệ % 2câu 3đ 1câu 2đ 20% Chủ đề 5. Tổng hợp các nội dung trên Hồn thành và phân loại được các phương trình hĩa học Vận dung cơng thức tính n,m và phương trình hĩa học tính được thành phần phần trăm theo khối lượng. Số câu Số điểm Tỉ lệ % 1câu 2đ 1 câu 3đ 2câu 5đ 50% Tổng số câu Tổng số điểm Tỉ lệ% 3câu 5đ 50% 1 câu 2đ 20% 1 câu 3đ 30% 6câu 10đ 100% II.ĐỀ KIỂM TRA . Câu 1: (1,5 đ)Nêu các tính chất hóa học của OXITBAZƠ mổi tính chất viết một phương trình phản ứng xảy ra ? Câu 2: (1,5 đ) Bằng phương pháp hĩa học hãy phân biệt 2 chất rắn sau: CaO, Na2O. Câu 3: (2 đ) Viết cơng thức hĩa học của những chất cĩ tên gọi sau Sắt (III) hidroxit, Axit sunfuric Axit clohidric Sắt (II) oxit Nhôm sunfat Kali hidrocacbonat Lưu huỳnh trioxít Kali oxit Câu 4:. (2 đ)Hoàn thành các sơ đồ phản ứng sau và cho biết chúng thuộc loại phản ứng gì? a/ Zn + ? - - -> ZnO b/ Fe(OH)3 - - -> Fe2O3 + H2O c/ SO2 + ? - - -> K2SO3 + H2O d/ ? + HCl - - -> AlCl3 + H2 Câu 5: (3 đ) Cho 3,2 gam CuO tác dụng vừa đủ với dd H2SO4 4,9% a.Viết phương trình hóa học phản ứng xảy ra ? b. Tính khối lượng của dd H2SO4 c. Tính nồng độ phần trăm của dd sau phản ứng . III .ĐÁP ÁN Câu Nội dung bài giải Điểm Câu 1 (1,5đ) Tính chất hóa học ; - Tác dụng với nước : CaO + H2O à Ca(OH)2 - Tác dụng với axit ZnO + 2HCl à ZnCl2 + H2O - Tác dụng với oxit axit Na2O + CO2 à Na2 CO3 0,5 điểm 0,5 điểm 0,5 điểm . Câu 2 (1,5đ) Hịa tan các chất rắn trên vào nước ta được 2 dd . CaO + H2O à Ca(OH)2 Na2O + H2O à 2NaOH Dẩn khí CO2 vào 2 dd trên nếu cĩ kết tủa trắng thì chất ban đầu là CaO ,khơng cĩ kết tủa là Na2O 0,5 điểm 0,5 điểm 0,5 điểm Câu 3 (2đ) Sắt (III) hidroxit Fe(OH)3 , Axit sunfuric H2SO4 , HCl Axit clohidric Sắt (II) oxit FeO, Nhôm sunfat Al2(SO4)3 Kali hidrocacbonat KHCO3 Lưu huỳnh trioxít SO3 Kali oxit K2O, 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm Câu 4 (2đ) a/ 2Zn + O2 à 2ZnO pư hóa hợp b/ 2Fe(OH)3 à Fe2O3 +3H2O pư phân hủy c/ K2O + H2O - - -> 2 KOH pư hóa hợp d/ Al + HCl - - -> AlCl3 + H2 Pư thế 0,5 điểm 0,5 điểm 0,5 điểm 0,5 điểm Câu 5 (3đ) Số mol CuO : n = = = 0.04 mol, PTHH: CuO + H2SO4 à CuSO4 + H2O Số mol axit sunfuric. 0.04 mol, Khồi lương chất tan H2SO4 là 0.04 .98 =3,92 g Khồi lương dd H2SO4 là 3,92.100/4,9 = 80 g Khối lượng dd sau phản ứng 80+ 3,2 = 83,2 g Khối lượng chất tan CuSO4 0,04.160 =6,4 g Nồng độ %của CuSO4 6,4.100/83,2 =7,69% 0,5 điểm 0,5 điểm 0,5 điểm 0,5 điểm 0,5 điểm 0,5 điểm II.ĐỀ KIỂM TRA . Câu 1: (1,5 đ)Nêu các tính chất hóa học của OXITAXIT mổi tính chất viết một phương trình phản ứng xảy ra ? Câu 2: (1,5 đ) Bằng phương pháp hĩa học hãy phân biệt 2 chất rắn sau: CaO, MgO. Câu 3: (2 đ) Viết cơng thức hĩa học của những chất cĩ tên gọi sau : Natri hidroxit . Sắt (II) hidroxit ,Axit photphoric , Natri Clorua Sắt (III) Clorua Nhôm sunfat Kali cacbonat Lưu huỳnh trioxít Kali oxit Câu 5:. (2 đ)Hoàn thành các sơ đồ phản ứng sau và cho biết chúng thuộc loại phản ứng gì? a/ Zn O + HCl - - -> ? + ? b/ Fe(OH)3 - - -> Fe2O3 + H2O c/ K2O + ? - - -> KOH d/ ? + HCl - - -> AlCl3 + H2O Câu 6: (3 đ) Cho 22,4 gam sắt vào dung dịch có chứa 24,5 gam axit sunfuric. a.Viết phương trình hóa học phản ứng xảy ra ? b.Khi phản ứng kết thúc, chất nào còn dư khối lượng là bao nhiêu ? c. Tính thể tích khí H2 tạo thành ở (đktc) III .ĐÁP ÁN Câu Nội dung bài giải Điểm Câu 1 (1,5đ) Tính chất hóa học ; - Tác dụng với nước : CO2 + H2O à H2CO3 - Tác dụng với dd bazo SO2 + 2KOH à K2SO3 + H2O - Tác dụng với oxit bazo Na2O + CO2 à Na2 CO3 0,5 điểm 0,5 điểm 0,5 điểm . Câu 2 (1,5đ) Hịa tan các chất rắn trên vào nước chất tan trong nước là CaO . CaO + H2O à Ca(OH)2 Chất khơng tan trong nước là MgO. 0,5 điểm 0,5 điểm 0,5 điểm Câu 3 (1đ) Natri hidroxit :NaOH . Sắt (II) hidroxit Fe(OH)2 ,Axit photphoric H3PO4 , Natri Clorua NaCl Sắt (III) Clorua FeCl3 Nhôm sunfat Al2(SO4)3 Kali hidro cacbonat KHCO3 Lưu huỳnh trioxít SO3 Kali oxit K2O 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm Câu 4 (2đ) a ./Zn O + HCl - - -> Zn Cl2 + H2O b/ 2Fe(OH)3 - - -> Fe2O3 + 3H2O c/ K2O + H2O - - -> 2 KOH d/ Al2O3 + 6 HCl - - -> 2 AlCl3 + 3H2 0,5 điểm 0,5 điểm 0,5 điểm 0,5 điểm Câu 5 (3đ) Số mol sắt: n = = = 0.4 mol, Số mol axit sunfuric. n = = = 0.25 mol, PTHH: Fe + H2SO4 à FeSO4 + H2 1 1 1 1 X 0,25 Chất dư là Fe :số mol chất dư là 0,4 – 0,25 = 0,15 mol Khối lượng Fe dư là : 0,15.56 = 8,4 g. Thể tích khí H2 là : V= n.22,4 = 0,25.22,4 = 5,6 lit 0,5 điểm 0,5 điểm 0,5 điểm 0,5 điểm 0,5 điểm 0,5 điểm
Tài liệu đính kèm:
 DE_KHAO_SAT_DAU_NAM.doc
DE_KHAO_SAT_DAU_NAM.doc





