Đề kiểm tra học kì I, năm học 2015 - 2016 trường THCS Hoa Lư môn: Hóa học 9 thời gian làm bài: 45 phút
Bạn đang xem tài liệu "Đề kiểm tra học kì I, năm học 2015 - 2016 trường THCS Hoa Lư môn: Hóa học 9 thời gian làm bài: 45 phút", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
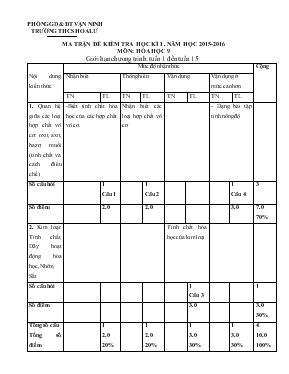
PHÒNG GD & ĐT VẠN NINH TRƯỜNG THCS HOA LƯ MA TRẬN ĐẾ KIỂM TRA HỌC KÌ I , NĂM HỌC 2015-2016 MÔN: HÓA HỌC 9 Giới hạn chương trình: tuần 1 đến tuần 15 Nội dung kiến thức Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng Vận dụng ở mức cao hơn TN TL TN TL TN TL TN TL 1. Quan hệ giữa các loại hợp chất vô cơ: oxit, axit, bazơ, muối (tính chất và cách điều chế) -Biết tính chất hóa học của các hợp chất vô cơ. Nhận biết các loại hợp chất vô cơ - Dạng bài tập tính nồng độ Số câu hỏi 1 Câu 1 1 Câu 2 1 Câu 4 3 Số điểm 2.0 2.0 3.0 7.0 70% 2. Kim loại: Tính chất, Dãy hoạt động hóa học,Nhôm, Sắt Tính chất hóa học của kim loại Số câu hỏi 1 Câu 3 1 Số điểm 3.0 3.0 30% Tổng số câu Tổng số điểm 1 2.0 20% 1 2.0 20% 1 3.0 30% 1 3.0 30% 4 10.0 100% PHÒNG GD & ĐT VẠN NINH ĐỀ KIỂM TRA HỌC KÌ I, NĂM HỌC 2015- 2016 TRƯỜNG THCS HOA LƯ MÔN: HÓA HỌC 9 Thời gian làm bài: 45 phút ( Không kể thời gian phát đề) Đề kiểm tra đề nghị Câu 1: (2 điểm) Viết phương trình hóa học của các phản ứng sau: Điphotpho pentaoxit và nước. Đồng (II) sunfat và natri hiđroxit. Bạc nitrat và axit clohiđric. Nhôm và dung dịch đồng (II) clorua. Câu 2: (2 điểm) Có 3 dung dịch không màu chứa trong 3 lọ riêng biệt gồm: H2SO4 loãng, Na2SO4, HCl. Nêu phương pháp hóa học để nhận biết từ dung dịch? Mô tả hiện tượng và viết phương trình hóa học xảy ra khi cho đinh sắt vào ống nghiệm chứa dung dịch CuSO4. Câu 3: (3 điểm) Viết các phương trình hóa học biểu diễn các chuyển đổi sau đây (ghi rõ điều kiện phản ứng nếu có): Al → Al2O3 → AlCl3 → Al(OH)3 → Al2O3 → Al → AlCl3. Câu 4: (3 điểm) Cho 20 (ml) dung dịch K2SO4 2M vào 30 (ml) dung dịch BaCl2 1M. Viết phương trình phản ứng xảy ra. Tính khối lượng kết tủa thu được. Tính nồng độ mol của các chất có trong dung dịch sau phản ứng (biết rằng thể tích dung dịch thay đổi không đáng kể)? HƯỚNG DẪN CHẤM ĐỀ KIỂM TRA HỌC KÌ I, MÔN HÓA HỌC 9 NĂM HỌC 2015- 2016 Câu 1: P2O5 + 3H2O ->2 H3PO4 CuSO4 + 2NaOH -> Na2SO4-> Cu(OH)2 AgNO3 +HCl -> AgCl + HNO3 2Al + 3CuCl2 -> 2AlCl3 + 3Cu Mỗi phương trình đúng được 0, 5 điểm Câu 2: Chiết mẫu thử, cho quỳ tím vào 3 lọ 2 lọ làm quỳ tím hóa đỏ là HCl và H2SO4 Nhận biết Na2SO4 0.25 điểm Dung BaCl2 nhận biết H2SO4 có kết tủa trắng BaCl2 + H2SO4 -> BaSO4 + 2HCl 0.5 điểm Chất còn lại là HCl 0.25 điểm Câu 3: 4Al +3 O2 –t0→ 2Al2O3 Al2O3 + 6HCl→2 AlCl3 + 3H2O AlCl3 +3NaOH → Al(OH)3 + 3NaCl 2Al(OH)3 –t0→ Al2O3 + 3H2O→ Al → AlCl3 2Al2O3 -đpnc(criolit)→ 4Al + 3O2 2Al + 3Cl2→2 AlCl3 Mỗi phương trình đúng được 0,5 điểm, hs dùng cách khác vẫn đạt điểm tối đa Câu 4: K2SO4 + BaCl2 -> BaSO4 + 2KCl 0.5 điểm 1 mol 1mol 1 mol 2 mol 0.5 điểm 0.03mol 0.03mol 0.03mol 0.06mol nK2SO4=0.02x2=0.04 mol 0.25 điểm nBaCl2=1x0.03=0.03 mol 0.25 điểm =>số mol của K2SO4 dư nBaSO4=0.03mol mBaSO4=0.03x233=6.69g 0.5điểm CMKCl=0.06/0.05=1.2M 0.5 điểm CMK 2SO4 dư =0.01/0.05=0.2M 0.5 điểm
Tài liệu đính kèm:
 kiem_tra_HKI_nam_hoc_20152016.doc
kiem_tra_HKI_nam_hoc_20152016.doc





