Đề kiểm tra học kì I môn: Hóa học khối 9
Bạn đang xem tài liệu "Đề kiểm tra học kì I môn: Hóa học khối 9", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
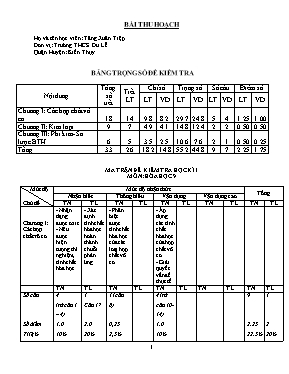
BÀI THU HOẠCH Họ và tên học viên: Tăng Xuân Tiệp Đơn vị: Trường THCS Du Lễ Quận Huyện: Kiến Thụy BẢNG TRỌNG SỐ ĐỀ KIỂM TRA Nội dung Tổng số tiết Tiết LT Chỉ số Trọng số Số câu Điểm số LT VD LT VD LT VD LT VD Chương I: Các hợp chất vô cơ 18 14 9.8 8.2 29.7 24.8 5 4 1.25 1.00 Chương II: Kim loại 9 7 4.9 4.1 14.8 12.4 2 2 0.50 0.50 Chương III: Phi kim- Sơ lược BTH 6 5 3.5 2.5 10.6 7.6 2 1 0.50 0.25 Tổng 33 26 18.2 14.8 55.2 44.8 9 7 2.25 1.75 MA TRẬN ĐỀ KIỂM TRA HỌC KÌ I MÔN: HÓA HỌC 9 Mức độ Chủ đề Mức độ nhận thức Tổng Nhận biết Thông hiểu Vận dụng Vận dụng cao TN TL TN TL TN TL TN TL TN TL Chương I: Các hợp chất vô cơ - Nhận dạng được oxit - Nêu được hiện tượng thí nghiệm, tính chất hóa học - Xác định tính chất hóa học hoàn thành chuỗi phản ứng. - Phân biệt được tính chất hóa học của các loại hợp chất vô cơ. - Áp dụng các tính chất hóa học của hợp chất vô cơ - Giải quyết vấn đề thực tế TN TL TN TL TN TL TN TL TN TL Số câu Số điểm Tỉ lệ% 4 (từ câu 1 – 4) 1.0 10% 1 Câu 17 2.0 20% 1 (câu 8) 0,25 2,5% 4 (từ câu 10- 14) 1.0 10% 9 2.25 22.5% 1 2 20% Chương II: Kim loại - Xác định được mức độ hoạt động của kim loại. - Nêu được tính chất vật lí của kim loại. - Áp dụng tính chất hóa học phân biệt các chất - Áp dụng tính chất hóa học tinh chế chất - Tính phần trăm khối lượng chât. - Vận dụng tổng hợp kiến thức, kĩ năng để giải bài toán liên quan đến thực tiễn nhằm PTNL học sinh TN TL TN TL TN TL TN TL TN TL Số câu Số điểm Tỉ lệ% 2 (từ câu 5 – 6) 0,5 5% 1 Câu18 2.0 20% 2 (từ câu 14-15) 0.5 5% 1 Câu19 2.0 20% 4 1.0 10% 2 4.0 40% Chương III: Phi kim - Nêu được tính chất hóa học của phi kim. - Dùng tính chất hóa học giải quyết một tình huống. - Dùng tính chất hóa học xác định chất trong phản ứng. TN TL TN TL TN TL TN TL TN TL Số câu Số điểm Tỉ lệ% 1 (câu 7) 0,25 2,5% 1 (câu9) 0,25 2,5% 1 (câu 16) 0.25 2.5% 3 0,75 7,5% Tổng câu 7 1 2 1 7 1 16 3 Tổng điểm 1.75 2.0 0.5 2.0 1.75 2.0 4.0 6.0 ĐỀ KIỂM TRA HỌC KÌ I MÔN: HÓA HỌC 9 Phần 1: Trắc nghiện khách quan (4,0 điểm) A. MỨC ĐỘ BIẾT I. Các hợp chất vô cơ Câu 1: Chất nào là oxit axit? A. CO. B. SO2. C. CaO. D. Fe2O3. Câu 2: Nhỏ 3 – 4 giọt dung dịch BaCl2 vào ống nghiệm đựng dung dịch H2SO4 loãng. Quan sát thấy xuất hiện kết tủa có màu A. vàng. B. xanh lam. C. đen. D. trắng. Câu 3: Dung dịch NaOH tác dụng với chất nào sau đây? A. CaO. B. HCl. C. KOH. D. NaCl. Câu 4: Dung dịch làm đổi màu quỳ tím thành màu xanh là A. NaOH. B. HCl. C. NaCl. D. H2SO4. II. Kim loại Câu 5: Dãy các kim loại được sắp xếp theo chiều giảm dần mức độ hoạt động hóa học là A. K, Na, Al, Fe, Cu. B. Na, Mg, Cu, Ag, Fe. C. Mg, K, Fe, Zn, Pb. D. Al, Zn, Na,Pb, Ag. Câu 6: Kim loại dẫn điện tốt nhất là A. Ag. B. Al. C. Cu. D. Fe. III. Phi kim Câu 7 : Chất khí làm mất màu giấy quỳ tím ẩm là A. CO2. B. O2. C. Cl2. D. SO2 . B. MỨC ĐỘ HIỂU I. Các hợp chất vô cơ Câu 8: Cho các cặp chất sau: (1) BaO và H2O (4) Fe3O4 và dd HCl (2) CuO và SO2 (5) Al2O3 và dd NaOH (3) SiO2 và H2O (6) Na2O và SO3 Số cặp chất không xảy ra phản ứng hóa học là A. 4 B. 5 C. 3 D. 2 II. Kim loại III. Phi kim Câu 9: Không khí trong phòng thí nghiệm bị ô nhiễm bởi khí Clo. Để khử độc hiệu quả, có thể xịt vào không khí dung dịch A. Nước đường. B. Axit sunfuric loãng. C. Nước vôi trong. D. Nước muối loãng. C. MỨC ĐỘ VẬN DỤNG I. Các hợp chất vô cơ Câu 10: Trong thực tế để làm sạch lớp cặn trong dụng cụ đun và chứa nước nóng, người ta có thể dùng dung dịch A. Nước vôi trong. B. Giấm ăn hoặc nước cốt chanh. C. Nước muối loãng. D. Rượu loãng. Câu 11: Dãy gồm các chất tác dụng được với dung dịch axit HCl là: A. CuO, Fe(OH)3, CO. B. Al2O3, CO2, Ca(OH)2. C. NaOH, NO, K2O. D. KOH, Al, Fe2O3. Câu 12: Cặp chất dùng điều chế khí CO2 trong phòng thí nghiệm là A. CaCO3 và HCl. B. Ca(OH)2 và Na2CO3. C. CaO và H2SO4. D. Ca(HCO3)2 và NaOH. Câu 13: Cặp chất không xảy ra phản ứng là A. NaCl và Cu(NO3)2. B. FeCl3 và NaOH. C. H2SO4 và BaCO3. D. K2CO3 và CaCl2. II. Kim loại Câu 14: Muối Cu(NO3)2 có lẫn muối AgNO3. Kim loại được sử dụng để làm sạch muối Cu(NO3)2 là A. Fe. B. Al. C. Cu. D. Ag. Câu 15: Hòa tan hoàn toàn 17,6 gam hỗn hợp X gồm 2 kim loại Fe và Cu vào dung dịch H2SO4 loãng thu được 4,48 lít khí H2 ở đktc. % về khối lượng của Fe trong hỗn hợp là A. 63,6% B. 31,8% C. 42,4% D. 36,4% III. Phi kim to to Câu 16:Cho các phản ứng sau: to to (a) C + O2 ® (b) CO + O2 ® đpdd to (c) Na + H2O ® (d) KClO3 ® to (e) KMnO4 ® (f) NaCl + H2O ® (g) HCl(nóng, đặc) + MnO2 ® (h) CaCO3 ® Số phản ứng sinh ra đơn chất khí là A. 7. B. 6. C. 5. D. 4. Phần 2: Tự luận (6 điểm) C©u 17 (2,0 ®iÓm): ViÕt PTHH thùc hiÖn sù chuyÓn ho¸ sau, ghi râ §KP¦ nÕu cã ? (1) Fe FeCl3 Fe(OH)3 Fe2O3 Fe Câu 18 (2,0 ®iÓm): Có 4 kim loại là nhôm, sắt, đồng và bạc. Trình bày phương pháp hoá học để nhận biết từng kim loại. Câu 19 (2,0 ®iÓm): Nhà máy thép Thái Nguyên đã sử dụng quặng hematit nâu (Fe2O3. 2H2O) trong quá trình luyện thép. Để trong một ngày nhà máy sản xuất được một tấn thép (98% Fe) thì lượng quặng hematit nâu cần dùng là bao nhiêu. Biết rằng hàm lượng hematit nâu trong quặng là 80%. Hiệu suất của quá trình phản ứng là 93%. ĐÁP ÁN BIỂU ĐIỂM Phần 1: Trắc nghiệm khách quan (4.0 điểm) Mỗi câu chọn đúng: 0,25 điểm Câu 1 2 3 4 5 6 7 8 Đáp án B D B A A A C D Câu 9 10 11 12 13 14 15 16 Đáp án C B D A A C A C Phần 2: Tự luận (6,0 điểm) Câu 17 (2,0 ®iÓm): Mỗi PTHH đúng được 0,5 điểm. Nếu cân bằng sai hoặc thiếu điều kiện PƯ trừ 0,25 điểm mỗi PTHH sai. 1) 2Fe + 3Cl2 2FeCl3 2) FeCl3(dd) + 3NaOH(dd) Fe(OH)3 + 3NaCl 3) 2 Fe(OH)3 Fe2O3 + 3H2O 4) Fe2O3 + 3H2 2Fe + 3H2O Câu 18 (2,0 ®iÓm): Nhận ra được một kim loại được 0,5 điểm. - Đánh số và chia nhỏ mẫu. - Tiến hành thí nghiệm nhận biết, ta có bảng hiện tượng sau: Chất nhận biết Thuốc thử Ag Cu Al Fe Dd NaOH ------------------ ------------------ ------------------ Dd HCl ------------------ ---------------- Dd AgNO3 ------------------ màu đỏ, dd có màu xanh - PTPƯ: 1) 2Al + 2H2O + 2NaOH 2NaAlO2 + 3H2 2) Fe + 2HCl FeCl2 + H2 3) Cu + 2AgNO3(dd) Cu(NO3)2 + 2Ag C©u 19 (2,0 ®iÓm): Khối lượng sắt chứa trong 1 tấn thép: = 0,98 (tấn) 0,5 điểm Khối lượng Fe2O3. 2H2O có chứa 0,98 tấn Fe: = 1,715 (tấn) 0,5 điểm Khối lượng quặng hematit nâu chứa 80% Fe2O3. 2H2O cần lấy: = 2,14375 (tấn) Khối lượng quặng thực tế cần dùng là (2,14375.100):93=2,305 (tấn) 0,5 điểm 0,5 điểm
Tài liệu đính kèm:
 DE_KTHKI_HOA_9.docx
DE_KTHKI_HOA_9.docx





