Đề kiểm tra học kì I môn: hóa học 11, chương trình : Nâng cao năm học : 2014-2015
Bạn đang xem tài liệu "Đề kiểm tra học kì I môn: hóa học 11, chương trình : Nâng cao năm học : 2014-2015", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
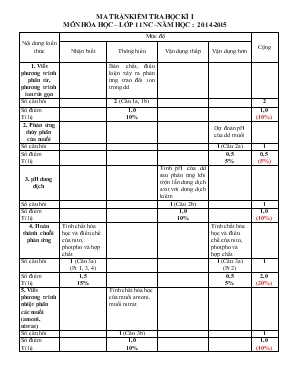
MA TRẬN KIỂM TRA HỌC KÌ I MÔN HÓA HỌC – LỚP 11 NC –NĂM HỌC : 2014-2015 Nội dung kiến thức Mức độ Cộng Nhận biết Thông hiểu Vận dụng thấp Vận dụng hơn 1. Viết phương trình phân tử, phương trình ion rút gọn Bản chất, điều kiện xảy ra phản ứng trao đổi ion trong dd Số câu hỏi 2 (Câu 1a, 1b) 2 Số điểm Tỉ lệ 1,0 10% 1,0 (10%) 2. Phản ứng thủy phân của muối Dự đoán pH của dd muối Số câu hỏi 1 (Câu 2a) 1 Số điểm Tỉ lệ 0,5 5% 0,5 (5%) 3. pH dung dịch Tính pH của dd sau phản ứng khi trộn lẫn dung dịch axit với dung dịch kiềm Số câu hỏi 1 (Câu 2b) 1 Số điểm Tỉ lệ 1,0 10% 1,0 (10%) 4. Hoàn thành chuỗi phản ứng Tính chất hóa học và điều chế của nito, photpho và hợp chất Tính chất hóa học và điều chế của nito, photpho và hợp chất Số câu hỏi 1 (Câu 3a) (Pt 1, 3, 4) 1 (Câu 3a) (Pt 2) 1 Số điểm Tỉ lệ 1,5 15% 0,5 5% 2,0 (20%) 5. Viết phương trình nhiệt phân các muối (amoni, nitrat) Tính chất hóa học của muối amoni, muối nitrat Số câu hỏi 1 (Câu 3b) 1 Số điểm Tỉ lệ 1,0 10% 1,0 (10%) 6. Phân biệt các dung dịch mất nhãn Dựa vào tính chất đặc trưng của từng hợp chất để phân biệt các chất mất nhãn Số câu hỏi 1 (Câu 4) 1 Số điểm Tỉ lệ 1,5 15% 1,5 (15%) 7. Bài toán: Hỗn hợp 2 kim loại tác dụng với dung dịch HNO3 Viết phương trình phản ứng xảy ra Tính % khối lượng của kim loại trong hỗn hợp Tính khối lượng dung dịch HNO3 phản ứng Tính khối lượng kết tủa thu được khi cho dung dịch muối tác dụng dung dịch NH3 Số câu hỏi 1 (Câu 5a) 1 (Câu 5b) 1 (Câu 5c) 1 (Câu 5d) 4 Số điểm Tỉ lệ 0,5 5% 1,0 10% 0,5 5% 1,0 10% 3,0 (30%) Tổng số câu Tổng số điểm Tỉ lệ 2 2,0 (20%) 3 3,0 (30%) 3 3,0 (30%) 3 2,0 (20%) 11 10,0 (100%) SỞ GD-ĐT NINH THUẬN TRƯỜNG THPT THÁP CHÀM ---------------------------- ĐỀ KIỂM TRA HỌC KÌ I MÔN: HÓA HỌC 11, Chương trình : NÂNG CAO NĂM HỌC : 2014-2015 Thời gian làm bài : 45 phút (Không kể thời gian phát, chép đề) Đề : Câu 1: (1,0 điểm) Viết phương trình phân tử và phương trình ion rút gọn của các phản ứng xảy ra (nếu có) trong dung dịch giữa các cặp chất sau: a) FeCl3 + NaOH b) Na2S + HCl Câu 2: (1,5 điểm) a) (0,5 điểm) Cho biết dung dịch K2CO3 có pH lớn hơn, nhỏ hơn hay bằng 7 ? b) (1,0 điểm) Trộn 500 ml dung dịch HNO3 0,02M với 500ml dung dịch NaOH 0,018M. Tính pH của dung dịch sau phản ứng. Câu 3: (3,0 điểm) a) (2,0 điểm) Viết các phương trình hóa học theo sơ đồ sau: b) (1,0 điểm) Viết phản ứng nhiệt phân các muối sau: NH4Cl, Cu(NO3)2 Câu 4: (1,5 điểm) Bằng phương pháp hoá học, hãy phân biệt các dung dịch chứa trong các lọ mất nhãn sau: Na3PO4, KNO3, NH4NO3, KCl. Viết các phương trình phản ứng xảy ra (nếu có). Câu 5: (3,0 điểm) Hòa tan hoàn toàn 21,9 gam hỗn hợp Al, Cu trong dung dịch HNO3 loãng 31,5% vừa đủ thu được dung dịch A và 6,72 lít (ở đktc) một khí không màu, hóa nâu trong không khí. a) Viết phương trình phản ứng xảy ra. (0,5 điểm) b) Tính thành phần % khối lượng mỗi kim loại trong hỗn hợp. (1,0 điểm) c) Tính khối lượng dung dịch HNO3 phản ứng. (0,5 điểm) d) Cho dung dịch NH3 dư vào dung dịch A. Tính khối lượng kết tủa thu được. (1,0 điểm) (Biết nguyên tử khối: Al=27; Cu=64; Na=23; N=14; O=16; H=1) ..................HẾT................. Ghi chú: Học sinh không được sử dụng bảng tuần hoàn các nguyên tố hóa học LỜI GIẢI TÓM TẮT BIỂU ĐIỂM Câu 1: (1,0 điểm) a) FeCl3 + 3NaOH → Fe(OH)3 ¯+ 3NaCl Fe3+ + 3OH- → Fe(OH)3 0,25 0,25 b) Na2S + 2HCl → 2NaCl + H2S S2- + 2H+ → H2S 0,25 0,25 Câu 2: (1,5 điểm) a) K2CO3 → 2K+ + CO32- CO32- + H2O HCO3- + OH- dd có OH- → pH > 7 0,25 0,25 b) Số mol H+ = 0,02.0,5=0,01 mol Số mol OH- = 0,018.0,5=0,009 mol 0,25 H+ + OH- → H2O 0,25 [H+]=(0,01-0,009):1=0,001M pH=3 0,25 0,25 Câu 3: (3,0 điểm) a) (1) 4NO2 + O2 + 2H2O 4HNO3 (2) P + 5HNO3 H3PO4 + 5NO2 + H2O (3) H3PO4 + 3NaOH Na3PO4 + 3H2O (4) Na3PO4 + 3AgNO3 Ag3PO4 + 3NaNO3 0,5 0,5 0,5 0,5 b) NH4Cl HCl + NH3 2Cu(NO3)2 2CuO + 4NO2 + O2 0,5 0,5 Câu 4: (1,5 điểm) * Đánh STT mỗi lọ, trích mỗi lọ một ít ra làm thí nghiệm * Cho dung dịch AgNO3 lần lượt vào 4 dung dịch trên - Nếu có kết tủa trắng là dd KCl KCl + AgNO3 AgCl ¯ + KNO3 - Nếu có kết tủa vàng là dd Na3PO4 Na3PO4 + 3AgNO3 Ag3PO4 ¯ + 3NaNO3 * Cho dung dịch NaOH lần lượt vào 2 dung dịch còn lại - Nếu có khí mùi khai thoát ra là dd NH4NO3 NaOH + NH4NO3 NaNO3+ NH3 + H2O - Còn lại là dd KNO3. 0,25 0,25 0,25 0,25 0,25 0,25 Câu 5: (3,0 điểm) a) Al + 4HNO3 → Al(NO3)3 + NO + 2H2O 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O 0,25 0,25 b) Al + 4HNO3 → Al(NO3)3 + NO + 2H2O x 4x x x 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O y 8y/3 y 2y/3 Ta có 27x + 64y = 21,9 x + 2y/3 = 0,3 x=0,1; y=0,3 % mAl = = 12,33% % mCu =100% - 12,33% = 87,67% 0,25 0,25 0,25 0,25 c) Số mol HNO3 = 4x + (8y/3) = 4.0,1 + (8/3.0,3) =1,2 mol Khối lượng HNO3 = 1,3´63=75,6g Khối lượng dd HNO3 = =240g 0,25 0,25 d) Al(NO3)3 + 3NH3 +3H2O → Al(OH)3 ¯ + 3NH4NO3 Cu(NO3)2 + 2NH3 +2H2O → Cu(OH)2 ¯ + 2NH4NO3 Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2 Kết tủa thu được : Al(OH)3 Khối lượng kết tủa= 78.0,1=7,8g 0,25 0,25 0,25 0,25
Tài liệu đính kèm:
 Hoa _NC_(THAPCHAM)hkI-11.doc
Hoa _NC_(THAPCHAM)hkI-11.doc





