Đề kiểm tra giữa kì I – Năm 2016 - 2017 môn: Hóa 10
Bạn đang xem tài liệu "Đề kiểm tra giữa kì I – Năm 2016 - 2017 môn: Hóa 10", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
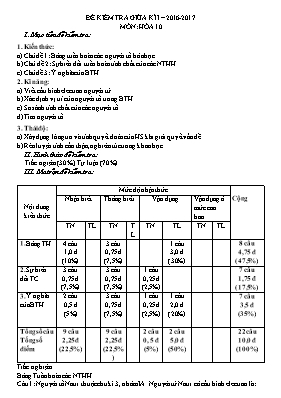
ĐỀ KIỂM TRA GIỮA KÌ I – 2016-2017 MÔN: HÓA 10 I. Mục tiêu đề kiểm tra: 1. Kiến thức: a) Chủ đề 1: Bảng tuần hoàn các nguyên tố hóa học b) Chủ đề 2: Sự biến đổi tuần hoàn tính chất của các NTHH c) Chủ đề 3: Ý nghĩa của BTH 2. Kĩ năng: a) Viết cấu hình electron nguyên tử b) Xác định vị trí của nguyên tố trong BTH c) So sánh tính chất của các nguyên tố. d) Tìm nguyên tố 3. Thái độ: a) Xây dựng lòng tin và tính quyết đoán của HS khi giải quyết vấn đề. b) Rèn luyện tính cẩn thận, nghiêm túc trong khoa học. II. Hình thức đề kiểm tra: Trắc ngiệm (30%), Tự luận (70%) III. Ma trận đề kiểm tra: Nội dung kiến thức Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng Vận dụng ở mức cao hơn TN TL TN TL TN TL TN TL 1. Bảng TH 4 câu 1,0 đ (10%) 3 câu 0,75 đ (7,5%) 1 câu 3,0 đ (30%) 8 câu 4,75 đ (47,5%) 2. Sự biến đổi TC 3 câu 0,75 đ (7,5%) 3 câu 0,75 đ (7,5%) 1 câu 0,25 đ (2,5%) 7 câu 1,75 đ (17,5%) 3. Ý nghĩa của BTH 2 câu 0,5 đ (5%) 3 câu 0,75 đ (7,5%) 1 câu 0,25 đ (2,5%) 1 câu 2,0 đ (20%) 7 câu 3,5 đ (35%) Tổng số câu Tổng số điểm 9 câu 2,25 đ (22,5%) 9 câu 2,25 đ (22,5%) 2 câu 0, 5 đ (5%) 2 câu 5,0 đ (50%) 22 câu 10,0 đ (100%) Trắc nghiệm Bảng Tuần hoàn các NTHH Câu 1: Nguyên tố Natri thuộc chu kì 3, nhóm IA. Nguyên tử Natri có cấu hình electron là: a. 1s22s22p63s1 b. 1s22s22p63s2 c. 1s22s22p63s23p1 d. 1s22s22p63s23p6 Câu 2: Các nguyên tố xếp ở chu kì 4 có số lớp electron trong nguyên tử là: 4 3 2 5 Câu 3: Trong bảng tuần hoàn các nguyên tố, số chu kì nhỏ và số chu kì lớn lần lượt là: 3 và 4 3 và 3 4 và 4 4 và 3 Câu 4: Số nguyên tố trong chu kì 2 và chu kì 4 lần lượt là: 8 và 18 18 và 8 8 và 8 18 và 18 Câu 5: Nguyên tử của nguyên tố Agon có cấu hình electron: 1s22s22p63s23p6. Vị trí của agon trong bảng tuần hoàn là: Chu kì 3, nhóm VIIIA Chu kì 3, nhóm VIA Chu kì 3, nhóm IIIA Chu kì 3, nhóm VIIIB Câu 6: Tìm câu sai trong các câu sau: Bảng tuần hoàn có 7 chu kì. Số thứ tự của chu kì bằng số phân lớp electron trong nguyên tử Bảng tuần hoàn gồm các ô nguyên tố, các chu kì và các nhóm Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được sắp xếp theo chiều điện tích hạt nhân tăng dần Bảng tuần hoàn có 8 nhóm A và 8 nhóm B Câu 7: Trong bảng tuần hoàn, các nguyên tố được xếp theo chiều: a. Điện tích hạt nhân tăng dần b. Độ âm điện tăng dần c. Bán kính nguyên tử tăng dần d. Cấu hình electron lớp ngoài cùng tăng dần Sự biến đổi tuần hoàn tính chất của các nguyên tố trong bảng tuần hoàn Câu 8: Tính phi kim của dãy nguyên tố: Na(Z=11), Mg(Z=12), Al(Z=13), Si(Z=14), P(Z=15), S(Z=16), Cl(Z=17) biến đổi như thế nào theo chiều tăng dần của điện tích hạt nhân nguyên tử? tăng dần giảm dần không thay đổi vừa tăng vừa giảm Câu 9: Oxit cao nhất của một nguyên tố ứng với công thức R2O3. Nguyên tố R là: Al Mg Si P Câu 10: Trong một chu kì, bán kính nguyên tử của các nguyên tố biến đổi như thế nào? a. Tăng theo chiều tăng dần của tính kim loại b.Tăng theo chiều tăng dần của tính phi kim c.Tăng theo chiều tăng dần của điện tích hạt nhân d.Tăng theo chiều tăng dần của độ âm điện Câu 11: Theo quy luật bến đổi tính chất đơn chất của các nguyên tố trong bảng tuần hoàn thì: a. phi kim mạnh nhất là flo b. phi kim mạnh nhất là iot c. kim loại yếu nhất là xesi d. kim koại mạnh nhất là liti Câu 12: Độ âm điện của dãy các nguyên tố: F, Cl, Br, I biến đổi như thế nào theo chiều tăng dần của điện tích hạt nhân nguyên tử? giảm dần tăng dần không thay đổi vừa tăng vừa giảm Câu 13: Các nguyên tố thuộc cùng một nhóm A có tính chất hoá học tương tự nhau, vì vỏ nguyên tử của chúng có: a. số electron thuộc lớp ngoài cùng như nhau b. số electron như nhau c. số lớp electron như nhau d. cùng số electron s, p,d,f Câu 14: A, B là 2 nguyên tố thuộc cùng 1 phân nhóm và thuộc 2 chu kì liên tiếp trong BTH. Biết tổng số hạt proton của hai nguyên tố bằng 32. Số proton trong nguyên tử của A, B lần lượt là: a. 12, 20 b. 7, 25 c. 15, 17 d. 8, 24 Ý nghĩa của bảng tuần hoàn các NTHH Câu 15: Nguyên tử M có cấu hình electron của phân lớp ngoài cùng là 2p2. Tổng số electron của nguyên tử M là: 6 4 2 8 Câu 16: Nguyên tố X có cấu hình electron hoá trị là 3d104s2. Vậy trong bảng tuần hoàn, vị trí của X thuộc: a. Chu kì 4, nhóm IIB b. Chu kì 4, nhóm IIA c. Chu kì 4, nhóm VIIA d.Chu kì 4, nhóm VIIB Câu 17: Cho biết cấu hình electron của các nguyên tố X: 1s22s22p63s23p4; Y: 1s22s22p63s23p64s2; Z: 1s22s22p63s23p6. Nguyên tố nào là kim loại ? a. Y b. X c. Z d. X, Y, Z Câu 18: Hiđroxit nào là bazơ mạnh nhất? a. NaOH b. Mg(OH)2 c. Al(OH)3 d. LiOH Câu 19: Các nguyên tố nhóm A trong bảng tuần hoàn là: a. các nguyên tố s và p b. các nguyên tố s c. các nguyên tố d và f d. các nguyên tố p Câu 20: Nguyên tố X có hoá trị I trong hợp chất khí với hiđro. Trong hợp chất oxit cao nhất thì X chiếm 38,8% khối lượng. Công thức oxit cao nhất, hiđroxit tương ứng của X là: a. Cl2O7, HClO4 b. F2O7, HF c. Br2O7, HBrO4 d. Cl2O7, HCl TỰ LUẬN Câu 1: Nguyên tố Canxi thuộc chu kì 4, nhóm IIA trong bảng tuần hoàn. Hãy viết cấu hình electron nguyên tử của canxi? Cho biết nguyên tố lưu huỳnh có cấu hình phân lớp electron ngoài cùng là 3p4. Hãy xác định vị trí của lưu huỳnh trong bảng tuần hoàn? Từ vị trí của lưu huỳnh hãy cho biết tính chất cơ bản của lưu huỳnh (gồm: tính kim loại hay phi kim, công thức oxit cao nhất, công thức hợp chất khí với hidro, công thức hidroxit tương ứng) Câu 2: Khi cho 1,17 gam một kim loại nhóm kiềm tác dụng với nước tạo ra 336 ml khí hiđro ở ĐKTC. Xác định kim loại đó? (Cho biết nguyên tử khối của các nguyên tố: Li=7, Na=23, K=39, O=16, H=1, Cl=35,3) ĐÁP ÁN: Trắc nghiệm: a đúng Tự luận: Câu 1: a. Cấu hình Ca : 1s22s22p63s23p64s2 0,5 b. Vị trí S : - Ô thứ : 16 - chu kì 3 0,25 - nhóm VIA 0,25 c. - S là phi kim 0,5 - công thức oxit cao nhất : SO3 0,5 - Công thức với hidro: H2S 0,5 - Công thức hidroxit: H2SO4 0,5 Câu 2: PTHH : 2A + 2H2O à 2AOH + H2 0,5 Số mol khí H2 = 0,015(mol) 0,25 Số mol A= 0,03(mol) 0,25 MA = 39 0,5 A là Kali 0,5
Tài liệu đính kèm:
 de_kiem_tra_hoa_10.doc
de_kiem_tra_hoa_10.doc





