Đề kiểm tra 1 tiết môn Hóa học Lớp 11 (Cơ bản) - Đề 1
Bạn đang xem tài liệu "Đề kiểm tra 1 tiết môn Hóa học Lớp 11 (Cơ bản) - Đề 1", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
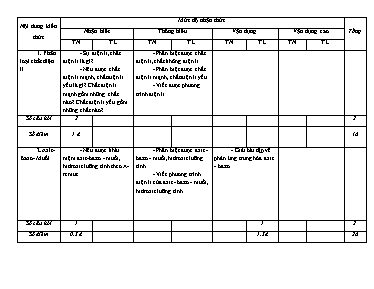
Nội dung kiến thức Mức độ nhận thức Tổng Nhận biết Thông hiểu Vận dụng Vận dụng cao TN TL TN TL TN TL TN TL 1. Phân loại chất điện li - Sự điện li, chất điện li là gì?. - Nêu được chất điện li mạnh, chất điện li yếu là gì? Chất điện li mạnh gồm những chất nào? Chất điện li yếu gồm những chất nào?. - Phân biệt được chất điện li, chất không điện li. - Phân biệt được chất điện li mạnh, chất điện li yếu. - Viết được phương trình điện li Số câu hỏi 2 2 Số điểm 1 đ 1đ 2.Axit- Bazo- Muối - Nêu được khái niệm axit -bazo - muối, hidroxit lưỡng tính theo A-reniut. - Phân biệt được axit - bazo - muối, hidroxit lưỡng tính. - Viết phương trình điện li của axit - bazo - muối, hidroxit lưỡng tính. . - Giải bài tập về phản ứng trung hòa axit - bazo. Số câu hỏi 1 1 2 Số điểm 0,5 đ 1,5đ 2đ 3. pH dung dịch - Nhận biết được môi trường của dung dịch dựa vào giá trị pH. - Nêu được ý nghĩa tích số ion của nước. - So sánh, sắp xếp pH của các dung dịch. - Tính nồng độ H+, OH-trong dung dịch. - Tính pH dung dịch axit, bazo. - Tính pH của dung dịch khi xảy ra phản ứng giữa axit - bazo. Số câu hỏi 2 3 5 Số điểm 1 đ 1,5đ 2,5đ 4. Phản ứng trao đổi ion trong dung dịch chất điện li - Nêu được điều kiện xảy ra phản ứng trao đổi ion trong dung dịch. - Xác định phản ứng trao đổi ion trong dung dịch có xảy ra không. - Viết phương trình phân tử và phương trình ion rút gọn. - Xác định các ion nào cùng tồn tại trong dung dịch. - Nhận biết được các chất. - giải các bài tập định lượng liên quan đến phản ứng trao đổi ion. - Áp dụng bảo toàn điện tích giải bài tập định lượng. Số câu hỏi 1 1 1 1 1 5 Số điểm 0,5đ 0,5đ 1đ 1,5đ 1đ 4,5đ Tổng số câu 6 4 1 2 1 14 Tổng số điểm 3đ 2đ 1đ 3đ 1đ 10đ ĐỀ KIỂM TRA (1 tiết) – Tiết 10: Hóa 11 cơ bản (Đề 1) Trắc nghiệm: ( 5 điểm) Câu 1 (B): Sự điện li là A. Sự phân li các chất thành các phân tử nhỏ hơn C. Sự phân li các chất thành các nguyên tử cấu tạo B. Sự phân li các chất thành ion trong nước D. Sự phân li các chất thành các chất đơn giản Câu 2 (B): Cho các chất sau: NaCl, HCl, HF, NaOH, Ca(OH)2, C2H5OH, CH3COOH, KBr, Fe2O3, BaCl2, H2O. Số chất điện li mạnh là. A. 5 B. 4 C. 6 D. 7 Câu 3 (B):Cho các muối sau : NaHSO4, NaHCO3, K2SO4, CaCl2 . Số muối thuộc loại muối axit là: A. 4. B. 1. C. 2. D. 3. Câu 4 (B): pH của dd A chứa HCl là: A. 10 B. 12 C. 4 D. 2 Câu 5 (B):Chọn câu nhận định sai trong các câu sau: A. Giá trị [H+] tăng thì giá trị pH tăng B. Dd mà giá trị pH > 7 có môi trường bazơ C. Dd mà giá trị pH < 7 có môi trường axit D. Dd mà giá trị pH = 7 có môi trường trung tính Câu 6 (B): Phương trình ion rút gọn của phản ứng cho biết A. Những ion nào tồn tại trong dung dịch. B. Nồng độ những ion nào trong dung dịch lớn nhất. C. Bản chất của phản ứng trong dung dịch các chất điện li. D. Không tồn tại phân tử trong dung dịch các chất điện li Câu 7 (H): Một dung dịch có nồng độ OH- = 1,5.10 -5 M. Môi trường của dung dịch này là: A. axit B. bazơ C. trung tính D. không xác định được Câu 8 (H): Đối với dung dịch axit yếu CH3COOH 0,10M, nếu bỏ qua sự điện li của nước thì đánh giá nào về nồng độ mol ion sau đây là đúng ? A. [H+] = 0,10M. B. [H+] < [CH3COO-]. C. [H+] > [CH3COO-]. D. [H+] < 0,10M. Câu 9 (H): Dãy các dd có cùng nồng độ mol sau được sắp xếp theo chiều tăng dần về độ pH: A. B. C. D. Câu 10 (H): Dãy gồm các ion có thể cùng tồn tại trong một dung dịch là A. Na+ , Ca2+ , Cl- , PO4 3- . B. Ba 2+ , Cu 2+ , NO3 - , SO4 2- . C. Zn2+ , K+ , Cl- , S2- . D. Al 3+ , Mg 2+ , SO4 2- , NO3 Tự luận: (5 điểm) Câu 1(H): (1,0 điểm) Viết phương trình phân tử và ion rút gọn NaOH + HCl -- > NH4Cl + AgNO3 - - > Câu 2 (VD): (1,5 điểm)Cho 50ml dd HCl 0,10 M tác dụng với 50ml dd NaOH 0,12 M thu được dd A.Cho quỳ tím vào dd A, quỳ có màu gì? Giải thích? Câu 3: (VD): (1,5 điểm) Trộn 100ml dung dịch H2SO4 20% (d=1,14g/ml) với 400g dung dịch BaCl2 5,2%. Tính khối lư ợng kết tủa tạo thành và % các chất trong dung dịch sau phản ứng? Câu 4 (VDC): (1 điểm)Có 500 ml dung dịch X chứa Na+, NH4+, CO32- và SO42-. Lấy 100 ml dung dịch X tác dụng với lượng dư dung dịch HCl thu 2,24 lít khí (đktc). Lấy 100 ml dung dịch X cho tác dụng với lượng dư dung dịch BaCl2 thấy có 43 gam kết tủa. Lấy 100 ml dung dịch X tác dụng với lượng dư dung dịch NaOH thu 4,48 lít khí NH3 (đktc). Tính lượng muối có trong 500 ml dung dịch X ? (cho Na = 23, H = 1, O = 16, N = 14, C = 12, S = 32, Ba = 137, Cl = 35,5) ----------------HẾT---------------- Đáp án Trắc Nghiệm 1B 2C 3C 4C 5A 6C 7B 8D 9B 10D Tự luận Câu Nội dung Điểm Câu 1: Viết đúng mỗi pt được 0,25 điểm Câu 2: nHCl = 0,005 mol, nNaOH = 0,006 mol = > NaOH dư vậy cho quỳ tím vào dung dịch chuyển quỳ tím chuyển màu xanh (1,5 điểm) Câu 3: nH2SO4 = 0,23 mol, nBaCl2 = 0,1 mol H2SO4 + BaCl2 - - >BaSO4 + 2HCl 0,1 0,1 0,1 0,2 nH2SO4 (dư) = 0,23 – 0,1 = 0,13mol C% H2SO4 (dư) = 2,59% C% HCl = 1,48% (0,5 điểm) (0,5 điểm) ( 0,5 điểm) Câu 4: Phản ứng của dung dịch X với dung dịch HCl : CO32- + H+ CO2 + H2O (1) mol: 0,1 0,1 Phản ứng của dung dịch X với dung dịch BaCl2 : CO32- + Ba2+ BaCO3 (2) mol: 0,1 0,1 SO42- + Ba2+ BaSO4 (3) mol: x x Theo (1), (2), (3) và giả thiết ta có : 0,1.197 + 233.x = 43 x = 0,1 Phản ứng của dung dịch X với dung dịch NaOH : NH4+ + OH- NH3 + H2O (4) mol: 0,2 0,2 Vậy theo các phương trình phản ứng và giả thiết ta thấy trong 100 ml dung dịch X có : 0,1 mol CO32-, 0,1 mol SO42-, 0,2 mol NH4+ và y mol Na+. Áp dụng định luật bảo toàn điện tích ta suy ra 0,1.2 +0,1.2 = 0,2.1 + y.1 y = 0,2. Khối lượng muối trong 500 ml dung dịch X là : (1điểm) IV. Tổng kết và hướng dẫn học tập
Tài liệu đính kèm:
 de_kiem_tra_1_tiet_mon_hoa_hoc_lop_11_co_ban_de_1.doc
de_kiem_tra_1_tiet_mon_hoa_hoc_lop_11_co_ban_de_1.doc






