Đề kiểm tra 1 tiết lần I môn: Hóa học 10 năm học 2014 – 2015
Bạn đang xem tài liệu "Đề kiểm tra 1 tiết lần I môn: Hóa học 10 năm học 2014 – 2015", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
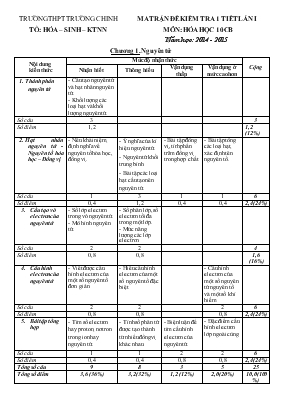
TRƯỜNG THPT TRƯỜNG CHINH TỔ: HÓA – SINH – KTNN MA TRẬN ĐỀ KIỂM TRA 1 TIẾT LẦN I MÔN: HÓA HỌC 10CB Năm học: 2014 - 2015 Chương 1. Nguyên tử Nội dung kiến thức Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng thấp Vận dụng ở mức cao hơn Thành phần nguyên tử - Cấu tạo nguyên tử và hạt nhân nguyên tử. - Khối lượng các loại hạt và khối lượng nguyên tử. Số câu 3 3 Số điểm 1,2 1,2 (12%) Hạt nhân nguyên tử - Nguyên tố hóa học – Đồng vị - Nêu khái niệm, định nghĩa về nguyên tố hóa học, đồng vị. - Ý nghĩa của kí hiệu nguyên tử. - Nguyên tử khối trung bình. - Bài tập các loại hạt cấu tạo nên nguyên tử. - Bài tập đồng vị,tính phần trăm đồng vị trong hợp chất. - Bài tập tổng các loại hạt, xác định tên nguyên tố. Số câu 1 3 1 1 6 Số điểm 0,4 1,2 0,4 0,4 2,4(24%) Cấu tạo vỏ electron của nguyên tử - Số lớp electron trong vỏ nguyên tử. - Mô hình nguyên tử. - Số phân lớp, số electron tối đa trong một lớp. - Mức năng lượng các lớp electron. Số câu 2 2 4 Số điểm 0,8 0,8 1,6 (16%) Cấu hình electron của nguyên tử - Viết được cấu hình electron của một số nguyên tố đơn giản. - Hiểu cấu hình electron của một số nguyên tố đặc biệt. - Cấu hình electron của một số nguyên tử nguyên tố và một số khí hiếm. Số câu 2 2 2 6 Số điểm 0,8 0,8 0,8 2,4(24%) Bài tập tổng hợp - Tìm số electron hay proton, nơtron trong ion hay nguyên tử. - Tính số phân tử được tạo thành từ nhiều đồngvị khác nhau. - Biện luận để tìm cấu hình electron của nguyên tử. - Đặc điểm cấu hình electron lớp ngoài cùng. Số câu 1 1 2 2 6 Số điểm 0,4 0,4 0,8 0,8 2,4(24%) Tổng số câu 9 8 3 5 25 Tổng số điểm 3,6 (36%) 3,2 (32%) 1,2 (12%) 2,0 (20%) 10,0(100%) TRƯỜNG THPT TRƯỜNG CHINH TỔ: HÓA – SINH – KTNN ĐỀ KIỂM TRA 1 TIẾT LẦN I Môn: Hóa Học 10CB Năm học 2014 – 2015 Mã đề thi 132 Họ, tên học sinh:..................................................................... Lớp: ....... Câu 1: Nguyên tử của 2 nguyên tố X, Y lần lượt có phân lớp ngoài cùng là 4px và 4sy. Biết số proton bằng số nơtron trong hạt nhân nguyên tử Y và X không phải là khí hiếm. X và Y là kim loại hay phi kim? A. X là kim loại, Y là phi kim. B. X, Y là kim loại. C. X là phi kim hoặc kim loại, Y là kim loại. D. X là phi kim, Y là kim loại. Câu 2: Trong nguyên tử, hạt mang điện là A. electron, nơtron B. proton, nơtron C. electron D. proton, electron Câu 3: Trong nguyên tử, lớp electron có mức năng lượng thấp nhất là: A. Lớp trong cùng B. Lớp ngoài cùng C. Tuỳ thuộc từng nguyên tử. D. Tất cả đều nhau Câu 4: Cho các phát biểu sau: 1. nhân của bất cứ nguyên tử nào cũng chứa proton và nơtron. 2. số proton của nguyên tử luôn luôn nhỏ hơn số nơtron của nguyên tử đó . 3. số proton của nguyên tử luôn luôn bằng số electron của nguyên tử đó A. Chỉ có 3 đúng B. Chỉ có 1 đúng C. 1,2,3 đều đúng D. Chỉ có 1,2 đúng Câu 5: Tính số loại phân tử SiO2 khác nhau có thể tạo thành từ hai đồng vị 28Si, 29Si với ba đồng vị 16O,17O,18O A. 10 B. 12 C. 14 D. 9 Câu 6: Trong các phát biểu dưới đây, phát biểu chưa đúng là: Trong một nguyên tử luôn luôn có số nơtron bằng số electron bằng số điện tích hạt nhân. Tổng số prôton và số nơtron trong một hạt nhân gọi là số khối. Số khối A là khối lượng tuyệt đối của nguyên tử. Số nơtron bằng điện tích hạt nhân. A. 2,3 B. 1, 3 C. 1,2,3 D. 1,3,4 Câu 7: Cho cấu hình electron của nguyên tử các nguyên tố: X: 1s2 2s2 2p1; Y: 1s2 2s2 2p6 3s2 3p4 ; Z:1s2 2s2 2p6 3s2 3p6 3d7 4s2 ; T: 1s22s22p2; M: 1s22s22p5 . Số nguyên tố phi kim là : A. X, T, M. B. X, Y, Z, T, M. C. T, M. D. Y, T, M. Câu 8: Cho biết sắt có số hiệu nguyên tử là 26. Cấu hình electron của ion Fe2+ là A. 1s22s22p63s23p63d54s1 B. 1s22s22p63s23p63d6 C. 1s22s22p63s23p63d44s2 D. 1s22s22p63s23p63d4 . Câu 9: Thứ tự của bốn lớp electron đầu tiên được ghi bằng các số nguyên, dương n = 1, 2, 3, 4 và kí hiệu (bằng các chữ cái) của chúng được xếp theo thứ tự tương ứng là: A. K, M, N, O. B. L, M, N, O C. M, N, O, P D. K, L, M, N Câu 10: Nguyên tử của nguyên tố R có 56 electron và 81 nơtron. Kí hiệu nào sau đây là của R. A. B. C. D. Câu 11: Một ion M3+có tổng số hạt proton, nơtron, electron là 79, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 19. Cấu hình electron của nguyên tử M là: A. [Ar]3d34s2. B. [Ar]3d54s1. C. [Ar]3d64s2. D. [Ar]3d64s1. Câu 12: Cho biết Kali có số hiệu nguyên tử là 19. Cấu hình electron của Kali là A. 1s22s22p63s23p54s2 B. 1s22s22p63s23p63d1 C. 1s22s22p63s23p64s1 D. 1s22s22p63s23p7 Câu 13: Số phân lớp và số electron tối đa của lớp N là: A. 3, 18 B. 3, 6 C. 4, 18 D. 4, 32. Câu 14: Chỉ ra cấu hình electron nguyên tử viết đúng: A. 1s22s22p63s23p63d2 (Z = 20). B. 1s22s22p63s23p63d6 (Z = 24) C. 1s22s22p63s23p63d104s1 (Z = 29) D. 1s22s22p63s23p64s23d6 (Z = 26) Câu 15: Cation R+ có cấu hình e ở lớp ngoài cùng là 2s22p6. Vậy cấu hình e của nguyên tử R là A. 1s22s22p5 B. 1s22s22p63s2 C. 1s22s22p63s23p1 D. 1s22s22p63s1 Câu 16: Số khối của nguyên tử bằng tổng A. số n và e B. số p và n C. tổng số n, e, p. D. số p và e Câu 17: Brom có hai đồngvị 79Br (chiếm 54,5%)và81Br. Nguyên tử khối trung bình của Br là: A. 80,01. B. 79,91. C. Đáp án khác. D. 79,19. Câu 18: Có hợp chất MX3 trong đó: tổng số hạt (p, n, e) trong phân tử là 196 và số hạt mang điện nhiều hơn số hạt không mang điện là 60. Khối lượng của nguyên tử X lớn hơn của nguyên tử M là 8 và tổng số 3 loại hạt trong ion X- nhiều hơn trong ion M3+ là 16.Hai nguyên tố M và X là: A. Al (Z=13) và Cl (Z=17) B. Al và Br C. Mg (Z=12) và Br (Z=35) D. Cr(Z=52) và Cl. Câu 19: Trong tự nhiên, nguyên tố clo có 2 đồng vị là 35Cl và 37Cl, nguyên tử khối trung bình là 35,50u. Thành phần % khối lượng của 37Cl chứa trong KClO3 là (cho K = 39, O = 16). A. 7,55% B. 8,0% C. 8,5% D. 7,0% Câu 20: Số electron tối đa chứa trong các phân lớp s, p, d, f lần lượt là: A. 2, 6, 8, 18 B. 2, 8, 18, 32. C. 2, 4, 6, 8. D. 2, 6, 10, 14. Câu 21: Kí hiệu nguyên tử biểu thị đầy đủ đặc trưng cho một nguyên tử của một nguyên tố hóa học vì nó cho biết: A. số A và số Z B. số A C. nguyên tử khối của nguyên tử D. số hiệu nguyên tử Z Câu 22: Cấu hình electron lớp ngoài cùng của 2 nguyên tử A và B lần lượt là 2px và 3s2. Biết rằng phân lớp 2p của 2 nguyên tử A và B hơn kém nhau chỉ 2 electron. Hai nguyên tố A, B lần lượt là: A. F (Z=9) và Mg. B. O (Z=8) và Mg (Z=12). C. N(Z=7) và Mg. D. O và Na (Z=11). Câu 23: Tổng số hạt cơ bản (proton, nơtron, electron) của một nguyên tử X là 155. Số hạt mang điện nhiều hơn số hạt không mang điện là 33. Số khối của nguyên tử X là: A. 108. B. 122 . C. 66. D. 188 Câu 24: Cr(Z = 24) có cấu hình electron là A. [Ar] 3d6 B. [Ar] 3d44s2 C. [Ar] 3d54s1 . D. [Ar] 3d34s3 Câu 25: Dãy (trong số các dãy cho dưới đây) gồm các ion có cấu hình electron của khí hiếm A. Na+, O2-, Pb2+ B. Ca+, Cl-, Cu2+ C. K+, S2-, F- D. Be2+, Fe2+, Br- . ----------------------------------------------- ----------- HẾT ---------- TRƯỜNG THPT TRƯỜNG CHINH ĐÁP ÁN ĐỀ KIỂM TRA 1 TIẾT LẦN 1 TỔ: HÓA - SINH - KTNN MÔN: HÓA HỌC 10CB Năm học 2014-2015 CÂU ĐÁP ÁN CÁC MÃ ĐỀ 132 209 357 485 1 C B C B 2 D C D B 3 A B D C 4 A D B D 5 B B B D 6 D D D A 7 D A A B 8 B D B D 9 D B A B 10 B A C C 11 C B C A 12 C A B A 13 D C A D 14 C C A B 15 D D B C 16 B A D C 17 B A B D 18 A A D C 19 A D A B 20 D A A D 21 A C C B 22 B C C A 23 A C B A 24 C D C C 25 C B D A
Tài liệu đính kèm:
 Hoa_Ch_(TRUONGCHINH)1-10.doc
Hoa_Ch_(TRUONGCHINH)1-10.doc





