Đề cương ôn tập kỳ 2 môn Hóa học Lớp 8
Bạn đang xem tài liệu "Đề cương ôn tập kỳ 2 môn Hóa học Lớp 8", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
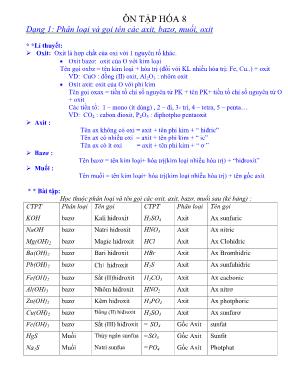
ÔN TẬP HÓA 8 Dạng 1: Phân loại và gọi tên các axit, bazơ, muối, oxit * *Lí thuyết: Oxit: Oxit là hợp chất của oxi với 1 nguyên tố khác. Oxit bazơ: oxit của O với kim loại Tên gọi oxbz = tên kim loại + hóa trị (đối với KL nhiều hóa trị: Fe, Cu..) + oxit VD: CuO : đồng (II) oxit, Al2O3 : nhôm oxit Oxit axit: oxit của O với phi kim Tên gọi oxax = tiền tố chỉ số nguyên tử PK + tên PK+ tiền tố chỉ số nguyên tử O + oxit Các tiền tố: 1 – mono (ít dùng) , 2 – đi, 3- tri, 4 – tetra, 5 – penta VD: CO2 : cabon đioxit, P2O5 : điphotpho pentaoxit Axit : Tên ax không có oxi = axit + tên phi kim + “ hiđric” Tên ax có nhiều oxi = axit + tên phi kim + “ ic” Tên ax có ít oxi = axit + tên phi kim + “ ơ ” Bazơ : Tên bazơ = tên kim loại+ hóa trị(kim loại nhiều hóa trị) + “hiđroxit” Muối : Tên muối = tên kim loại+ hóa trị(kim loại nhiều hóa trị) + tên gốc axit * * Bài tập: Học thuộc phân loại và tên gọi các oxit, axit, bazơ, muối sau (kẻ bảng) : CTPT Phân loại Tên gọi CTPT Phân loại Tên gọi KOH bazơ Kali hiđroxit H2SO4 Axit Ax sunfuric NaOH bazơ Natri hiđroxit HNO3 Axit Ax nitric Mg(OH)2 bazơ Magie hiđroxit HCl Axit Ax Clohiđric Ba(OH)2 bazơ Bari hiđroxit HBr Axit Ax Bromhiđric Pb(OH)2 bazơ Chì hiđroxit H2S Axit Ax sunfuhiđric Fe(OH)2 bazơ Sắt (II)hiđroxit H2CO3 Axit Ax cacbonic Al(OH)3 bazơ Nhôm hiđroxit HNO2 Axit Ax nitrơ Zn(OH)2 bazơ Kẽm hiđroxit H3PO4 Axit Ax photphoric Cu(OH)2 bazơ Đồng (II) hiđroxit H2SO3 Axit Ax sunfurơ Fe(OH)3 bazơ Sắt (III) hiđroxit = SO4 Gốc Axit sunfat HgS Muối Thủy ngân sunfua =SO3 Gốc Axit Sunfit Na2S Muối Natri sunfua =PO4 Gốc Axit Photphat PbS Muối Chì Sunfua - NO2 Gốc Axit Nitrit CuS Muối Đồng (II) sunfua = CO3 Gốc Axit Cacbonat Ag2S Muối Bạc Sunfua = S Gốc Axit Sunfua CaCO3 Muối Canxi cacbonat K3PO4 Muối Kali photphat K2CO3 Muối Kali cacbonat K2HPO4 Muối Kali hiđrophotphat Ba(HCO3)2 Muối Bari hiđrocacbonat CuSO4 Muối đồng (II) sunfat NaHCO3 Muối Natri hiđrocacbonat Al2(SO4)3 Muối Nhôm sunfat BaCO3 Muối Bari cacbonat KHSO4 Muối Kali hiđrosunfat MgCO3 Muối Magie cacbonat CaSO4 Muối Canxi sunfat NaCl Muối Natri clorua MgSO4 Muối Magie sunfat KCl Muối Kali clorua PbSO4 Muối chì sunfat AgCl Muối Bạc clorua Al(NO3)3 Muối Nhôm nitrat ZnCl2 Muối Kẽm clorua Ca(NO3)3 Muối Canxi nitrat FeCl2 Muối Sắt (II) clorua Fe(NO3)3 Muối Sắt(III) nitrat BaCl2 Muối Bari clorua KNO3 Muối Kali nitrat CuCl2 Muối Đồng (II) clorua Cu(NO3)2 Muối đồng (II) nitrat K2O Oxbz Kali oxit SO2 Oxax Lưu huỳnh đioxit FeO Oxbz Sắt (II) oxit SO3 Oxax Lưu huỳnh trioxit CuO Oxbz Đồng (II) oxit P2O5 Oxax Điphotpho pentaoxit Al2O3 Oxbz Nhôm oxit N2O Oxax đinitơ oxit ZnO Oxbz Kẽm oxit CO2 Oxax Cacbon đioxit PbO Oxbz Chì oxit CO Oxax Cacbon oxit Dạng 2: Tìm độ tan của một chất trong dung dịch * *Lí thuyết : * Công thức: 2 .100ct H O m S m Trong đó: S :độ tan (g) mct : khối lượng chất tan (g) mnước : khôi lượng nước (g) ** Bài tập: 1. Xác định độ tan của muối Na2CO3 trong nước ở 18 o C . Biết rằng ở nhiệt độ này khi hòa tan hết 53 gam Na2CO3 trong 250 gam nước thì thu được dd bão hòa. 2. Xác định số gam Na2CO3 cần đê hòa tan vào 150 gam nước ở 18 oC thu được dd bão hòa biết ở nhiệt độ này độ tan của Na2CO3 là 21,2 gam. Dạng 3: Nồng độ dung dịch ** Lí thuyết: dd % .100%ct m C m dd%. ; 100% ct C m m dd .100% % ctmm C Ngoài ra: mdd = mct + mdm M n C V . ;Mn C V M n V C Trong đó: C%: Nồng độ phần trăm của dd (%) ; mdd : khối lượng dd (g) ; mdm : khối lượng dung môi (g) CM: Nồng độ mol/l của dd (M); n: số mol chất tan (mol) mct : Khối lượng chất tan (g); V: thể tích dd (l) ** Bài tập: 1. Tính mct, n trong mỗi dd sau: a/ 200 g dd BaCl2 5%. b/ 500 ml dd Na2CO3 2M. c/ 2,5 lít dd K2SO4 0,3 M. d/ 50 g dd MgCl2 4%. e/ 250 ml dd CaCl2 0,1 M. f/ 3 lít dd NaCl 0,5 M. 2. Tính số gam chất tan cần dùng để pha chế mỗi dd sau: a/ 2,5 lít đ NaCl 0,9 M. b/ 250 ml dd MgSO4 0,1 M. 3. Tính nồng độ phần trăm của những dd sau: a/ 20 gam KCl trong 600 gam dd. c/ 2 gam MgCl2 trong 50 gam dd. b/ 32 gam K2CO3 trong 2kg dd. d/ 4,9 gam H2SO4 trong 10 gam dd. 4. Tính nồng độ mol của 850 ml dd có hòa tan 20 gam KNO3. 5. Ở 25oC , độ tan của muối ăn là 36 gam, của đường là 204 gam. Hãy tính nồng độ % của các dung dịch bão hào muối ăn và đường ở nhiệt độ trên. 6. Làm bay hơi 300 gam nước khỏi 700 gam dd muối 12 % thì thấy có 5 gam muối tách khỏi dd bão hòa. Hãy xác định nồng độ % của dd muối bão hòa trên ? Dạng 4: Tính theo PTHH kết hợp dạng lượng dư *** Các công thức chuyển đổi giữa n, m, M, V m = n. M ; m m n M M n V = n. 22,4 22,4 V n Trong đó: m : khối lượng (g); n :số mol (mol) M: khối lượng mol (g); V: thể tích khí đktc (l) *** Các bước làm: Bước 1: Đổi các số liệu bài toán đã cho ra số mol Bước 2: Viết các PTHH xảy ra, cân bằng. Bước 3: Tính số mol các chất còn lại theo phương trình. Bước 4: Tính theo yêu cầu bài toán. *** Lượng chất dư Bước 1: Đổi các số liệu bài toán đã cho ra số mol và kết hợp với số mol ở phần trên(ít nhất đề cho biết 2 số mol). Bước 2: Viết các PTHH xảy ra, cân bằng. Bước 3: Nhận xét và suy ra chất dư, chất hết. Bước 4: Viết lại phương trình và tính số mol các chất còn lại theo chất hết. Bước 5: Tính theo yêu cầu bài toán. *** Bài mẫu: Cho 5,6 gam Fe tác dụng với HCl thu được muối sắt (II) clorua và khí hiđro. a/ Tính khối lượng muối sắt (II) clorua thu được ? b/ Tính thể tích khí Hiđro ở đktc sinh ra ? c/ nếu dùng toàn bộ lượng hiđro bay ra ở trên đem khử 16 gam bột Fe2O3 ở nhiệt độ cao thì chất nào còn dư ? dư bao nhiêu gam ? Giải: Bước 1: e e e 5,6 0,1 56 F F F m n mol M Bước 2: PTHH: Fe + 2 HCl FeCl2 + H2 Bước 3: p/ư : 0,10,2 0,1 0,1 Bước 4: a/ 2 2 2e e . 0,1.127 12,7( )F Cl F Cl FeClm n M g b/ 2 2 .22.4 0,1.22,4 2,24( )H HV n l c/ (dạng lượng dư vì biết số mol 2 chất) bước 1: 2 3 2 3 2 3 e e e 16 0,1 160 F O F O F O m n mol M ; nH2 = 0,1 mol (ở trên) Bước 2: PTHH : 3H2 + Fe2O3 2Fe + 3H2O Bước 3: 3H2 + Fe2O3 2Fe + 3H2O Ban đầu: 0,1 0,1 0 0 P/ư: 0,1 0,1/3 0,2/3 Sau p/ư: 0 0,2 / 3 0,2/3 Vậy 2 3eF O m dư = 2 3eF O n dư . 2 3eF O M = 0,2/3.160 = 10,67(g) *** Bài tập tự làm: 1. Cho 13 gam kẽm tác dụng hoàn toàn với dd axit clohiđric dư. a/ Tính khối lượng muối kẽm clorua thu được ? b/ Tính thể tích khí Hiđro ở đktc sinh ra ? c/ nếu dùng toàn bộ lượng hiđro bay ra ở trên đem khử 12 gam bột CuO ở nhiệt độ cao thì chất nào còn dư ? dư bao nhiêu gam ? 2. Cho 19,5 gam kẽm tác dụng hoàn toàn với dd axit clohiđric vừa đủ. a/ Tính khối lượng muối kẽm clorua thu được ? b/ Tính thể tích khí Hiđro ở đktc sinh ra ? c/ nếu dùng hết lượng hiđro bay ra ở trên cho đi qua 32 gam bột Fe2O3 ở nhiệt độ cao thì chất nào còn dư ? dư bao nhiêu gam ? Tính khối lượng kim loại tạo thành sau phản ứng ? (gợi ý: kim laoị tạo thành chính là sắt) Dạng 5: Nhận biết các dd axit, bazơ, muối hoặc các khí ***Phương pháp: Nhận biết các dd thì dùng quì tím. Nhận biết các khí thường dùng ngọn lửa ( khí CO2 làm ngọn lửa tắt, khí H2 làm ngọn lửa chuyển sang màu xanh, khí O2 làm ngọn lửa cháy to hơn, không khí làm ngọn lửa cháy bình thường). *** Bài mẫu: 1. Bằng phương pháp hóa học nhận biết 3 dd đựng trong các lọ riêng biệt sau: NaCl, NaOH, H2SO4. ** Hướng dẫn: xác định chất NaOH có nhóm OH nên NaOH là bazơ (kiềm) (làm quì tím chuyển từ màu tím sang màu xanh). H2SO4 có nguyên tủ H đầu tiên nên là axit (làm quì tím chuyển từ màu tím sang màu đỏ). Chất còn lại NaCl là muối (quì tím giữ nguyên màu tím) ** Trình bày bài giải: Nhỏ lần lượt 3 dd trên vào 3 mẩu giấy quì tím khác nhau. Dd nào làm cho quì tím chuyển sang màu xanh thì đó là dd NaOH. DD nào làm cho quì tím chuyển sang màu đỏ thì đó là dd H2SO4. DD nào quì tím vẫn giữ nguyên màu thì đó là NaCl. 2. Bằng phương pháp hóa học nhận biết 3 dd đựng trong các lọ riêng biệt sau: muối, kiềm(bazơ), axit. 3. Bằng phương pháp hóa học nhận biết 3 dd đựng trong các lọ riêng biệt sau: Na2SO4, Ba(OH)2, HCl. 4. Bằng phương pháp hóa học nhận biết 4 khí đựng trong các lọ riêng biệt sau: không khí, oxi, cacbonic, hiđro. Dạng 6: Lập PTHH, xác định loại phản ứng,chất khử, chất oxi hóa, sự khử, sự oxi hóa Phản ứng hóa hợp là PƯHH trong đó từ nhiều chất tạo ra 1 chất mới. Vd: 4Al + 3O2 2Al2O3 Phản ứng phân hủy là PƯHH trong đó từ 1 chất ban đầu tạo ra nhiều chất mới. VD: 2KClO3 2KCl + 3O2 Phản ứng thế là phản ứng giữa đơn chất và hợp chất, trong đó nguyên tử đơn chất thay thế 1nguyên tử trong hợp chất. VD: Fe + 2HCl FeCl2 + H2 Phản ứng oxi hóa khử là PƯHH trong đó có sự nhường và nhận O (hoặc có O2 tham gia phản ứng). Chất khử là chất lấy O của chất khác. Chất oxi hóa là chất bị mất O. Sự khử là quá trình mất O. Sự oxi hóa là quá tình nhận thêm O. VD: FeO + H2 Fe + H2O Chất oxi hóa Chất khử *** Bài tập: Hãy lập PTHH (CB PTHH) và xác định xem các phản úng sau thuộc loại phản ứng hóa học nào đã học: 2 5 2 3 2 ,450 2 2 3 2 4 1. .... 2. .... 3. 4. e .... .... 5. .... .... oV O C Al O KClO O SO O SO F HCl Zn H SO 2 4 2 2 2 5 2 3 2 3 2 5 2 6. e eS 7. ................ ......... 8. 9. e ............. .......... 10. O .............. ........... 11. .......... F S F KMnO O P O P O F O H CaC P O H O Dạng 7 : Dạng lập CTHH và tính PTK ** Mẫu: Lập CTHH giữa Cu và SO4 Gọi CTHH : Cux(SO4)y Theo QTHT ta có : II. x = II. y Vậy CTHH là : CuSO4. ; PTK = NTKCu + NTKS + NTKO.4 = 64 + 32 + 16. 4 = 160 (đvC) ** Bài tập : hãy lập CTHH và tính PTK của a/ Fe (III) và SO4 d/ Al và NO3 b/ Na và Cl e/ H và S(II) c/ Fe (II) và OH f/ S(IV) và O Dạng 8 : Lí thuyết Học thuộc định nghĩa oxit, axit, bazơ, muối, phản ứng hóa hợp, phản ứng phân hủy, phản ứng thế, phản ứng oxi hóa khử, sự oxi hóa, dung dịch, dung dịch bão hòa, dung dịch chưa bão hòa... (các phần lí thuyết trong chuyên đề 1,2,3 )
Tài liệu đính kèm:
 de_cuong_on_tap_ky_2_mon_hoa_hoc_lop_8.pdf
de_cuong_on_tap_ky_2_mon_hoa_hoc_lop_8.pdf






