Ma trận đề thi Hóa 8 học Kì 1 (tiết 36) - Trường THCS Tân Tiến
Bạn đang xem tài liệu "Ma trận đề thi Hóa 8 học Kì 1 (tiết 36) - Trường THCS Tân Tiến", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
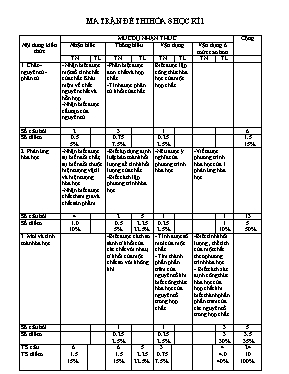
MA TRẬN ĐỀ THI HÓA 8 HỌC KÌ 1 Nội dung kiến thức MỨC ĐỘ NHẬN THỨC Cộng Nhận biết Thông hiểu Vận dụng Vận dụng ở mức cao hơn TN TL TN TL TN TL TN TL 1. Chất – nguyên tử - phân tử. - Nhận biết được một số tính chất của chất. Khái niệm về chất nguyên chất và hỗn hợp. -Nhận biết được cấu tạo của nguyên tử. -Phân biệt được đơn chất và hợp chất. -Tính được phân tử khối của chất. Biết được lập công thức hóa học của một hợp chất. Số câu hỏi 2 3 1 6 Số điểm 0.5 5% 0.75 7.5% 0.25 2.5% 1.5 15% 2. Phản ứng hóa học. -Nhận biết được sự biến đổi chất, sự biến đổi thuộc hiện tượng vật lí và hiện tượng hóa học. -Nhận biết được chất tham gia và chất sản phẩm. -Biết áp dụng định luật bảo toàn khối lượng để tính khối lượng của chất. -Biết cách lập phương trình hóa học. -Nêu được ý nghĩa của phương trình hóa học. -Viết được phương trình hóa học của 1 phản ứng hóa học. . Số câu hỏi 4 2 5 1 1 13 Số điểm 1.0 10% 0.5 5% 2.25 22.5% 0.25 2.5% 1 10% 5 50% 3. Mol và tính toán hóa học. -Biết được cách so sánh tỉ khối của các chất với nhau, tỉ khối của một chất so với không khí. - Tính được số mol của một chất. - Tìm thành phần phần trăm của nguyên tố khi biết công thức hóa học của nguyên tố trong hợp chất. -Biết tính khối lượng , thể tích của một chất theo phương trình hóa học. - Biết cách xác định công thức hóa học của hợp chất khi biết thành phần phần tram của các nguyên tố trong hợp chất. Số câu hỏi 1 1 3 5 Số điểm 0.25 2.5% 0.25 2.5% 3 30% 3.5 35% TS câu TS điểm 6 1.5 15% 6 1.5 15% 5 2.25 22.5% 3 0.75 7.5% 4 4.0 40% 24 10 100% Trường THCS Tân Tiến Họ và tên: Lớp:8. ĐỀ KIỂM TRA HÓA HỌC KÌ 1 Tiết :36 Thời gian: 45’ Tuần:18 Duyệt Điểm: Lời phê của thầy cô Mã đề:01 A.PHẦN TRẮC NGHIỆM : Thời gian 15 phút (4đ) I.Khoanh tròn các chữ cái A,B,C, D đầu mỗi ý trả lời đúng nhất cho các câu sau: Câu 1: Cấu tạo của nguyên tử gồm? Hạt nhân. B. Electron. C. Lớp vỏ. D. Hạt nhân và lớp vỏ. Câu 2: Tính chất nào sau đây cho ta biết đó là chất tinh khiết? Không tan trong nước. C. Không màu, không mùi. Khi đun thấy sôi ở nhiệt độ xác định. D. Có vị ngọt, mặn hoặc chua. Câu 3: Trong các dãy chất sau, dãy chất nào thuộc hợp chất? O2, SO3, CO2. B. H2, CO2, CH4. C. N2, H2O, SO2. D. H2O, SO2, CaO Câu 4: Biết Ba (II) và PO4 (III) vậy công thức hóa học đúng là? BaPO4. B. Ba3PO4. C. Ba3(PO4)2. D. Ba(PO4)2. Câu 5: Hiện tượng nào là hiện tượng vật lí ? Đập đá vôi sắp vào lò nung. C. Làm sữa chua. Muối dưa cải. D. Sắt bị gỉ. Câu 6: Cho phương trình: CaO + H2O→ Ca(OH)2. Chất tham gia là? CaO, Ca(OH)2. B. Ca(OH)2. C. H2O, Ca(OH)2. D. CaO, H2O. Câu 7: Đốt cháy 6.4g bột đồng trong không khí, thu được 8g đồng(II) oxit CuO. Khối lượng của oxi tham gia phản ứng là? 2.6g. B. 3.6g. C. 5.6g. D.1.6g. Câu 8: Khí lưu huỳnh đioxit SO2 nặng hơn hay nhẹ hơn so với khí oxi bao nhiêu lần? Nhẹ hơn 3 lần. B. Nhẹ hơn 2 lần. C. Nặng hơn 2 lần. D. Nặng hơn 3 lần. Câu 9: Hệ số cân bằng trong phản ứng : ?Al + ?HCl----- > ?AlCl3 + ?H2 lần lượt là? 6;1;2;1. B. 2;6;2;3. C. 2;1;2;6. D. 2;1;6;3. Câu 10: Số mol của 5.4g Nhôm là? 0.2mol. B. 0.1mol. C.0.3mol. D. 0.01mol. Câu 11: Để chỉ 3 phân tử Nitơ ta viết? 3N. B. 3N2. C. 3N3. D. 3N4. Câu 12: Dãy chất nào sau đây chỉ kim loại? Đồng, Bạc, Nhôm, Magie. C.Sắt, Hidro, Kẽm, bạc. Bạc, Oxi, Sắt, Nhôm. D.Sắt, Lưu huỳnh, Cacbon, Nhôm. II. Nối cột A với nội dụng ở cột B sao cho phù hợp. A. B. Trả lời 1. Cồn để trong lọ không kín bị bay hơi. 2. Đốt than trong không khí. 3. BaCO3 có phân tử khối bằng. 4. Nước cất là. a. Chất tinh khiết. b. 197 đvC. c. Hiện tượng vật lí. d. Hiện tượng hóa học. .... Trường THCS Tân Tiến Họ và tên: Lớp:8. ĐỀ KIỂM TRA HÓA HỌC KÌ 1 Tiết :36 Thời gian: 45’ Tuần:18 Duyệt Điểm: Lời phê của thầy cô Mã đề:02 A.PHẦN TRẮC NGHIỆM : Thời gian 15 phút (4đ) I.Khoanh tròn các chữ cái A,B,C, D đầu mỗi ý trả lời đúng nhất cho các câu sau: Câu 1: Nguyên tử Canxi có số electron là 20, vậy số proton là? 5. B. 10. C. 15. D. 20. Câu 2: Chất nào sau đây là chất tinh khiết? Nước suối. B. Nước cất. C. Nước khoáng. D. Nước đá. Câu 3: Trong các dãy chất sau dãy chất nào thuộc đơn chất? O2, H2, N2. B. CO2, H2 , H2O. C. N2, H2 , CO2. D. H2, O2, H2O. Câu 4: Cho công thức hóa học của X với oxi là XO, của Y với hidro là YH3. Vậy công thức hóa học của X với Y là. XY. B. XY2. C. X3Y2. D. X3Y. Câu 5: Hiện tượng nào sau đây là hiện tượng hóa học? Mặt trời mọc sương tan. C. Dây đồng được quấn thành dây dẫn điện. Sắt được tán nhỏ thành đinh. D. Làm cơm rượu. Câu 6: Cho phương trình: Na2CO3 + 2HCl→ 2NaCl + H2O + CO2. Chất sản phẩm là? Na2CO3, H2O.,CO2. C. Na2CO3, NaCl, HCl. HCl, H2O, NaCl. D. NaCl, HCl, CO2. Câu 7: Đốt cháy 6.2g phốt pho trong không khí thu được 7.1g điphotpho pentaoxit P2O5. Khối lượng oxi đã tham gia phản ứng là? 0.8g. B. 0.9g. C. 10g. D. 11g. Câu 8: Khí NO2 nặng hơn hay nhẹ hơn không khí bao nhiêu lần? Nhẹ hơn 1.59. B. Nhẹ hơn 1.8. C. Nặng hơn 1.59. D. Nặng hơn 1.8. Câu 9: Hệ số cân bằng của phản ứng: ?Fe2O3 + ?CO ----- > ?Fe + ?CO2 lần lượt là? 1;3;2;3. B. 1.2.3.3. C. 1;2;3;2. D. 1;3;3;2. Câu 10: Số mol của 12.8g Đồng là? 0.02mol. B. 0.01mol. C. 0.1mol. D. 0.2mol. Câu 11: Để chỉ 3 phân tử khí Clo ta viết? 3Cl. B. 3Cl2. C. 3Cl3. D.2Cl3. Câu 12: Dãy chất nào sau đây chỉ phi kim? Hidro, Oxi, Nitơ. B. Sắt, Oxi, Nitơ. C. Kẽm, Nhôm, Đồng. D. Sắt, Kẽm, Đồng. II. Nối cột A với nội dung ở cột B sao cho phù hợp. A. B. Trả lời 1. MgSO4 có phân tử khối bằng. 2. Sắt bị gỉ sét là 3. Hòa tan KMnO4 vào nước được dung dịch có màu tím. 4. Zn +2HCl → ZnCl2 + H2. a.Có 2 chất tham gia,2 chất sản phẩm. b. 120 đvC. c. Hiện tượng hóa học. d. Hiện tượng vật lí. B.PHẦN TỰ LUẬN. Thời gian 30 phút (6đ) Câu 1 ( 2 điểm): Lập phương trình của các phản ứng sau? a/ Al + H2SO4 -----> Al2(SO4)3 + H2. b/ Fe3O4 +CO---- > Fe + CO2. c/ CaCO3 + HCl ---- > CaCl2 + H2O + CO2. d/ P + O2 ----- > P2O5. Câu 2 ( 3 điểm) : Cho 11,2g sắt tác dụng hết với dung dịch axit clohidric HCl theo phương trình : Fe + HCl ----- > FeCl2 + H2. a/ Lập phương trình hóa học của phản ứng trên? b/ Tính khối lượng Sắt(II) clorua (FeCl2 ) tạo thành? c/ Tính thể tích khí hidro sinh ra (ở đktc)? Câu 3 (1 điểm): Một loại Mgie oxit có khối lượng mol phân tử là 40g/mol. Oxit này có thành phần phần trăm theo khối lượng là : 60% Mgie và 40% Oxi. Tìm công thức hóa học của oxit đó. Trường THCS Tân Tiến Họ và tên: Lớp:8. ĐỀ KIỂM TRA HÓA HỌC KÌ 1 Tiết :36 Thời gian: 45’ Tuần:18 Duyệt Điểm: Lời phê của thầy cô Mã đề:02 Trường THCS Tân Tiến Họ và tên: Lớp:8. ĐỀ KIỂM TRA HÓA HỌC KÌ 1 Tiết :36 Thời gian: 45’ Tuần:18 Duyệt Điểm: Lời phê của thầy cô Mã đề:01 B.PHẦN TỰ LUẬN. Thời gian 30 phút (6đ) Câu 1(2 điểm): Lập phương trình hóa học của các phản ứng sau? a/ Zn+ HCl ----- > ZnCl2 + H2. b/ Al(OH)3 ------ > Al2O3 + H2O. c/ Fe3O4 + CO ---- > Fe + CO2. d/ Al + O2 ---- > Al2O3. Câu 2 ( 3 điểm): Cho 4.8g kim loại Magie tác dụng hết với dung dịch axit clohidric HCl theo phương trình: Mg + HCl ----- > MgCl2 + H2. a/ Lập phương trình hóa học của phản ứng trên? b/ Tính khối lượng Magie clorua MgCl2 tạo thành? c/ Tính thể tích khí hidro sinh ra ( ở đktc)? Câu 3 ( 1 điểm): Một oxit của lưu huỳnh có thành phần phần trăm của lưu huỳnh là 50% và Oxi là 50%. Biết oxit này có khối lượng mol phân tử là 64g/mol. Hãy tìm công thức hóa học của oxit đó. Phần Câu Nội dung Biểu điểm Trắc nghiệm (4điểm) I. (1 → 12) (3 điểm) 1 2 3 4 5 6 7 8 9 10 11 12 D B D C A D D C B A B A Mỗi câu đúng được 0.25đ. II. điểm) 1 - c 2 – d 3 – b 4 – a Mỗi câu đúng được 0.25đ. Tự luận (6điểm) Câu 1 a/ 2Al + 3H2SO4 → Al2(SO4)3 + 3H2. b/ Fe3O4 + CO → 3Fe + 4CO2. c/ CaCO3 + HCl → CaCl2 + H2O + CO2. d/ 4P + 5O2 → 2P2O5. 0.5đ 0.5đ 0.5đ 0.5đ Câu 2 a/ Fe + 2HCl → FeCl2 + H2. b/ nFe = 11.2/56 = 0.2(mol). Fe + 2HCl → FeCl2 + H2. Theo PTHH 1 2 1 1 Theo bài 0.2 0.2 0.2 mol Khối lượng của Sắt(II) clorua : mFeCl2 = nFeCl2xM = 0.2x127 = 25.4g. c/ Thể tích của khí hidro sinh ra: VH2 = nH2 x V = 0.2 x 22.4 = 4.48(l). 1đ 0.25đ 0.25đ 0.5đ 1đ Câu 3 mMg = 60% x 40/100% = 24g.→nMg = mMg/M = 24/24 =1(mol) mO = 40% x 40/100% = 16g →nO = mO/m = 16/16 = 1(mol) Ta có tỉ lệ số mol trong 1 mol hợp chất: nMg : nO = 1 : 1 Vậy CTHH của hợp chất là MgO. 0.25đ 0.25đ 0.25đ 0.25đ ĐÁP ÁN ĐỀ 01 Phần Câu Nội dung Biểu điểm Trắc nghiệm (4 điểm) I.( 1→ 12) (3 điểm) 1 2 3 4 5 6 7 8 9 10 11 12 D B D C D A B C A D B A Mỗi câu đúng được 0.25 điểm. II.( 1 điểm) 1 – b 2 – c 3 – d 4 - a Mỗi câu đúng được 0.25điểm Tự luận (6 điểm) Câu 1 a/ Zn + 2HCl → ZnCl2 + H2. b/ 2Al(OH)3 → Al2O3 +3H2O. c/ Fe3O4 + 4CO → 3Fe + 4CO2. d/ 4Al + 3O2 → 2Al2O3. 0.5đ 0.5đ 0.5đ 0.5đ Câu 2 a/ Mg + 2HCl → MgCl2 + H2. b/ nMg = mMg/M = 4.8/24 = 0.2(mol). Mg + 2HCl → MgCl2 + H2. Theo PTHH 1 2 1 1 Theo bài 0.2 0.2 0.2 mol Khối lượng cảu Mgie clorua : mMgCl2 = nMgCl2 x m = 0.2 x 95 = 9(g). b/ Thể tích khí hidro sinh ra: VH2 = nH2 x V = 0.2 x 22.4 = 4.48(l). 1đ 0.25đ 0.25đ 0.5đ 1đ Câu 3 mS = 50% x 64/100% = 32(g) →nS = mS/M = 32/32 = 1mol. mO = 50% x 64/100% = 32(g) →nO = mO/M = 32/16 = 2mol Ta có tỉ lệ số mol trong 1 mol hợp chất: nS : nO = 1 : 2. Vậy CTHH của hợp chất là SO2. 0.25đ 0.25đ 0.25đ 0.25đ. ĐÁP ÁN ĐỀ 02
Tài liệu đính kèm:
 thihoa.doc.docx
thihoa.doc.docx





