Đề cương ôn tập học kì 1 - Hóa học 9
Bạn đang xem tài liệu "Đề cương ôn tập học kì 1 - Hóa học 9", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
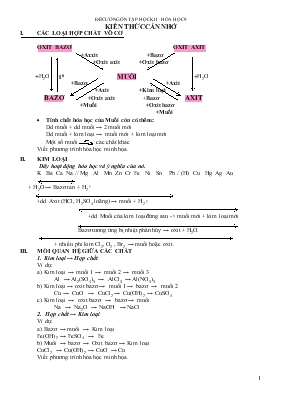
KIẾN THỨC CẦN NHỚ I. CÁC LOẠI HỢP CHẤT VÔ CƠ OXIT BAZƠ OXIT AXIT +Axxit +Bazơ +Oxit axit +Oxit bazơ +H2O t0 MUỐI +H2O +Bazơ +Axit +Axit +Kim loại BAZƠ +Oxit axit +Bazơ AXIT +Muối +Oxit bazơ +Muối Tính chất hóa học của Muối còn có thêm: Dd muối + dd muối → 2 muối mới Dd muối + kim loại → muối mới + kim loại mới Một số muối các chất khác Viết phương trình hóa học minh họa. II. KIM LOẠI Dãy hoạt động hóa học và ý nghĩa của nó. K Ba Ca Na // Mg Al Mn Zn Cr Fe Ni Sn Pb / (H) Cu Hg Ag Au + H2O → Bazơ tan + H2 ↑ +dd Axit (HCl, H2SO4 loãng) → muối + H2 ↑ +dd Muối của kim loại đứng sau -> muối mới + kim loại mới Bazơ tương ứng bị nhiệt phân hủy → oxit + H2O. + nhiều phi kim Cl2, O2 , Br2 → muối hoặc oxit. III. MỐI QUAN HỆ GIỮA CÁC CHẤT 1. Kim loại → Hợp chất Ví dụ: a) Kim loại → muối 1 → muối 2 → muối 3 Al → Al2(SO4)3 → AlCl3 → Al(NO3)3 b) Kim loại → oxit bazơ → muối 1 → bazơ → muối 2 Cu → CuO → CuCl2 → Cu(OH)2 → CuSO4 c) Kim loại → oxit bazơ → bazơ → muối Na → Na2O → NaOH → NaCl 2. Hợp chất → Kim loại Ví dụ: a) Bazơ → muối → Kim loại Fe(OH)2 → FeSO4 → Fe b) Muối → bazơ → Oxit bazơ → Kim loại CuCl2 → Cu(OH)2 → CuO → Cu Viết phương trình hóa học minh họa. CÂU HỎI VÀ BÀI TẬP ÔN THI HỌC KỲ I HÓA HỌC 9 Năm học 20013 – 2014 A. BÀI TẬP ĐỊNH TÍNH Câu 1: Viết phương trình hóa học thực hiện dãy biến hóa sau, ghi điều kiện nếu có: a/ FeCl2 → Fe(OH)2 → FeSO4 Fe Fe FeCl3 → Fe(OH)3 → Fe2O3 b/ Al2O3 → Al → Al2(SO4)3 → AlCl3 → Al(NO 3)3 → Al → NaAlO2 c/ S → SO2 → SO3 → H2SO4 → CuSO4 → Cu Câu 2: Có các chất sau, dựa vào mối quan hệ giữa các chất vô cơ lập các dãy biến hóa có thể thực hiện được. a/ Cu , Cu(OH)2 , CuO, CuSO4 b/ Al, AlCl3, Al(OH)3, Al2O3 Viết phương trình hoá học của phản ứng. Câu 3: Nhận biết các chất sau để riêng biệt bằng phương pháp hóa học: a/ dd: H2SO4, HCl, NaNO3, NaCl b/ chất rắn: Na2O, MgO, P2O5, Al2O3 c/ dd: NaOH, H2SO4, BaCl2, NaCl d/ bột: Al, Fe, Mg, Ag Câu 4: Nêu hiện tượng quan sát được và giải thích hiện tượng: a/ Cho đinh sắt vào dung dịch CuSO4 b/ Cho lá đồng vào dung dịch AgNO3 c/ Cho bột nhôm, bột sắt lần lượt vào các ống nghiệm chứa dung dịch HCl d/ Cho bột nhôm, bột sắt lần lượt vào các ống nghiệm chứa dung dịch NaOH Câu 5: Bổ túc các phương trình hoá học sau: 1) Mg + ... MgCl2 + .......... 2) ... + NaOH Na2CO3 + .. 3) CuSO4 + ... Cu(OH)2 + .......... 4) NaCl + ... AgCl + .... 5) Fe + ... FeSO4 + Cu 6) ZnSO4 + ... BaSO4 + .......... 7) K2CO3 + ... KCl + ... + ... 8) Cu + ... CuSO4 + ... + H2O 9) Al2O3 + HCl ..... + 10) NaOH + ... Na3PO4 + ................ Câu 6:a) Các chất nào trong các chất sau có thể tác dụng với dung dịch HCl: NaOH, Mg, Cu, K2SO4, AgNO3. b) Các chất nào trong các chất sau có thể tác dụng với dung dịch KOH: CuSO4, BaCl2, H3PO4, Fe. c) Các chất nào trong các chất sau có thể tác dụng với dung dịch FeSO4: Mg, BaCl2, Cu, Ca(OH)2, K2CO3. Viết PTHH của các phản ứng xảy ra. Câu 7: Cho các chất sau đây tác dụng với nhau từng đôi một. Ghi dấu (x) nếu xảy ra, dấu (o) nếu không xảy ra phản ứng: Chất dd H2SO4 loãng dd ZnCl2 dd Cu(NO3)2 Fe Al B. BÀI TẬP ĐỊNH LƯỢNG 1. Cho 24g CuO tác dụng vừa đủ với dd HCl 0.2M a. Viết PTHH và tính khối lượng muối tạo thành. b. Tính thể tích dd HCl tham gia phản ứng. 2. Cho 9.6g Mg tác dụng với 200g dd HCl (vừa đủ) a. Viết PTHH và tính thể tích khí Hidrô tạo thành (ĐKTC). b. Tính nồng độ % dd HCl tham gia phản ứng. 3. Cho 400ml dd NaOH 0.5M tác dụng vừa đủ với dd H2SO4 19.6% a. Viết PTHH và tính khối lượng muối tạo thành. b. Tính khối lượng dd H2SO4 tham gia phản ứng 4. Cho 150g dd Na2CO3 10,6% tác dụng vừa đủ với 500ml dd HCl a. Viết PTHH và tính thể tích chất khí tạo thành (ĐKTC). b. Tính nồng độ M dd HCl tham gia phản ứng. 5. Trung hòa dung dịch HCl có chứa 1,825 g HCl bằng dd Ca(OH)2 có chứa2,96 Ca(OH)2 a. Viết PTHH. Chất nào còn dư trong PTHH, tính khối lượng chất dư. b. Tính khối lượng muối tạo thành. 6. Cho 4,8g một kim loại hoá trị (II) tác dụng với dd HCl (dư). Sau PƯ thu được 19g muối. Xác định kim loại đó? 7.Cho 16,8g 1 kim loại hóa trị (III) tác dụng với khí Clo(dư). Sau PƯ thu được 48,75g muối. Xác định kim loại đó? 8. Cho 40g hỗn hợp gồm 2 kim loại Mg và Cu tác dụng với dung dịch H2SO4 dư, sau PƯ thu được 8,96 lít khí (ĐKTC ). Tính % về khối lượng các kim loại trong hỗn hợp ban đầu? 9. Cho 1,66g hỗn hợp gồm 2 kim loại Fe và Al tác dụng với dung dịch HCl dư, sau PƯ thu được 11,2 lít khí (ĐKTC ). Tính % về khối lượng các kim loại trong hỗn hợp ban đầu? 10. Cho 4,4 g hỗn hợp gồm Mg và MgO tác dụng với dung dịch HCl dư, sau PƯ thu được 2,24 lít H2 (ĐKTC) a. Viết PTHH, và tính TP% về khối lượng của các chất trong hỗn hợp b. Tính thể tích dung dịch HCl 2M tác dụng vừa đủ với hỗn hợp trên 11. Cho 5,6g Fe tác dụng 300 ml dd HCl 1M. a. Viết PTHH , chất nào còn dư trong PƯ trên? Tính khối lượng chất dư? b. Tính nồng độ M các chất còn lại sau PƯ?( Giả sử thể tích dd không đổi) 12. Cho 200g dd Ca(OH)2 7,4% tác dụng với 300g dd HCl 7,3% a. Viết PTHH. Chất nào còn dư trong PƯ? b. Tính nồng độ % của các chất còn lại sau PƯ? 13. Cho 200 ml dung dịch NaOH 8% có D = 1,15g/ml tác dụng với 380g dung dịch MgCl2 5%. a. Viết PTHH. Chất nào còn dư? Tính khối lượng chất dư? b. Tính khối lượng kết tủa tạo thành? Sau khi loại bỏ kết tủa,tính C% các chất còn lại sau PƯ. 14. Cho 63,5 g dung dịch muối Sắt Clorua 20% tác dụng với dung dịch AgNO3 dư thì tạo thành 28,7 g kết tủa. Hãy tìm CTHH của muối Sắt đã dùng. CHÚC CÁC EM HỌC TỐT ! SỞ GD & ĐÀO TẠO ĐỀ KIỂM TRA HỌC KÌ I LỚP 9 NĂM HỌC 2009-2010 QUẢNG TRỊ Khóa ngày 28 tháng 12 năm 2009 ĐỀ CHÍNH THỨC Môn: HÓA HỌC Thời gian : 45 phút (không kể thời gian phát đề) Câu 1: (2,5 điểm) Trình bày tính chất hóa học của lim loại và viết các phương trình phản ứng minh họa Câu 2: (2,0 điểm) Cho các chất: CO2 , Fe, NaOH, CaSO3 , chất nào phản ứng được với các chất sau: HCl, Ca(OH)2 . Hãy viết phương trình phản ứng xảy ra. Câu 3:(2,0 điểm) Hãy cho biết hiện tượng xảy ra trong các trường hợp sau và viết phương trình phản ứng: Nhỏ vài giọt dung dịch NaOH vào dung dịch FeCl3 Cho một đinh sắt vào dung dịch CuSO4 Nhỏ dung dịch BaCl2 vào dung dịch H 2SO4 . Cho Na vào nước có vài giọt phenolphtalein. Câu 4: (3 điểm) Viết phương trình phản ứng hoàn thành sơ đồ chuyển hóa sau: Al → Al2(SO4)3 → Al(OH)3 → Al2O3 → Al Câu 5: (1,5 điểm) Cho m gam hỗn hợp X gồm Al và Fe tác dụng hết với dung dịch HCl thu được 5,6 lít H2 (đktc). Cũng cho m gam hỗn hợp trên tác dụng với NaOH dư thì sau phản ứng còn 5,6 gam chất rắn. Tính thành phần phần trăm theo khối lượng của mỗi kim loại trong hỗn hợp X.
Tài liệu đính kèm:
 Deef_cuong_on_tap_hoa_9_ki_I.doc
Deef_cuong_on_tap_hoa_9_ki_I.doc





