Chuyên đề Lý thuyết và bài tập nguyên tử
Bạn đang xem tài liệu "Chuyên đề Lý thuyết và bài tập nguyên tử", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
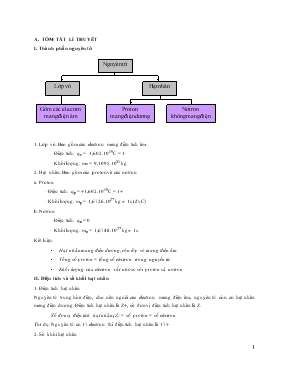
A. TÓM TẮT LÍ THUYẾT I. Thành phần nguyên tử Lớp vỏ Hạt nhân Gồm các electron mang điện âm Proton mang điện dương Nguyên tử Nơtron không mang điện 1. Lớp vỏ: Bao gồm các electron mang điện tích âm. - Điện tích: qe = -1,602.10-19C = 1- - Khối lượng: me = 9,1095.10-31 kg 2. Hạt nhân: Bao gồm các proton và các nơtron a. Proton - Điện tích: qp = +1,602.10-19C = 1+ - Khối lượng: mp = 1,6726.10-27 kg » 1u (đvC) b. Nơtron - Điện tích: qn = 0 - Khối lượng: mn = 1,6748.10-27 kg » 1u Kết luận: Hạt nhân mang điện dương, còn lớp vỏ mang điện âm Tổng số proton = tổng số electron trong nguyên tử Khối lượng của electron rất nhỏ so với proton và nơtron II. Điện tích và số khối hạt nhân 1. Điện tích hạt nhân Nguyên tử trung hòa điện, cho nên ngoài các electron mang điện âm, nguyên tử còn có hạt nhân mang điện dương. Điện tích hạt nhân là Z+, số đơn vị điện tích hạt nhân là Z. Số đơn vị điện tích hạt nhân (Z) = số proton = số electron Thí dụ: Nguyên tử có 17 electron thì điện tích hạt nhân là 17+ 2. Số khối hạt nhân A = Z + N Thí dụ: Nguyên tử có natri có 11 electron và 12 nơtron thì số khối là: A = 11 + 12 = 23 (Số khối không có đơn vị) 3. Nguyên tố hóa học - Là tập hợp các nguyên tử có cùng số điện tích hạt nhân. - Số hiệu nguyên tử (Z): Z = P = e - Kí hiệu nguyên tử: Trong đó A là số khối nguyên tử, Z là số hiệu nguyên tử. III. Đồng vị, nguyên tử khối trung bình 1. Đồng vị - Là tập hợp các nguyên tử có cùng số proton nhưng khác nhau số nơtron (khác nhau số khối A). - Thí dụ: Nguyên tố cacbon có 3 đồng vị: 2. Nguyên tử khối trung bình Gọi là nguyên tử khối trung bình của một nguyên tố. A1, A2 ... là nguyên tử khối của các đồng vị có % số nguyên tử lần lượt là a%, b%... Ta có: chú ý: a + b + = 100 Hoặc tính theo tỉ lệ số nguyên tử a,b. B. CÁC DẠNG BÀI TẬP HAY GẶP CHƯƠNG 1: CẤU TẠO NGUYÊN TỬ CHỦ ĐỀ 1:BÁN KÍNH NGUYÊN TỬ, KHỐI LƯỢNG NGUYÊN TỬ 1. Nguyên tử khối của neon là 20,179u. Hãy xác định khối lượng của một nguyên tử neon theo kg? 2. Nguyên tử kali có 19 e, 19 p, 20 n. a. Tính khối lượng tuyệt đối của kali. b. Tính khối lượng tương đối của Kali. 3. Tính bán kính gần đúng của 1 nguyên tử canxi, biết rằng 1 mol canxi chiếm thể tích 25,87 cm3 và trong tinh thể , các nguyên tử cannxi chỉ chiếm 74% thể tích, còn lại là khe trống. 4. Nguyên tử khối của neon là 20,179. Hãy tính khối lượng của một nguyên tử neon theo kg. 5. Kết quả phân tích cho thấy trong phân tử khí CO2 có 27,3% C và 72,7% O theo khối lượng. Biết nguyên tử khối của C là 12,011. Hãy xác định nguyên tử khối của oxi. 6. Biết rằng khối lượng một nguyên tử oxi nặng gấp 15,842 lần và khối lượng của nguyên tử cacbon nặng gấp 11,9059 lần khối lượng của nguyên tử hiđro. Hỏi nếu chọn khối lượng nguyên tử cacbon làm đơn vị thì H, O có nguyên tử khối là bao nhiêu ? 7. Mục đích thí nghiệm của Rơ-dơ-pho là gì? Trình bày thí nghiệm tìm ra hạt nhân nguyên tử của Rơ-dơ-pho và các cộng sự của ông. 8. Hãy cho biết số đơn vị điện tích hạt nhân, số proton, số nơtron và số electron của các nguyên tử có kí hiệu sau đây : a) b) 9. Cách tính số khối của hạt nhân như thế nào ? Nói số khối bằng nguyên tử khối thì có đúng không ? tại sao ? 10. Nguyên tử khối trung bình của bạc bằng 107,02 lần nguyên tử khối của hiđro. Nguyên tử khối của hiđro bằng 1,0079. Tính nguyên tử khối của bạc. CHỦ ĐỀ 2: TOÁN VỀ CÁC LOẠI HẠT TRONG NGUYÊN TỬ - Tổng số hạt S = P + E + N. Ta có P = E è S = 2P + N - Hạt mang điện: proton (P) và electron (E). - Hạt không mang điện: notron (N) - Số đơn vị điện tích hạt nhân = số proton = số electron=STT=Số HNT - Số khối A = Z + N - Từ nguyên tố thứ 2 đến 82 trong bảng tuần hoàn thì: S/3,5 ≤ Z ≤ S/3 Bài tập 1:Một nguyên tử R có tổng số hạt p, n, e là 115. Số hạt mang điện nhiều hơn số hạt không mang điện là 25 hạt. Xác định điện tích hạt nhân của R . Tên ngtử R ? Bài tập 2 : Tổng số hạt p, n, e trong nguyên tử X là 10. Tìm số khối của nguyên tử X. Bài tập 3:Xác định cấu tạo hạt (tìm số e, số p, số n), viết kí hiệu nguyên tử của các nguyên tử sau, biết: Tổng số hạt cơ bản là 13. Bài tập 4 : Cho biết tổng số hạt p, n, e trong nguyên tử của nguyên tố X là 52, trong đó số hạt không mang điện ít hơn số hạt mang điện là 16 hạt. Tìm số hiệu nguyên tử, nguyên tử khối của X. Viết cấu hình e từ đó xác định vị trí X trong BTH ? Bài tập 5 : Xác định số khối , số hiệu nguyên tử của 2 loại nguyên tử sau : a. Nguyên tử nguyên tố X câú tạo bởi 36 hạt cơ bản ( p,n,e) trong đó số hạt mang điện tích nhiều gấp đôi số hạt không mang điện tích. b. Nguyên tử nguyên tố Y có tổng các phần tử tạo nên là 155 , số hạt mang điện nhiều hơn số hạt không mang điện là 33 . Bài tập 6 : Kim loại A có hóa trị I, có tổng p, n, e là 34. Tìm kim loại A. Bài tập 7 : Cho các kí hiệu nguyên tử sau : Hãy xác định: Số khối, số hiệu nguyên tử, số đơn vị điện tích hạt nhân, điện tích hạt nhân, số nơtron của từng nguyên tố. Bài tập 8 :Tổng số hạt proton, nơtron, electron có trong một loại nguyên tử của ,nguyên tố Y là 54, trong đó tổng số hạt mang điện nhiều hơn số hạt không mang điện là 1,7 lần. Hãy xác định số hiệu nguyên tử, số khối và viết kí hiệu nguyên tử X. Bài tập 9 :Biết rằng tổng số các loại hạt (p, n, e) trong nguyên tử R là 40, trong đó hạt không mang điện kém hơn số hạt mang điện là 12. Xác định tên của nguyên tố R và viết kí hiệu nguyên tử R. Bài tập 10: Nguyên tử Y có tổng số hạt là 36. Số hạt không mang điện thì bằng một nửa hiệu số giữa tổng số hạt và số hạt mang điện tích âm. Bài tập 11: Biết tổng số hạt p, n, e trong một nguyên tử là 155. Số hạt mang điện nhiều hơn số hạt không mang điện là 33 hạt. Tính số khối của nguyên tử. Bài tập 12: Tổng số hạt proton, nơtron, electron trong nguyên tử là 28, trong đó số hạt không mang điện chiếm xấp xỉ 35% tổng số hạt. Tính số hạt mỗi loại và viết cấu hình electron của nguyên tử . Bài tập 13 : Biết 1 mol nguyên tử sắt có khối lượng bằng 56g, một nguyên tử sắt có 26 electron. Số hạt electron có trong 5,6g sắt là A. 15,66.1024 B. 15,66.1021 C. 15,66.1022 D. 15,66.1023 Bài tập 14 : Nguyên tử nào trong số các nguyên tử sau đây có 20 proton, 20 electron, 20 nơtron? A. K B. Ar C. Ca D. Cl CHỦ ĐỀ 3: TOÁN VỀ ĐỒNG VỊ Nguyên tử khối trung bình : + Tính theo tỉ lệ % mỗi đồng vị: A, B là NTK của các đvị A, B a,b là tỉ lệ % số nguyên tử của đvị A,B + Tính theo tỉ lệ số nguyên tử của mỗi đồng vị: A, B là NTK của các đvị A, B a,b là tỉ lệ số nguyên tử của đvị A,B Bài tập 1 :Trong tự nhiên nguyên tố brôm có 2 đồng vị là 7935Br và 8135Br. Biết đồng vị 7935Br chiếm 54,5% số nguyên tử. Tìm khối lượng nguyên tử trung bình của Br. Bài tập 2 : Đồng trong tự nhiên gồm 2 đồng vị 6329Cu và 6529Cu với tỉ lệ số nguyên tử tương ứng là 105 :245. Tính khối lượng nguyên tử trung bình của đồng. Bài tập 3 : Đồng trong tự nhiên gồm 2 đồng vị 6329Cu và 6529Cu. Nguyên tử khối trung bình của đồng là 63,54. Tính thành phần % số nguyên tử của mỗi đồng vị ? Bài tập 4 : Nguyên tử khối trung bình của B là 10,81. B có 2 đồng vị 105B và 115B. Hỏi có bao nhiêu % 115B trong axit boric H3BO3 . Cho MH3BO3 = 61,84. Bài tập 5: Đồng có 2 đồng vị và . Nguyên tử khối trung bình của đồng là 63,54. Tìm tỉ lệ khối lượng của trong CuCl2 . Bài tập 6: Clo có hai đồng vị là . Tỉ lệ số nguyên tử của hai đồng vị này là 3 : 1. Tính nguyên tử lượng trung bình của Clo Bài tập 7: Brom có hai đồng vị, trong đó đồng vị 79Br chiếm 54,5%. Xác định đồng vị còn lại, biết . Bài tập 8: Trong tự nhiên đồng vị 37Cl chiếm 24,23,% số nguyên tử clo.Tính thành phần phần trăm về khối lượng 37Cl có trong HClO4 ( với hidro là đồng vị 1H, oxi là đồng vị 16O). Cho khối lượng nguyên tử trung bình của Clo là 35,5. Bài tập 9: Trong tự nhiên Clo có 2 đồng vị là 35Cl và 37Cl có nguyên tử khối trung bình là 35,5. Tính số nguyên tử của đồng vị 37Cl, trong 3,65g HCl. Bài tập 10:. Trong tự nhiên Brom có 2 đồng vị là 79Br và 81Br có nguyên tử khối trung bình là 79,92. Thành phần phần trăm về khối lượng của 81Br trong NaBr là bao nhiêu. Bài tập 11. Cho hai đồng vị hiđro với tỉ lệ % số nguyên tử : (99,984%), (0,016%) và hai đồng vị của clo : (75,53%), (24,47%). a) Tính nguyên tử khối trung bình của mỗi nguyên tố. b) Có thể có bao nhiêu loại phân tử HCl khác nhau được tạo nên từ hai loại đồng vị của hai nguyên tố đó. c) Tính phân tử khối gần đúng của mỗi loại phân tử nói trên. Bài tập 12. Nguyên tử khối trung bình của đồng bằng 63,546. Đồng tồn tại trong tự nhiên dưới hai dạng đồng vị và . Tính tỉ lệ % số nguyên tử đồng tồn tại trong tự nhiên. Bài tập 13. Cho hai đồng vị (kí hiệu là H), (kí hiệu là D). a) Viết các công thức phân tử hiđro có thể có. b) Tính phân tử khối của mỗi loại phân tử. c) Một lit khí hiđro giàu đơteri () ở điều kiện tiêu chuẩn nặng 0,10g. Tính thành phần % khối lượng từng đồng vị của hiđro. Bài tập 14: Tính khối lượng nguyên tử trung bình của niken, biết rằng trong tự nhiên, các đồng vị của niken tồn tại như sau: Đồng vị Thành phần % 67,76 26,16 1,25 3,66 1,16
Tài liệu đính kèm:
 day_them_ly_thuyet_va_bai_tap_nguyen_tu.doc
day_them_ly_thuyet_va_bai_tap_nguyen_tu.doc





