Bài kiểm tra số 3 ( thi học kì I ) năm học 2014 - 2015 môn hóa khối 10
Bạn đang xem tài liệu "Bài kiểm tra số 3 ( thi học kì I ) năm học 2014 - 2015 môn hóa khối 10", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
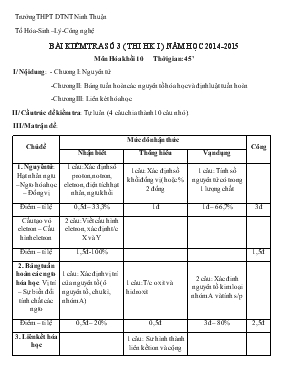
Trường THPT DTNT Ninh Thuận Tổ Hóa-Sinh –Lý-Công nghệ BÀI KIỂM TRA SỐ 3 ( THI HK I ) NĂM HỌC 2014-2015 Môn Hóa khối 10 Thời gian: 45’ I/ Nội dung: - Chương I: Nguyên tử -Chương II: Bảng tuần hoàn các nguyên tố hóa học và định luật tuần hoàn -Chương III: Liên két hóa học II/ Cấu trúc đề kiểm tra: Tự luân (4 câu chia thành 10 câu nhỏ). III/ Ma trận đề: Chủ đề Mức đô nhận thức Công Nhận biết Thông hiểu Vạn dụng 1. Nguyên tử: Hạt nhân ngtu –Ngto hóa học – Đồng vị 1 câu: Xác định số proton, notron, eletron, điện tích hạt nhân, ngtu khối 1câu: Xác định số khối đồng vị( hoặc % 2 đồng 1 câu: Tính số nguyên tử có trong 1 lượng chất Điểm – tỉ lệ 0,5đ – 33,3% 1đ 1đ – 66,7% 3đ Cấu tạo vỏ eletron – Cấu hình eletron 2 câu: Viết cấu hình eletron, xác định t/c X và Y Điểm – tỉ lệ 1,5đ -100% 1,5đ 2. Bảng tuần hoàn các ngto hóa học: Vị trí – Sự biến đổi tính chất các ngto 1 câu: Xác định vị trí của nguyên tố( ô nguyên tố, chu kì, nhóm A) 1 câu: T/c oxit và hidroxit 2 câu: Xác đinh nguyên tố kim loại nhóm A và tính s/p Điểm – ti lệ 0,5đ – 20% 0,5đ 3đ – 80% 2,5đ 3. Liên kết hóa học 1 câu: Sư hình thành liên kết ion và cộng hóa trị Điểm – tỉ lệ 1đ – 50% 2đ 4. Phản ứng oxihoa- khử 1 câu: Đ/n số oxihoa Xác định số oxi hóa của nguyên tố trong pt h/c và ion Diểm – tỉ lệ 0,5đ – 50% 0,5đ – 50% 1đ Điểm tổng cộng 3,đ 3đ 4đ 10đ Tỉ lệ 30% 30% 40% 100% Trường PTTH DTNT Ninh Thuận Tổ Hóa-Sinh-Công nghệ ĐỀ - ĐÁP ÁN THI HỌC KÌ I – MÔN HÓA LỚP 10 – NĂM HỌC 2014-2015 Đề số 1: Câu 1(1,0 điểm): Số oxi hóa là gì? Xác định số oxi hóa của Cl trong hợp chất HClO4 và ion ClO3- Câu 2(4,0 điểm): Cho , Y( chu kì 3, nhóm VIIA) và Z có phân mức năng lượng cao nhất là 4s2 a) Xác định số proton, số notron, số eletron, điện tích hạt nhân, nguyên tử khối của X b) Viết cấu hình eletron của và xác định tính chất cơ bản của X , Y và Z. c) Xác định vị trí của X trong bảng tuần hoàn d) Oxit và hidroxit của Y và Z có tính chất gì? e) Viết sơ đồ tạo thành phân tử giữa X và Y , giữa Y và Z. Câu 3(2,0 điểm): Đồng có 2 đồng vị bền là 2963Cu và 2965Cu. a) Tính phần trăm theo khối lượng mỗi đồng vị biết nguyên tử khối trung bình của Cu là 63,54. b) Tính số nguyên tử đồng vị 2963Cu có trong 24g CuS. ( Cho S = 32). Câu 4(3 điểm):Hòa tan hoàn toàn 8,4g oxit của kim loại A(nhóm IIA) cần phải dùng hết 200ml dd HCl 1,5M thì vừa đủ và thu được dd (X) a) Xác định A. b) Tính khối lượng dd AgNO3 1M (d = 1,52g/ml) đủ để kết tủa hết với dd (X) (Biết: Kim loại nhóm IIA: Mg = 24; Ca = 40; Ba = 137 và Ag = 108; N = 14. O = 16) Đề số 2: Câu 1(1,0 điểm): Số oxi hóa là gì? Xác định số oxi hóa của N trong hợp chất HNO3 và ion NH4+ Câu 2(4,0 điểm): Cho , Y(chu kì 2, nhóm VIA) và Z có phân mức năng lượng cao nhất là 3s1 a) Xác định số proton, số notron, số eletron, điện tích hạt nhân, nguyên tử khối của X b) Viết cấu hình eletron của và xác định tính chât cơ bản của X , Y và Z. d) Xác định vị trí của X trong bảng tuần hoàn e) Oxit và hidroxit của X và Z có tính chât gì? g) Viết sơ đồ tạo thành phân tử giữa X và Y , giữa Y và Z. Câu 3(2,0 điểm): Đồng có 2 đồng vị bền: Đồng vị 1 là 2963Cu (chiếm 73%) a) Tính nguyên tử khối đồng vị 2 biết nguyên tử khối trung bình của Cu là 63,54. b) Tính số nguyên tử đồng vị 2 có trong 12g CuO. ( Cho O = 16). Câu 2(3,0 điểm): Hòa tan hoàn toàn 15,5g oxit của một kim loại kiềm A cần phải dùng hết 250ml dd HCl 2M thì vừa đủ và thu được dd (X) a) Xác định kim loại kiềm A b) Tính thể tích dd AgNO3 17% (d = 1,52g/ml) đủ để kết tủa hết dd (X) ( Biết: Kim loại kiềm: Li = 7; Na = 23; K =39; Rb = 85 và Ag = 108; N = 14; O = 16) Đáp án đề 1: Câu Lời giải tóm tắt Biểu điểm Câu 1 Số oxi hóa là điện tích ion của nguyên tố nếu giả định liên kết trong các phân tử đều là liên kết ion Số oxi hóa của Cl lần lượt là: +7 và +5 1đ 0,5đ 0,5đ Câu 2 a) X có số proton: 15; số notron: 16; số eletron: 15; điện tích hạt nhân: 15+; nguyên tử khối: 31(u) b) 15X: 1s22s22p63s23p3 => X là phi kim ( 5e lớp nc) Y: 3 lớp e, 7e lớp ngoài cùng nên Y: 1s22s22p63s23p5 =>Y là phi kim (7e lớp nc) Z: 1s22s22p63s23p64s2 => Z là kim loại (2e lớp nc) c) X có Z=15, 3 lớp e, 5e lớp ngoài cùng (nguyên tố p) nên X : ô nguyên tố 15, ở chu kì 3, nhóm VA d) Y(PK, nhóm VIIA) nên oxit Y2O7 và hidroxit HXO4 có tính chất axit Z(KL, nhóm IIA) nên oxit AO và hidroxit A(OH)2 có tính chât bazo e) X và Y hình thành liên kết cộng hóa trị: X góp 3e và Y góp 1e nên X + 3Y à XY3. Học sinh viết được công thức eletron và công thức cấu tạo của phân tử XY3 Y và Z hình thành liên kết ion: Z à Z2+ + 2e và Y + 1e à Y- à Z2+ + 2Y- à ZY2 4đ (0,5d) (1,5đ) 0,5đ 0,5đ 0,5đ (0,5đ) (0,5đ) (1đ) 0,5đ 0,5đ Câu 3 a) 2963Cu (chiếm x%) và 2965Cu (chiếm 100% - x% = 1 – x) MCu = 63x + 65(1 – x) = 63,54 => x = 0,73 = 73% b) nCuS = 2496 = 0,25 mol 1 mol pt CuS chứa 1 mol nt Cu → 6,02x1023 nt Cu 0,25 mol pt CuS →0,25x6,02x1023 nt Cu =>Số nt ĐV 2963Cu có trong 24g CuS = 0,25x6,02x1023100 x 7 = 109,865x1021 nt 2đ (1đ) 0,5đ 0,5đ (1đ) 0,5đ 0,5đ Câu 4: a) Số mol HCl = 0,2. 1,5 = 0,3 mol Ptpứ: AO + 2HCl → ACl2 + H2O (mol) 0,15 0,3 0,15 => MAO = MA + 16 = 8,40,15 = 56 => MA = 40 => A là Ca b) dd (X) là CaCl2 Ptpứ: CaCl2 + 2AgNO3 → 2AgCl↓ + Ca(NO3)2 (mol) 0,15 0,3 => mddAgNO3 = 0,3. 1000. 1,52 = 456ml 3đ (2đ) 0,25đ 0,5đ 0,25đ 0,5đ 0,5đ (1đ) 0,5đ 0,5đ Đáp án đề 2: Câu Lời giải tóm tắt Biểu điểm Câu 1 Số oxi hóa là điện tích ion của nguyên tố nếu giả định liên kết trong các phân tử đều là liên kết ion Số oxi hóa của N lần lượt là: +5 và -3 1đ 0,5đ 0,5đ Câu 2: a) X có số proton: 6; số notron: 6; số eletron: 6; điện tích hạt nhân: 6+; nguyên tử khối: 12(u) b) 6X: 1s22s22p2 => X là phi kim (4e lớp nc thuộc CK nhỏ) Y: 2 lớp e, 6e lớp ngoài cùng nên Y: 1s22s22p4 => Y là phi kim (6e lớp nc) Z: 1s22s22p63s1 => Z là kim loại (1e lớp nc) c) X có Z=6, 2 lớp e, 4e lớp ngoài cùng (nguyên tố p) nên X ở ô nguyên tố 6, chu kì 2, nhóm IVA d) X(PK,nhóm IVA) nên oxit XO2 và hidroxit H2XO3 có tính chất axit Z(KL, nhóm IA) nên oxit Z2O và hidroxit ZOH có tính chât bazo e) X và Y hình thành liên kết cộng hóa trị: X góp 4e và Y góp 2e nên X + 2Y à XY2 Học sinh viết được công thức eletron và công thức cấu tạo của phân tử XY2 Y và Z hình thành liên kết ion: Z à Z+ + 1e và Y + 2e à Y2- à 2Z+ + Y2- à Z2Y 4đ (0,5đ) (1,5đ) 0,5đ 0,5đ 0,5đ (0,5đ) (0,5đ) (1đ) 0,5đ 0,5đ Câu 3 a) 2963Cu (chiếm 73%) và 29A2Cu (chiếm 27%) MCu = (63.73 + 27A2) : 100 = 63,54 => A2 = 65 b) nCuO = 128o = 0,15 mol 1 mol pt CuO chứa 1 mol nt Cu → 6,02x1023 nt Cu 0,15 mol pt CuO →0,15x6,02x1023 nt Cu =>Số nt ĐV 2965Cu có trong 24g CuS = 0,15x6,02x1023100 x 27 = 24,381x1021 nt 2đ (1đ) 0,5đ 0,5đ (1đ) 0,5đ 0,5đ Câu 4 a) Số mol HCl = 0,25. 0,2 = 0,5 mol Ptpứ: A2O + 2HCl → 2ACl + H2O (mol) 0,25 0,5 0,5 => MA2O = 2MA + 16 = 15,50,25 = 62 => MA = 23 => A là Na b) dd (X) là NaCl Ptpứ: NaCl + AgNO3 → AgCl↓ + NaNO3 (mol) 0,5 0,5 => mddAgNO3 = 0,5.170.10017.15,2 = 329 ml 3đ (2đ) 0,25đ 0,5đ 0,25đ 0,5đ 0,5đ (1đ) 0,5đ 0,5đ Lưu ý: Học sinh có thể giải bằng cách khác nếu đúng vẫn được điểm tối đa. Phan rang ngày 18 tháng 11 năm 2014 PHT TTCM GVBM Nguyễn Thị Thu Thủy Tài Nhất Chuyên Huỳnh Thị Thu Thủy – Hồ Thị Quý
Tài liệu đính kèm:
 Hoa_Ch_(DTNT)_HK1_10.doc
Hoa_Ch_(DTNT)_HK1_10.doc





