Bài kiểm tra học kì Im môn Hóa 9
Bạn đang xem tài liệu "Bài kiểm tra học kì Im môn Hóa 9", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
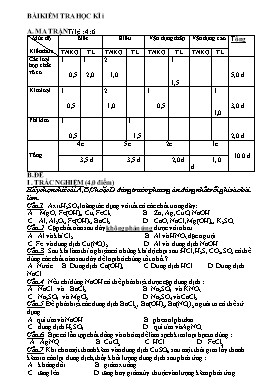
BÀI KIỂM TRA HỌC KÌ i A. MA TRẬN Tỉ lệ : 4: 6 Mức độ Kiến thức Biết Hiểu Vận dụng thấp Vận dụng cao Tổng TNKQ TL TNKQ TL TNKQ TL TNKQ TL Các loại hợp chất vô cơ 1 0,5 1 2,0 2 1,0 1 1,5 5,0 đ Kim loại 1 0,5 2 1,0 1 0,5 1 1,0 3,0 đ Phi kim 1 0,5 1 1,5 2,0 đ Tổng 4c 5c 2c 1c 10.0 đ 3,5 đ 3,5 đ 2,0 đ 1, 0 đ B. ĐỀ I . TRẮC NGHIỆM (4,0 điểm) Hãy chọn chữ cái A,B,C hoặc D đứng trước phương án đúng nhất rồi ghi vào bài làm Câu 1. Axit H2SO4 loãng tác dụng với tất cả các chất trong dãy: A. MgO, Fe(OH)2, Cu, FeCl3. B. Zn, Ag, CuO, NaOH. C. Al, Al2O3, Fe(OH)3, BaCl2. D. CaO, NaCl, Mg(OH)2 ., K2SO3 . Câu 2. Cặp chất nào sau đây không phản ứng được với nhau A. Al và khí Cl2 B. Al và HNO3 đặc nguội. C. Fe và dung dịch Cu(NO3) 2 D. Al và dung dịch NaOH. Câu 3. Sau khi làm thí nghiệm có những khí độc hại sau: HCl, H2S, CO2,SO2 có thể dùng các chất nào sau đây để loại bỏ chúng tốt nhất ? A. Nước. B. Dung dịch Ca(OH)2. C. Dung dịch HCl. D. Dung dịch NaCl . Câu 4 Nếu chỉ dùng NaOH có thể phân biệt được cặp dung dịch : A. NaCl và BaCl2 . B. Na2SO4 và KNO3. C. Na2SO4 và MgCl2 . D. Na2SO4 và CaCl2. Câu 5 Để phân biệt các dung dịch BaCl2, , Ba(OH)2, Ba(NO3)2 người ta có thể sử dụng A. quì tím và NaOH . B. phenolphtalein. C. dung dịch H2SO4. D. quì tím và AgNO3 . Câu 6. Bạc có lẫn tạp chất đồng và nhôm, để làm sạch kim loại bạc ta dùng : A. AgNO3. B. CuCl2 . C. HCl . D. FeCl2. Câu 7 Khi cho một thanh kẽm vào dung dịch CuSO4, sau một thời gian lấy thanh kẽm ra cân lại dung dịch, thấy khối lượng dung dịch sau phản ứng : A. không đổi. B. giảm xuống. C. tăng lên. D. tăng hay giảm tùy thuộc vào lượng kẽm phản ứng. Câu 8, Hổn hợp nào sau đây tan hết trong nước ? A. Na, Mg. B. Na, Al. C. Al, Al2O3. D. Na, MgO II. TỰ LUẬN (6,0đ) Câu 1. 2,0đ) a. Viết phương trình hóa học cho những chuyển đổi sau : FeCl3Fe (NO3)3 Fe (OH)3 Fe2O3 Fe Câu 2 (1,5đ) Dẫn khí clo vào nước, nhúng mẫu quì tím vào dung dịch thu được. Nêu hiện tượng, giải thích và viết phương trình hóa học xảy ra. Câu 3 (1,5đ) Cho 50 gam dung dịch NaOH 3,2 % tác dụng vừa đủ với dung dịch CuCl2 1M, thu được dung dịch A và kết tủa B a Tính thể tích dung dịch CuCl2 đã dùng. b. Tính khối lượng kết tủa B. Câu 4: (1,0đ) Để sản xuất một tấn nhôm, cần dùng bao nhiêu tấn quặng boxit chứa 90% Al2O3. Biết hiệu suất của quá trình là 80 % . (Cho biết: H = 1, O = 16, Na = 23, Al = 27, S =32, Cl = 35,5, Fe = 56, Cu = 64 ) C. ĐÁP ÁN Phần trắc nghiệm (4đ) Câu 1 2 3 4 5 6 7 8 Đáp án C B B C D A C B Phần tự luận (6đ) Câu Nội dung Điểm 1 (2,0 điểm) 1) FeCl3 + 3AgNO3 Fe(NO3)3 + 3AgCl 2) Fe(NO3)3 +3NaOH Fe(OH)3 + 3NaNO3 3) 2Fe (OH)3 Fe2O3 + 3H2O 4) Fe2O3 + 3CO 2Fe + 3CO2 0,5 đ 0,5 đ 0,5 đ 0,5 đ 2 (1,5 điểm) Hiên tượng : Dung dịch nước clo có màu vàng lục mùi hắc của khí clo, giấy quì tím chuyển sang đỏ, sau đó mất màu ngay Giải thích : Nước clo là dung dịch hổn hợp các chất : Cl2, HCl, HClO nên có màu vàng lục mùi hắc, lúc đầu axit làm quì tím chuyển sang đỏ, nhưng nhanh chóng mất màu là do tác dụng oxi hóa mạnh của HClO PTHH Cl2 + H2O HCl + HClO 0,5 đ 0,75 đ 0,25 đ 3 (1,5 điểm) Khối lượng NaOH mNaOH= Số mol NaOH nNaOH= = 0,04 mol 2NaOH + CuCl2 2NaCl + Cu(OH)2 2 mol 1mol 1 mol 0,04 mol 0,02 mol 0,02 mol Thể tích của dd NaOH Vdd () = lít = 20 ml Khối lượng kết tủa B m = 0,02 . 98 = 19,6 gam 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 4 (1,0điểm) 2Al2O3 4Al + 3O2 2 x102 g 4 x 27 g x kg 1000 kg x = kg Khối lượng Al2O3 phản ứng = kg Khối lượng quặng cần dùng mquăng= kg = 2,623 Tấn 0,25 đ 0,25 đ 0,25 đ 0,25 đ
Tài liệu đính kèm:
 de_thi_HKI_hoa_9.doc
de_thi_HKI_hoa_9.doc





