Thi học kì I năm học 2014 - 2015 môn: Hóa học 11
Bạn đang xem tài liệu "Thi học kì I năm học 2014 - 2015 môn: Hóa học 11", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
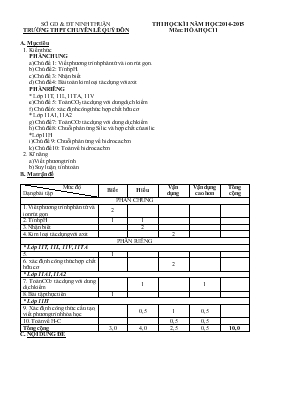
SỞ GD & ĐT NINH THUẬN TRƯỜNG THPT CHUYÊN LÊ QUÝ ĐÔN THI HỌC KÌ I NĂM HỌC 2014-2015 Môn: HÓA HỌC 11 A. Mục tiêu 1. Kiến thức PHẦN CHUNG a) Chủ đề 1: Viết phương trình phân tử và ion rút gọn. b) Chủ đề 2: Tính pH. c) Chủ đề 3: Nhận biết d) Chủ đề 4: Bài toán kim loại tác dụng với axit PHẦN RIÊNG * Lớp 11T, 11L, 11TA, 11V e) Chủ đề 5: Toán CO 2 tác dụng với dung dịch kiềm f) Chủ đề 6: xác định công thức hợp chất hữu cơ * Lớp 11A1, 11A2 g) Chủ đề 7: Toán CO 2 tác dụng với dung dịch kiềm h) Chủ đề 8: Chuỗi phản ứng Silic và hợp chất của silic *Lớp 11H i) Chủ đề 9: Chuỗi phản ứng về hidrocacbon k) Chủ đề 10: Toán về hidrocacbon 2. Kĩ năng a) Viết phương trình. b) Suy luận, tính toán. B. Ma trận đề Mức độ Dạng bài tập Biết Hiểu Vận dụng Vận dụng cao hơn Tổng cộng PHẦN CHUNG 1. Viết phương trình phân tử và ion rút gọn 2 2. Tính pH 1 1 3. Nhận biết 2 4. Kim loại tác dụng với axit 2 PHẦN RIÊNG * Lớp 11T, 11L, 11V, 11TA 5. 1 6. xác định công thức hợp chất hữu cơ 2 * Lớp 11A1, 11A2 7. Toán CO 2 tác dụng với dung dịch kiềm 1 1 8. Bài tập thực tiễn 1 * Lớp 11H 9. Xác định công thức cấu tạo, viết phương trình hóa học 0,5 1 0,5 10. Toán về H-C 0,5 0,5 Tổng cộng 3,0 4,0 2,5 0,5 10,0 C. NỘI DUNG ĐỀ SỞ GD & ĐT NINH THUẬN TRƯỜNG THPT CHUYÊN LÊ QUÝ ĐÔN (Đề kiểm tra có 01 trang) KIỂM TRA HỌC KÌ I Năm học: 2014-2015 Môn: HÓA HỌC 11 Thời gian làm bài: 45 phút ĐỀ PHẦN CHUNG (7 điểm) Câu 1: (2 điểm) Viết phương trình phân tử và phương trình ion rút gọn của các phản ứng sau: a) KOH+ KHCO3→ b) FeCl3 + AgNO3→ Câu 2: (1 điểm) A là dung dịch H2SO4 0,005M. a) Tính pH của dung dịch A. b) Pha loãng dung dịch A 100 lần được dung dịch B. Tính pH của dung dịch B. Câu 3: (2 điểm) Chỉ dùng một hóa chất duy nhất, hãy nhận biết các dung dịch đựng trong các lọ riêng biệt: NH 4NO3, (NH4)2SO3, Na2SO3, NaCl. Viết phương trình ion thu gọn xảy ra trong quá trình nhận biết. Câu 4: (2 điểm) Cho 14,85 gam Al tác dụng vừa đủ với V lít dung dịch HNO3 1M thu được 6,72 lít hỗn hợp gồm 2 khí NO, N2O ở điều kiện chuẩn và dung dịch X chỉ gồm một muối duy nhất. Tính thể tích dung dịch HNO3 đã dùng. B. PHẦN RIÊNG (3 điểm) Dành cho lớp 11T, 11L, 11V, 11TA Câu 5: (1 điểm) Trong ngành chế biến thực phẩm, người ta thường dùng muối NH4HCO3 hoặc muối (NH4)2CO3 để làm xốp bánh (hay còn gọi là làm bột nở). Hãy giải thích tại sao, viết phương trình hóa học minh họa. Câu 6: (2 điểm) Hợp chất X có phần trăm khối lượng cacbon, hiđro và oxi lần lượt là 60%; 13,333%; 26,667%. Khối lượng mol phân tử của X là 60 g/mol. Xác định công thức phân tử của X. Dành cho lớp 11A1, 11A2 Câu 7: (1 điểm) Trong ngành chế biến thực phẩm, người ta thường dùng muối NH4HCO3 hoặc muối (NH4)2CO3 để làm xốp bánh (hay còn gọi là làm bột nở). Hãy giải thích tại sao, viết phương trình hóa học minh họa. Câu 8: (2 điểm) Sục một thể tích khí CO2 nặng 8,8 gam vào 200 ml dung dịch NaOH 1,5 M thu được dung dịch X (thể tích dung dịch thay đổi không đáng kể). a) Tính nồng độ mol/l các chất có trong dung dịch X. b) Nêu hiện tượng xảy ra khi nhúng quỳ tím vào dung dịch X. Giải thích bằng phương trình hóa học. Dành cho lớp 11H Câu 9: (2 điểm) Cho sơ đồ biến hóa sau: CuCl/NH4Cl + H2 (dư)/ Ni, to Xúc tác, to + dung dịch KMnO4 + dd AgNO3/ NH 3 Ni, to C2H2 A B C D E Hãy xác định công thức cấu tạo của A, B, C, D, E. Viết phương trình hóa học cho phản ứng từ C → D và từ A → E. Câu 10: (1 điểm) Hỗn hợp khí X gồm có 0,3 mol H2 và 0,1 mol vinylaxetilen. Nung X trong một thời gian với xúc tác Ni thu được hỗn hợp khí Y có tỉ khối so với không khí là 1. Nếu cho toàn bộ Y sục từ từ vào dung dịch Br2 (dư) thì có m gam Br2 tham gia phản ứng. Tính m. (Cho Cu = 64; N = 14; Na = 23; Ba = 137; Al = 27; O = 16; C=12; Mg = 24) ------------HẾT------------ D. ĐÁP ÁN LỜI GIẢI TÓM TẮT Biểu điểm A. PHẦN CHUNG (7 điểm) Câu 1: (2 điểm) Viết phương trình phân tử và phương trình ion rút gọn của các phản ứng sau: a) KOH+ KHCO3→ b) FeCl3 + AgNO3→ Viết đúng 4 phương trình phản ứng 0,5 x 4 Câu 2: (1 điểm) A là dung dịch H2SO4 0,005M. a) Tính pH của dung dịch A. b) Pha loãng dung dịch A 100 lần được dung dịch B. Tính pH của dung dịch B. a. H2SO4 0,005M→[H+]=0,01M→ pH=2 0,5 b. Pha loãng 100 lần nên: [H+]=0,01/100M = 10-4 → pH=4 0,5 Câu 3: (2 điểm) Chỉ dùng một hóa chất duy nhất, hãy nhận biết các dung dịch đựng trong các lọ riêng biệt: NH 4NO3, (NH4)2SO3, Na2SO3, NaCl. Viết phương trình ion thu gọn xảy ra trong quá trình nhận biết. Dùng Ba(OH)2 0,5 NH4NO3: Khí mùi khai thoát ra. Viết đúng phương trình 0,5 (NH4)2SO3: Khí mùi khai thoát ra và kết tủa trắng. Viết đúng phương trình 0,5 Na2SO3: Kết tủa trắng. Viết đúng phương trình. Còn lại là NaCl 0,5 Câu 4: (2 điểm) Cho 14,85 gam Al tác dụng vừa đủ với V lít dung dịch HNO3 1M thu được 6,72 lít hỗn hợp gồm 2 khí NO, N2O ở điều kiện chuẩn và dung dịch X chỉ gồm một muối duy nhất. Tính thể tích dung dịch HNO3 đã dùng. Al→Al3+ + 3e 0,55 1,65 (mol) 4H+ + NO3- + 3e →NO + 2H2O 4x 3x x 10H+ + 2NO3- + 8e →N2O + 5H2O 10y 8y y 0,5 Theo định luật bảo toàn electron: 3x+8y =1,65 0,5 Ta có hệ phương trình Số mol HNO3 = 4x+10y = 2,1mol →Vdd HNO3 = 2,1 lít 1 Nếu giải theo cách viết phương trình thì: - Viết đúng 2 phương trình: 1 điểm - Lập đúng hệ phương trình: 0,5 điểm - giải và tính đúng thể tích HNO3: 0,5 điểm B. PHẦN RIÊNG (3 điểm) * Dành cho lớp 11T,11L,11TA,11V Câu 5: (1 điểm) Trong ngành chế biến thực phẩm, người ta thường dùng muối NH4HCO3 hoặc muối (NH4)2CO3 để làm xốp bánh (hay còn gọi là làm bột nở). Hãy giải thích tại sao, viết phương trình hóa học minh họa. Muối NH4HCO3 và muối (NH4)2CO3 kém bền với nhiệt. Khi nướng hoặc hấp bánh, chúng dễ bị nhiệt phân tạo ra một hỗn hợp khí và hơi nước thoát ra, làm cho bánh xốp và nở. 0,5 NH4HCO3 NH3 + CO2 + H2O (NH4)2CO3 2NH3 + CO2 + H2O 0,5 Câu 6: (2 điểm) Hợp chất X có phần trăm khối lượng cacbon, hiđro và oxi lần lượt là 60%; 13,333%; 26,667%. Khối lượng mol phân tử của X là 60 g/mol. Xác định công thức phân tử của X. 1 → x=3, y=8, z=1 → CTPT: C3H8O 1 * Dành cho lớp 11A1,11A2 Câu 7: (1 điểm) Trong ngành chế biến thực phẩm, người ta thường dùng muối NH4HCO3 hoặc muối (NH4)2CO3 để làm xốp bánh (hay còn gọi là làm bột nở). Hãy giải thích tại sao, viết phương trình hóa học minh họa. Muối NH4HCO3 và muối (NH4)2CO3 kém bền với nhiệt. Khi nướng hoặc hấp bánh, chúng dễ bị nhiệt phân tạo ra một hỗn hợp khí và hơi nước thoát ra, làm cho bánh xốp và nở. 0,5 NH4HCO3 NH3 + CO2 + H2O (NH4)2CO3 2NH3 + CO2 + H2O 0,5 Câu 8: (2 điểm) Sục một thể tích khí CO2 nặng 8,8 gam vào 200 ml dung dịch NaOH 1,5 M thu được dung dịch X (thể tích dung dịch thay đổi không đáng kể). a) Tính nồng độ mol/l các chất có trong dung dịch X. b) Nêu hiện tượng xảy ra khi nhúng quỳ tím vào dung dịch X. Giải thích bằng phương trình hóa học. a) Lập tỉ lệ: Số mol OH-/số mol CO2 = 1,5 → Tạo 2 muối NaHCO3 x mol và Na2CO3 y mol. 0,5 Theo đề ta có hệ 2 phương trình: x + y = 0,2 và 2x + y = 0,3 → x = y = 0,1. 0,5 Nồng độ muối NaHCO3 = Nồng độ muối Na2CO3 = 0,1/0,2 = 0,5 M. 0,5 b) Quỳ tím hóa xanh. Giải thích: dung dịch có chứa ion CO32 và HCO3- bị thủy phân tạo môi trường bazơ. CO32 + H2O ↔ HCO3- + OH- 0,5 * Dành cho lớp 11H Câu 9: (2 điểm) Cho sơ đồ biến hóa sau: CuCl/NH4Cl + H2 (dư)/ Ni, to Xúc tác, to + dung dịch KMnO4 + dd AgNO3/ NH 3 Ni, to C2H2 A B C D E Hãy xác định công thức cấu tạo của A, B, C, D, E. Viết phương trình hóa học cho phản ứng từ C → D và từ A → E. A: H - C≡C – CH = CH2 B: CH3 – CH2 – CH2 – CH3 0,25 C: CH3 – CH = CH2 hoặc CH2=CH2 0,25 D: CH3 – CH(OH) – CH2OH hoặc CH2OH – CH2OH 0,25 E: Ag - C≡C – CH = CH2 0,25 Viết đúng 2 phương trình 0,5x2 Câu 10: (1 điểm) Hỗn hợp khí X gồm có 0,3 mol H2 và 0,1 mol vinylaxetilen. Nung X trong một thời gian với xúc tác Ni thu được hỗn hợp khí Y có tỉ khối so với không khí là 1. Nếu cho toàn bộ Y sục từ từ vào dung dịch Br2 (dư) thì có m gam Br2 tham gia phản ứng. Tính m. mY = mX = 2.0,3 + 52.0,1 = 5,8 g nY = mY/29 = 0,2 mol. Số mol hiđro phản ứng = 0,4 – 0,2 = 0,2 (mol). 0,5 Ta có: H–C≡C – CH = CH2 + 2H2 → CH3 – CH2 – CH = CH2 (mol) 0,1 0,2 0,1 CH3 – CH2 – CH = CH2 + Br2 → CH3 – CH2 – CHBr – CH2Br (mol) 0,1 0,1 Khối lượng brom phản ứng: m = 160.0,1 = 16 gam 0,5
Tài liệu đính kèm:
 Hoa_Ch+NC_(LE QUY DON)_HK1_11.doc
Hoa_Ch+NC_(LE QUY DON)_HK1_11.doc





