Tài liệu Tổng kết Hóa học 12
Bạn đang xem 20 trang mẫu của tài liệu "Tài liệu Tổng kết Hóa học 12", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
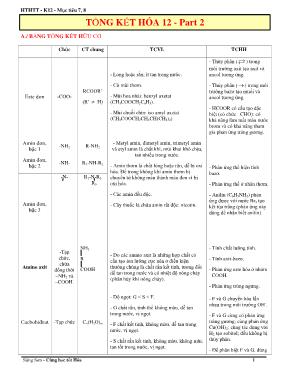
HTHTT - K12 - Mục tiêu 7, 8 Sáng Sơn - Cùng học tốt Hóa 1 A./ BẢNG TỔNG KẾT HỮU CƠ Chức CT chung TCVL TCHH Este đơn -COO- RCOOR’ (R’ H) - Lỏng hoặc rắn; ít tan trong nước. - Có mùi thơm. - Mùi hoa nhài: benzyl axetat (CH3COOCH2C6H5). - Mùi chuối chín: iso amyl axetat (CH3COOCH2CH2CH(CH3)2) - Thủy phân ( ) trong môi trường axit tạo axit và ancol tương ứng. - Thủy phân ( ) trong môi trường bazơ tạo muối và ancol tương ứng. - HCOOR có cấu tạo đặc biệt (có chức –CHO): có khả năng làm mất màu nước brom và có khả năng tham gia phản ứng tráng gương. Amin đơn, bậc 1 -NH2 R-NH2 - Metyl amin, đimetyl amin, trimetyl amin và etyl amin là chất khí, mùi khai khó chịu, tan nhiều trong nước. - Amin thơm là chất lỏng hoặc rắn, dễ bị oxi hóa. Để trong không khí amin thơm bị chuyển từ không màu thành màu đen vì bị oxi hóa. - Các amin đều độc. - Cây thuốc là chứa amin rất độc: nicotin. - Phản ứng thể hiện tính bazơ. - Phản ứng thế ở nhân thơm. - Anilin (C6H5NH2) phản ứng được với nước Br2 tạo kết tủa trắng (phản ứng này dùng để nhận biết anilin). Amin đơn, bậc 2 -NH- R1-NH-R2 Amin đơn, bậc 3 -N- R1-N-R2 R3 Amino axit -Tạp chức, chứa đồng thời –NH2 và –COOH. NH2 R COOH - Do các amino axit là những hợp chất có cấu tạo ion lưỡng cực nên ở điều kiện thường chúng là chất rắn kết tinh, tương đối dễ tan trong nước và có nhiệt độ nóng chảy (phân hủy khi nóng chảy). - Tính chất lưỡng tính. - Tính axit-bazơ. - Phản ứng este hóa ở nhóm –COOH. - Phản ứng trùng ngưng. Cacbohiđrat -Tạp chức Cn(H2O)m - Độ ngọt: G < S < F. - G chất rắn, tinh thể không màu, dễ tan trong nước, vị ngọt. - F chất kết tinh, không màu, dễ tan trong nước, vị ngọt. - S chất rắn kết tinh, không màu, không mùi, tan tốt trong nước, vị ngọt. - F và G chuyển hóa lẫn nhau trong môi trường OH-. - F và G cùng có phản ứng tráng gương; cùng phản ứng Cu(OH)2; cùng tác dụng với H2 tạo sobitol; đều không bị thủy phân. - Để phân biệt F và G, dùng TỔNG KẾT HÓA 12 - Part 2 Thiên tài gồm 1% là năng khiếu, còn 99% là mồ hôi - Thomas Edison 2 Không gì tự đến, cũng chẳng gì tự đi! - T chất rắn, ở dạng bột vô định hình, màu trắng, không tan trong nước lạnh. Trong nước nóng, hạt tinh bột ngậm nước, trương phồng lên tạo dung dịch keo (hồ tinh bột). - X chất rắn dạng sợi, màu trắng, không mùi vị, không tan trong nước và nhiều dung môi hữu cơ khác. Tan được trong nước Svayde. nước Br2 thì G làm mất màu. - S, T, X cùng có phản ứng thủy phân trong môi trường axit. - S có phản ứng với Cu(OH)2. - T có phản ứng dung dịch iot tạo phức xanh tím. - X có 3OH, phản ứng với HNO3 (H2SO4 đặc) thu được xenlulozơ trinitrat. B./ LÝ THUYẾT QUAN TRỌNG PHẦN HỮU CƠ Cần hệ thống kiến thức theo từng chủ đề. I. Các khái niệm cần nhớ: Đồng phân, danh pháp. II. Tính chất vật lí: Trạng thái, so sánh nhiệt độ sôi, tính tan và ứng dụng. III. Tính chất hóa học (giới hạn trong chương trình lớp 12). 1. Những chất phản ứng với Na (K) giải phóng H2 là: Ancol, phenol, axit , H2O. 2. Những chất phản ứng dung dịch NaOH (KOH) là: phenol, axit , muối amoni, aminoaxit. 3. Những chất phản ứng với dung dịch NaOH (KOH) khi đun nóng: là este; dẫn xuất. 4. Những chất phản ứng với CaCO3, NaHCO3 giải phóng CO2 là: axit RCOOH. 5. Những chất phản ứng với dung dịch axit HCl, HBr là : ancol, amin, anilin, aminoaxit, muối amoni RCOONH4, muối của amin RNH3Cl. 6. Những chất có phản ứng với dung dịch AgNO3/ dd NH3 khi đun nóng có kết tủa Ag (phản ứng tráng bạc ): các chất có nhóm –CHO : RCHO , HCOOH , HCOOR , HCOONH4, glucozơ, fructozơ. 7. Những chất có phản ứng với Cu(OH)2/NaOH - Tạo thành muối, nước: là axit - Tạo thành dung dịch có màu xanh lam: các chất có nhiều nhóm OH kế cận: như etilen glycol ; glixerol , glucozơ; Fructozơ ; Saccarozơ. - Khi đun nóng tạo thành kết tủa có màu đỏ gạch Cu2O là : các chất có nhóm – CHO. 8. Những chất có phản ứng dung dịch nước brôm: - Làm mất màu dung dịch nước brôm: các chất không no có liên kết pi ( = ; ≡ ); andehit RCHO bị oxi hóa bới dd Br2. - Tạo kết tủa trắng: phenol; anilin. 9. Những chất có phản ứng cộng H2 (Ni): các chất có liên kết pi: ( =; ≡ ); benzen; nhóm chức anđehit RCHO; nhóm chức Xeton RCOR; tạp chức: glucozơ, fructozơ. 10. Các chất có phản ứng thủy phân : Tinh bột; xenlulozơ; saccarozơ, peptit; protein, este, chất béo. 11. Các chất có phản ứng trùng hợp : những chất có liên kết đôi (C=C) hay vòng không bền. 12. Những chất có phản ứng trùng ngưng là : Các chất có nhiều nhóm chức. 13. Polime thiên nhiên: cao su thiên nhiên, tơ tằm, bông, xenlulozơ, tinh bột. 14. Polime nhân tạo ( bán tổng hợp ): tơ Visco, tơ axetat, xenlulozơ trinitrat. 15. Polime tổng hợp ( điều chế từ phản ứng trùng hợp hay trùng ngưng): các polime còn lại : PE, PVC. 16. Polime được điều chế từ phản ứng trùng ngưng: Nilon-6 , Nilon-7, Nilon-6,6, tơ lapsan, nhựa PPF 17. Polime được điều chế từ phản ứng trùng hợp: (còn lại): PE, PVC , Caosubuna, Caosu buna-S, tơnitron . HTHTT - K12 - Mục tiêu 7, 8 Sáng Sơn - Cùng học tốt Hóa 3 18. Tơ có nguồn gốc xenlulozo : sợi bông, tơ Visco, tơ axetat 19. Tơ poliamit : Nilon-6 , Nilon-7 , Nilon-6,6 20. Tripeptit.polipeptit, protein, lòng trắng trứng: có phản ứng màu biure (phản ứng Cu(OH)2 có màu tím). IV. So sánh lực bazơ của các amin (lấy NH3 làm mốc amin no > NH3 > Amin thơm). V. Môi trường của dung dịch, pH (chú ý phenol, anilin, glixin không làm quỳ tím đổi màu) - Axit RCOOH: quỳ tím hóa đỏ. - Amin no: quỳ tím hóa xanh; aminoaxit (tùy vào số nhóm chức ). - Muối của axit mạnh bazơ yếu quỳ hóa đỏ; muối của axit yếu bazơ mạnh quỳ hóa xanh. VI. Nhận biết các chất hữu cơ - Nếu chỉ dùng 1 hoá chất nhận biết hợp chất hữu cơ thì hóa chất thường sử dụng là: • Quỳ tím (nếu thấy có amin, axit ) • Dung dịch brom (nếu thấy có Phenol , anilin, hợp chất không no ...). • Phân biệt giữa Glucozơ và Fructozơ dùng dung dịch brom. • Cu(OH)2 ( Nếu thấy có Glucozơ , Glixerol, anđehit, peptit... ) • Phân biệt giữa đipeptit và các polipeptit khác dùng Cu(OH)2 ( phản ứng màu biure) • Nhận biết protein (lòng trắng trứng ) : dùng Cu(OH)2 có màu tím xuất hiện hoặc dùng HNO3 có màu vàng. VII. Điều chế - Este (từ phản ứng este hóa : axit phản ứng với ancol) chú ý các este đặc biệt : vinyl axetat , phenyl axetat (điều chế riêng)... - Glucozơ (từ tinh bột, xenlulozơ, saccarozơ). - Ancol etylic (từ glucozơ bằng phương pháp lên men). - Anlin (từ nitrobenzen). - Các polime điều chế từ phản ứng trùng ngưng : (nilon -6, nilon-7, nilon-6,6 , tơ lapsan nhựa PPF). - Các polime điều chế từ phản ứng trùng hợp : (PE , PVC , PVA , cao su buna , tơ nitron ). PHẦN KIM LOẠI 1. Học thuộc cấu hình e: Na (z =11) [Ne]3s1 ; Mg (z =12) [Ne]3s2 ; Al(z =13) [Ne] 3s23p1 ; Fe (z=26) [Ar]3d64s2 ; Cr (z =24) [Ar]3d54s1 và suy ra vị trí trong bảng tuần hoàn. 2. Nhớ qui luật biến đổi tính chất trong nhóm A (từ trên xuống: tính kim loại tăng, bán kính nguyên tử tăng, năng lượng ion hóa giảm, độ âm điện giảm) Nhớ qui luật biến đổi tính chất trong chu kì (từ trái sang phải : tính kim loại giảm, bán kính nguyên tử giảm, năng lượng ion hóa tăng, độ âm điện tăng, tính phi kim tăng). 3. Tính chất vật lí chung của kim loại Tính dẻo, tính dẫn điện, tính dẫn nhiệt, ánh kim. Các tính chất vật lí chung này là do các electron tự do trong kim loại gây ra. - Kim loại dẻo nhất là : Au. - Kim loại dẫn điện tốt nhất là: Ag. - Kim loại khối lượng riêng nhỏ nhất (nhẹ nhất) là : Li (D = 0,5 g/cm3). - Kim loại khối lượng riêng lớn nhất (nặng nhất) là: Os ( D= 22,6 g/ cm3). - Kim loại cứng nhất: Cr (độ cứng =9/10). - Kim loại mềm nhất: Cs (độ cứng = 0,2 ). - Kim loại có nhiệt độ nóng chảy cao nhất là: W ( 34100c) thấp nhất là : Hg(-390c). 4. Nhớ dãy điện hóa của kim loại và áp dụng: ( kiến thức trọng tâm) đặc biệt chú ý cặp Fe3+/Fe2+ - Kim loại trước cặp Fe3+/Fe2+ phản ứng được với Fe3+. Ví dụ: Cu + 2FeCl3 CuCl2 + 2FeCl2. Thiên tài gồm 1% là năng khiếu, còn 99% là mồ hôi - Thomas Edison 4 Không gì tự đến, cũng chẳng gì tự đi! 5. Tính chất hóa học chung của kim loại : Tính khử: ( dễ bị oxi hóa) - Kim loại phản ứng với oxi : (trừ Ag , Pt , Au). - Kim loại phản ứng với HCl và H2SO4 loãng : (trừ Pb , Cu , Ag , Hg, Pt , Au ). - Kim loại phản ứng với HNO3 và H2SO4 đặc : (trừ Pt , Au ). - Kim loại phản ứng với HNO3 đặc nguội và H2SO4 đặc nguội : (trừ Al, Fe , Cr, Pt , Au ). - Kim loại phản ứng với nước ở đk thường : (có : nhóm IA , Ca, Sr , Ba ). - Kim loại phản ứng dung dịch kiềm (NaOH , KOH , Ba(OH)2 ) nhớ nhất : Al , Zn. - Kim loại trước cặp Fe3+/Fe2+ phản ứng với Fe3+. 6. Điều chế kim loại - Nguyên tắc : khử ion kim loại trong các hợp chất thành kim loại tự do: Mn+ + neM - Phương pháp điện phân nóng chảy : dùng điều chế kim loại nhóm IA , IIA , Al. - Phương pháp điện phân dung dịch muối : dùng điều chế kim loại sau nhôm. - Nhiệt luyện : dùng điều chế các kim loại : (Zn , Cr , Fe ). - Thủy luyện : thường nhất dùng điều chế các kim loại : (Cu , Ag ). 7. Sự ăn mòn kim loại Cần phân biệt giữa 2 loại ăn mòn - Ăn mòn hóa học ( không làm phát sinh dòng điện ) - Ăn mòn điện hóa ( chú ý gợi ý của đề : có 2 kim loại, hợp kim gang, thép để trong dung dịch chất điện li HCl, dd muối, không khí ẩm ). - Chú ý kim loại có tính khử mạnh hơn thì đóng vai trò cực âm (anot) bị ăn mòn. Ở cực âm xảy ra quá trình oxi hóa. Dòng electron di chuyển từ cực âm sang cực dương tạo nên dòng điện ). Ví dụ hợp kim Zn- Cu để trong dung dịch HCl loãng bị ăn mòn điện hóa (Zn làm cực âm và bị ăn mòn). 8. Học thuôc hai loại hợp kim của sắt : Gang và thép a. Gang: là hợp kim của sắt và C (%C= 2-5%) và một số các nguyên tố : Si , S, Mn , P - Nguyên tắc sản suất : Dùng than cốc (CO) khử sắt oxit ở nhiệt độ cao. - Nguyên liệu : quặng sắt , than cốc , chất chảy (CaCO3 hay SiO2). b. Thép: là hợp kim của sắt và C (% C : 0,01-2%) và một lượng rất nhỏ các nguyên tố: Si , S, Mn , P - Nguyên tắc sản suất : Oxi hóa C , Si , S, P có trong gang để làm giảm hàm lượng của các nguyên tố này . - Nguyên liệu : gang trắng , không khí , chất chảy (CaCO3 hay SiO2) 9. Công thức một số chất cần nhớ và ứng dụng 10. Nước cứng nước mềm và các phương pháp làm mềm nước cứng - Nước cứng là nước chứa nhiều ion Ca2+ hay Mg2+ - Nước mềm là nước chứa rất ít hay không chứa ion Ca2+ , Mg2+ - Nguyên tắc làm mềm nước : Làm giảm nồng độ các ion Ca2+ , Mg2+ trong nước cứng bằng cách chuyển các ion này thành các chất không tan. - Để làm mềm nước cứng tạm thời có thể dùng : đun sôi, dd NaOH, Ca(OH)2 vừa đủ, Na2CO3, Na3PO4. - Để làm mềm nước cứng vỉnh cữu hay toàn phần dùng : Na2CO3, hay Na3PO4. Chứa Ca, Mg Chứa Al Chứa Fe + CaCO3.MgCO3: đolomit. + CaSO4.2H2O thạch cao sống. + CaSO4.H2O thạch cao nung. + CaSO4.thạch cao khan. + CaCO3: đá vôi. + Al2O3.2H2O boxit. + Na3AlF6 : criolit. + K2SO4.Al2(SO4)3.24H2O : phèn chua. + Fe2O3 hematit. + Fe3O4 manhetit. + FeCO3 xiderit. + FeS2 pirit. HTHTT - K12 - Mục tiêu 7, 8 Sáng Sơn - Cùng học tốt Hóa 5 11. Thuộc tên kim loại kiềm - Nhóm IA : Li, Na, , Rb, Cs, Fr: (là kim loại nhẹ, mềm, dễ nóng chảy, phản ứng được với H2O tạo dung dịch kiềm, oxit, hidroxit tan trong nước tạo dung dịch kiềm là baz mạnh). 12. Thuộc tên kim loại kiềm thổ - Nhóm IIA : Be, Mg, Ca, Sr, Ba, Ra; chú ý Ca , Ba , Sr phản ứng với nước tạo dung dịch kiềm; CaO, BaO, SrO, Ca(OH)2, Ba(OH)2, Sr(OH)2 tan trong nước tạo dung dịch kiềm. 13. Phản ứng đặt trưng nhất bài Al là phản ứng với dung dịch kiềm 2Al + 2NaOH + 2H2O 2NaAlO2 + 3H2 Al2O3, Al(OH)3 tan trong dung dịch kiềm và dung dịch axit mạnh. - Cần nhớ phản ứng nhiệt nhôm : ví dụ : 2Al + Fe2O3 0t Al2O3 + 2Fe (ứng dụng để hàn kim loại) 2Al + Cr2O3 0tAl2O3 + 2Cr (ứng dụng để sản xuất crom). - Chú ý hiện tượng khi cho từ từ dung dịch NaOH vào dung dịch muối AlCl3 (có kết tủa trắng, dư NaOH kết tủa tan dần). 14. Sắt - Chú ý! - Các trường hợp Sắt phản ứng tạo hợp chất sắt (II): sắt phản ứng với HCl; H2SO4 loãng; S; dung dịch muối. - Các trường hợp Sắt phản ứng tạo hợp chất sắt (III): sắt phản ứng với HNO3 dư, H2SO4 đặc nóng dư, Cl2, Br2, dung dịch AgNO3 dư. - Tính chất hóa học của hợp chất Sắt (III) Fe2O3 , FeCl3 .: là tính oxi hóa - Hợp chất Sắt (II) FeO, FeCl2: có thể là chất khử hay oxi hóa (tùy phản ứng). - Các oxit sắt , hidroxit sắt là bazơ. 15. Crom - Chú ý! - Các trường hợp Crom phản ứng tạo hợp chất crom (II) : crom phản ứng với HCl, H2SO4 loãng - Các trường hợp Crom phản ứng tạo hợp chất crom (III) : crom phản ứng với HNO3 dư, H2SO4 đặc nóng dư, Cl2, Br2, O2, S. - Tính chất hóa học của hợp chất crom (IV) CrO3, K2Cr2O7 .: là tính oxi hóa. - Hợp chất Crom (III) Cr2O3, CrCl3: có thể là chất khử hay oxi hóa (tùy phản ứng). - Các oxit CrO, hidroxit Cr(OH)2 là bazơ. - Các oxit Cr2O3, hidroxit Cr(OH)3 lưỡng tính. - CrO3, H2CrO4, H2Cr2O7: là axit. 16. Các chất lưỡng tính cần nhớ +) Loại 1: oxit lưỡng tính Al2O3, Cr2O3, BeO, ZnO, PbO, SnO. +) Loại 2: Hiđroxit lưỡng tính Al(OH)3, Cr(OH)3, Zn(OH)2, Sn(OH)2, Pb(OH)2, Be(OH)2. +) Loại 3: Các muối axit của axit yếu ví dụ: HSO3-, HS-, HCO3-, HPO4-, H2PO3-... +) Loại 4: Các muối tạo bởi axit yếu và bazơ yếuví dụ: (NH4)2CO3; RCOONH4 ... +) Loại 5: Các aminoaxit, H2O. Chú ý: este RCOOR' không phải là chất lưỡng tính. 17. Biết phân biệt các chất vô cơ và các hiện tượng xảy ra trong thí nghiệm. 18. Đọc sơ bài hóa học và môi trường liên hệ các kiến thức trong đời sống. 19. Ghi nhớ điều kiện phản ứng trao đổi ion trong dung dịch (sản phẩm có : kết tủa, hay chất khí, hay chất điện li yếu). Thiên tài gồm 1% là năng khiếu, còn 99% là mồ hôi - Thomas Edison 6 Không gì tự đến, cũng chẳng gì tự đi! C./ PHẢN ỨNG QUAN TRỌNG (Thầy Tuấn - CHV) ESTE 1. RCOOC6H5 + 2NaOH ot RCOONa + C6H5ONa + H2O 2. RCOOCH=CH2 + NaOH otRCOONa + CH3CHO 3. RCOOC(CH3)=CH2 + NaOH otRCOONa + CH3COCH3 4. (C17H35COO)3C3H5 + H2O + oH , t 3C17H35COOH + C3H5(OH)3 5. C3H5(OOC R )3 + 3NaOH ot 3 R COONa + C3H5(OH)3 6. CH3COOH + CH≡CH CH3COOCH=CH2 7. bR(COOH)a + aR’(OH)b + oH , t Rb(COO)abR’a + abH2O 8. CH3COONa(r) + NaOH(r) oCaO, t CH4 + Na2CO3 9. CH3CH2COOH + Br2 ophotpho, tCH3CHBrCOOH + HBr 10. CH3COCH3 + HCN (CH3)2C(OH)CN 11. (CH3)2C(OH)CN + 2H2O + H+ (CH3)2C(OH)COOH + NH4+ 12. RCl + KCN RCN + KCl 13. RCN + 2H2O + H+ RCOOH + NH4+ 14. RMgCl + CO2 ot RCOOMgCl 15. RCOOMgCl + HCl ot RCOOH + MgCl2 16. C6H5CH(CH3)2 2 + 2 1) O 2) H O, HC6H5OH + CH3COCH3 17. RCOONa + HCl (dd loãng) RCOOH + NaCl 18. 2CH3COONa(r) + 4O2 otNa2CO3 + 3CO2 + 3H2O 19. CxHy(COOM)a + O2 ot M2CO3 + CO2 + H2O (sơ đồ phản ứng đốt cháy muối cacboxylat). CACBOHIĐRAT 1. CH2OH[CHOH]4CHO + 5(CH3CO)2O oxt, t CH3COOCH2[CHOOCCH3]4CHO + CH3COOH pentaaxetyl glucozơ 2. CH2OH[CHOH]4CHO + H2 oNi, t CH2OH[CHOH]4CH2OH Sobit (Sobitol) 3. CH2OH[CHOH]4CHO + 2Cu(OH)2 ot CH2OH[CHOH]4COOH + Cu2O +2H2O 4. ot 2 4 3 2 2 4 4 3 2CH OH[CHOH] CHO 2[Ag(NH ) ]OH CH OH[CHOH] COONH 2Ag 3NH H O glucozơ amoni gluconat 5. CH2OH[CHOH]4CHO + Br2 + H2O CH2OH[CHOH]4COOH + 2HBr 6. C6H12O6 oxt, t 2C2H5OH + 2CO2 7. C6H12O6 oxt, t 2CH3–CHOH–COOH Axit lactic (axit sữa chua) 8. (C6H10O5)n + nH2O oxt, t nC6H12O6 (Tinh bột) (Glucozơ) 9. (C6H10O5)n + nH2O oxt, t nC6H12O6 (Xenlulozơ) (Glucozơ) 10. 6HCHO oxt, t C6H12O6 HTHTT - K12 - Mục tiêu 7, 8 Sáng Sơn - Cùng học tốt Hóa 7 11. OH OH H OH H OHH OH CH2OH 1 OH OH H OCH3 H OHH OH CH2OH + HOCH3 HCl + H2O 23 4 5 6 1 23 4 5 6 metyl -glucozit 12. CH2OH[CHOH]3COCH2OH OH CH2OH[CHOH]4CHO 13. C12H22O11 (saccarozơ) + H2O oxt, t C6H12O6 (glucozơ) + C6H12O6 (fructozơ) 14. C12H22O11 + Ca(OH)2 + H2O C12H22O11.CaO.2H2O 15. C12H22O11.CaO.2H2O + CO2 C12H22O11 + CaCO3+ 2H2O 16. 6nCO2 + 5nH2O oxt, t (C6H10O5)n 17. [C6H7O2(OH)3]n + 2nHONO2 oxt, t [C6H7O2(ONO2)2(OH)]n + 2nH2O (HNO3) xenlulozơ đinitrat 18. [C6H7O2(OH)3]n + 3nHONO2 oxt, t [C6H7O2(ONO2)3]n + 3nH2O (HNO3) xenlulozơ trinitrat 19. [C6H7O2(OH)3]n + 2n(CH3CO)2O ot [C6H7O2(OOCCH3)2(OH)]n + 2nCH3COOH anhiđrit axetic xenlulozơ điaxetat 20. [C6H7O2(OH)3]n + 3n(CH3CO)2O ot [C6H7O2(OOCCH3)3]n + 3nCH3COOH anhiđrit axetic xenlulozơ triaxetat HỢP CHẤT CHỨA NITƠ 1. C2H5–NH2 + HONO 2NaNO HClC2H5–OH + N2 + H2O 2. C6H5–NH2 + HONO + HCl o0 5 C C6H5N2Cl + 2H2O 3. C6H5N2Cl + H2O C6H5OH + N2+ HCl 4. R(R’)N – H +HO – N=O otR(R’)N – N =O + H2O (nitroso – màu vàng) 5. CH3–NH2 + H2O CH3–NH3+ + OH- 6. CH3NH2 + H–COOH H–COONH3CH3 metylamoni fomiat 7. CH3NH2 + HNO3 CH3NH3NO3 8. C6H5NH2 + HCl C6H5NH3Cl phenylamoni clorua 9. CH3NH3Cl + NaOH CH3NH2 + NaCl + H2O 10. C6H5NH2 + CH3COOH CH3COONH3C6H5 11. C6H5NH2 + H2SO4 C6H5NH3HSO4 12. 2C6H5NH2 + H2SO4 [C6H5NH3]2SO4 Thiên tài gồm 1% là năng khiếu, còn 99% là mồ hôi - Thomas Edison 8 Không gì tự đến, cũng chẳng gì tự đi! 13. + 3Br2(dd) + 3HBr(dd) NH2 BrBr NH2 Br (dd) 14. R–NO2 + 6 H Fe HClR–NH2 + 2H2O 15. C6H5–NO2 + 6 H Fe HClC6H5–NH2 + 2H2O Cũng có thể viết : 16. R–NO2 + 6HCl + 3Fe R–NH2 + 3FeCl2 + 2H2O 17. R–OH + NH3 2 3Al O P R–NH2 + H2O 18. 2R–OH + NH3 2 3Al O P (R)2NH + 2H2O 19. 3R–OH + NH3 2 3Al O P (R)3N + 3H2O 20. R–Cl + NH3 2 5oC H OH100 C R – NH2 + HCl 21. R–NH2 + HCl R–NH3Cl 22. R–Cl + NH3 2 5oC H OH100 C R–NH3Cl 23. R–NH3Cl + NaOH R–NH2 + NaCl + H2O 24. 2R–Cl + NH3 2 5oC H OH100 C (R)2NH + 2HCl 25. 3R–Cl + NH3 2 5oC H OH100 C (R)3N + 3HCl 26. H2N–R–COOH H2N–R–COO- + H+ H3N+–R – COO- 27. H2NR(COOH)a + aNaOH H2N(COONa)a + aH2O 28. 2(H2N)bR(COOH)a + aBa(OH)2 [(H2N)bR(COO)a]2Baa + 2aH2O 29. H2N–R–COOH + Na H2N–R–COONa + 12 H2 30. (H2N)bR(COOH)a + aNa (H2N)bR(COONa)a + a2 H2 31. 2(H2N)bR(COOH)a + aNa2O 2(H2N)b R(COONa)a + aH2O 32. H2N–R–COOH + R’–OH HCl H2N–R–COOR’ + H2O 33. H2N–R–COOH + R’–OH + HCl HCl [H3N+–R–COOR’]Cl- + H2O 34. [H3N+–R–COOR’]Cl- + NH3 H2N–R–COOR’ + NH4Cl 35. H2N–R–COOH + HCl ClH3N–R–COOH 36. 2(H2N)bR(COOH)a + bH2SO4 [(H3N)bR(COOH)a]2(SO4)b 37. ClH3N–R–COOH + 2NaOH H2N–R–COONa + NaCl + H2O 38. H2N–R–COOH + HONO HCl HO–R–COOH + N2 + H2O 39. nH2N[CH2]5COOH NH[CH2]5CO n + nH2O xt, to, p 40. nH2N[CH2]6COOH xt, to, p HN[CH2]6CO + nH2On 41. CH3CH(Br)COOH + 3NH3 CH3CH(NH2)COONH4 + NH4Br HTHTT - K12 - Mục tiêu 7, 8 Sáng Sơn - Cùng học tốt Hóa 9 POLIME 1. Nhựa a. Nhựa PE nCH2 CH2 CH2 CH2 xt, to, p n etilen polietilen(PE) b. Nhựa PVC nCH2 CH Cl CH2 CH Cl xt, to, p vinyl clorua poli(vinyl clorua) (PVC) n c. Nhựa PS CH CH2 C6H5 CH CH2 C6H5 xt, to, p n n d. Nhựa PVA CH2 CH OCOCH3 xt, to, p CH CH2 OCOCH3 nn Thuỷ phân PVA trong môi trường kiềm thu được poli vinylic: CH2 CH OH + nNaOH + nCH3COONa toCH CH2 OCOCH3 n n e. Nhựa PMM (thuỷ tinh hữu cơ - plexiglas) nCH2 CH COOCH3 CH3 xt, to, p metyl metacrylat poli(metyl metacrylat) (PMM) CH CH2 CH3 COOCH3 n f. Nhựa PPF Poli(phenol - fomanđehit) (PPF) có 3 dạng: nhựa novolac, nhựa rezol, nhựa rezit. - Nhựa novolac: Nếu dư phenol và xúc tác axit. OH OH CH2 n+ nHCHO H+, to + nH2On - Nhựa rezol: Nếu dư fomanđehit và xúc tác bazơ. OH CH2 CH2OH CH2 CH2 OH CH2 ... ... Thiên tài gồm 1% là năng khiếu, còn 99% là mồ hôi - Thomas Edison 10 Không gì tự đến, cũng chẳng gì tự đi! - Nhựa rezit (nhựa bakelít): Nhựa rezol nóng chảy (150oC) và để nguội thu được nhựa có cấu trúc mạng lưới không gian. OH CH2H2C OH CH2 CH2 OH CH2 OH CH2 H2C CH2 OH CH2 CH2 OH CH2 CH2 ... ... . . . . . . ...... 2. Cao su a. Cao su buna nCH2=CHCH=CH2 0Na, t 2CH CH CH 2 nCH buta-1,3-đien (butađien) polibutađien (cao su buna) b. Cao su isopren nCH2 C CH CH2 CH3 CH3 CH2 C CH CH2 nxt, t o , p poliisopren (cao su isopren)2-metylbuta-1,3-dien (isopren) c. Cao su buna – S nCH2 CH CH CH2 + nCH CH2 C6H5 to, p, xt CH2 CH CH CH2 CH CH2 C6H5 n d. Cao
Tài liệu đính kèm:
 tai_lieu_tong_ket_hoa_hoc_12.pdf
tai_lieu_tong_ket_hoa_hoc_12.pdf






