Ma trận đề thi môn Hóa học 8 học kỳ I năm học 2015 - 2016
Bạn đang xem tài liệu "Ma trận đề thi môn Hóa học 8 học kỳ I năm học 2015 - 2016", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
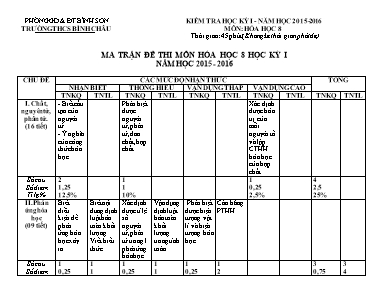
PHÒNG GD & ĐT BÌNH SƠN KIỂM TRA HỌC KỲ I - NĂM HỌC 2015-2016 TRƯỜNG THCS BÌNH CHÂU MÔN: HÓA HỌC 8 Thời gian: 45 phút (Không kể thời gian phát đề) MA TRẬN ĐỀ THI MÔN HÓA HỌC 8 HỌC KỲ I NĂM HỌC 2015 - 2016 CHỦ ĐỀ CÁC MỨC ĐỘ NHẬN THỨC TỔNG NHẬN BIẾT THÔNG HIỂU VẬN DỤNG THẤP VẬN DỤNG CAO TNKQ TNTL TNKQ TNTL TNKQ TNTL TNKQ TNTL TNKQ TNTL I. Chất, nguyên tử, phân tử. (16 tiết) - Biết cấu tạo của nguyên tử. - Ý nghĩa của công thức hóa học. Phân biệt được nguyên tử, phân tử, đơn chất, hợp chất. Xác định được hóa trị của mỗi nguyên tố và lập CTHH hóa học của hợp chất. Số câu Số điểm Tỉ lệ % 2 1,25 12,5% 1 1 10% 1 0,25 2,5% 4 2,5 25% II. Phản ứng hóa học (09 tiết) Biết điều kiện để phản ứng hóa học xảy ra. Biết nội dung định luật bảo toàn khối lượng. Viết biểu thức. Xác định được tỉ lệ số nguyên tử, phân tử trong 1 phản ứng hóa học. Vận dụng định luật bảo toàn khối lượng trong tính toán. Phân biệt được hiện tượng vật lí và hiện tượng hóa học. Cân bằng PTHH. Số câu Số điểm Tỉ lệ % 1 0,25 2,5% 1 1 10% 1 0,25 2,5% 1 1 10% 1 0,25 2,5% 1 2 20% 3 0,75 7,5% 3 4 40% III. Mol và tính toán hóa học (11 tiết) Biết số hạt nguyên tử trong 1 mol nguyên tử. Xác đinh được thể tích mol của chất khí ở đktc. Tính thành phần trăm theo khối lượng các nguyên tố trong hợp chất. Làm được bài toán tính khối lượng và thể tích của chất khí. Số câu Số điểm Tỉ lệ % 1 0,25 2,5% 1 0,25 2,5% 1 0,25 2,5% 2 2 20% 3 0,75 7,5% 2 2 20% TỔNG Số câu Số điểm Tỉ lệ % 4 1,75 17,5% 1 1 10% 3 1,5 15% 1 1 10% 2 0,5 5% 3 4 40% 1 0,25 2,5% 10 4 40% 5 6 60% TRƯỜNG THCS BÌNH CHÂU Họ và tên: .................................................... Lớp : .................................................... KIỂM TRA HỌC KỲ I (2015-2016) Môn : Hóa học 8 Thời gian: 15 phút (Phần TN) Điểm: A/ TRẮC NGHIỆM: ( 4 điểm ) Câu 1: (1 điểm) Khoanh tròn chữ cái đứng trước câu trả lời đúng: 1. Cho biết công thức hóa học hợp chất của nguyên tố X với O là: XO và hợp chất của nguyên tố Y với H là: YH3 (X; Y là những nguyên tố nào đó). Công thức hóa học đúng cho hợp chất X với Y là: A. X3Y2 B. X2Y3 C. XY3 D. XY 2. Một mol nguyên tử chứa bao nhiêu hạt nguyên tử ? A. 6.1025 B. 0,6.1023 C. 6.1023 D. 12.1023 3. Cho phương trình hoá học sau: 2Al + 3Cu(NO3)2 2Al(NO3)3 + 3Cu Tỉ lệ: Số nguyên tử Al : Số phân tử Cu(NO 3)2 : Số phân tử Al(NO3)3 : Số nguyên tử Cu lần lượt là: A. 2 : 1 : 1 : 3 B. 2 : 3 : 2 : 3 C. 2 : 3 : 1 : 3 D. 2 : 3 : 1 : 2 4. Trong hợp chất Fe2O3 phần trăm khối lượng các nguyên tố Fe và O lần lượt là: A. 50%; 50% B. 30%; 70% C. 75%; 25% D. 70%; 30% Câu 2: (1 điểm) Hãy chọn các cụm từ thích hợp để điền vào (........) trong các câu sau: Mỗi công thức hóa học chỉ một ......................................... của chất (trừ đơn chất kim loại), cho ta biết ................................................ tạo ra chất, số ............................................ của mỗi nguyên tố và .......................................... Câu 3: (1 điểm) Hãy ghép các ý ở cột A tương ứng với các ý ở cột B sao cho phù hợp: Cột A Cột B Kết quả 1. Nguyên tử 2. Phân tử 3. Đơn chất 4. Hợp chất a. Zn, O2, Al2(SO4)3, HCl b. KOH, FeCl2, H2O, Na2CO3 c. O2, Cl2, H2O, NaCl d. Cu, S, H, O e. O2, Cl2, Fe, Cu 1. + ..... 2. + ..... 3. + ..... 4. + ..... Câu 4: (1 điểm) Hãy điền Đ với câu trả lời đúng và S vào câu trả lời sai: 1. Hiện tượng cháy rừng là hiện tượng vật lí. 2. Để phản ứng hóa học xảy ra ta phải đun nóng các chất tham gia phản ứng. 3. Nguyên tử là hạt vô cùng nhỏ và trung hòa về điện. Các nguyên tử cùng loại có cùng số proton. 4. Ở đktc, thể tích mol của các chất khí điều bằng 24 lít. TRƯỜNG THCS BÌNH CHÂU Họ và tên: .................................................. Lớp : .................................................. KIỂM TRA HỌC KỲ I (2015-2016) Môn: Hóa học 8 Thời gian: 30 phút (Phần TL) Điểm: B/ TỰ LUẬN: (6 điểm ) Câu 1: (2 điểm) a/ Phát biểu định luật bảo toàn khối lượng. Viết biểu thức. b/ Vận dụng: Cho 2 gam khí hiđro (H2) tác dụng vừa đủ với 80 gam đồng (II) oxit (CuO), thu được 64 gam đồng kim loại (Cu) và nước (H2O). Tính khối lượng nước thu được. Câu 2: (2 điểm) Lập phương trình hóa học của các sơ đồ phản ứng hóa học sau: a/ Fe + O2 Fe3O4 b/ Al + CuSO4 Al2(SO4)3 + Cu c/ Na2CO3 + CaCl2 CaCO3 + NaCl d/ FeS2 + O2 Fe2O3 + SO2 Câu 3: (2 điểm) Cho 2,8 gam Fe tác dụng vừa đủ với dung dịch HCl theo phương trình hóa học: Fe + 2HCl FeCl2 + H2 a/ Tính khối lượng HCl tham gia phản ứng. b/ Tính thể tích khí H2 thu được ở điều kiện tiêu chuẩn. (Biết Fe = 56; Cl =35,5; H = 1) Bài làm: .................................................................................................................................................................................................................................................................................................................................................................................................................................................................................... ................................................................................................................................................................................................................................................................................................................................................................................................................................................................................... ................................................................................................................................................................................................................................................................................................................................................................................................................................................................................... ................................................................................................................................................................................................................................................................................................................................................................................................................................................................................... ................................................................................................................................................................................................................................................................................................................................................................................................................................................................................... ................................................................................................................................................................................................................................................................................................................................................................................................................................................................................... ................................................................................................................................................................................................................................................................................................................................................................................................................................................................................... ................................................................................................................................................................................................................................................................................................................................................................................................................................................................................... ........................................................................................................................................................... HƯỚNG DẪN CHẤM KIỂM TRA HỌC KỲ I NĂM HỌC 2015 - 2016 MÔN: HÓA HỌC LỚP: 8 A. PHẦN TRẮC NGHIỆM: (4 điểm) Câu 1: (1 điểm) Mỗi câu khoanh tròn đúng được 0,25 điểm. Câu 1 2 3 4 Đáp án A C B D Câu 2: (1 điểm) Thứ tự cần điền là: 1. Phân tử. 2. Nguyên tử. 3. Số nguyên tử. 4. Phân tử khối. (Mỗi ý đúng 0,25 điểm) Câu 3: (1 điểm) Mỗi câu ghép đúng 0,25 điểm. Kết quả ghép: 1. d 2. b, c 3. e 4. b Câu 4: (1 điểm) Điền chính xác mỗi ý 0,25 điểm. 1. S 3. Đ 2. S 4. S B. PHẦN TỰ LUẬN: (6 điểm) Câu Nội dung Điểm 1 (2 điểm) - Phát biểu đúng nội dung đinh luật: “Trong một phản ứng hóa học, tổng khối lượng của các chất sản phẩm bằng tổng khối lượng của các chất tham gia phản ứng”. - Viết đúng biểu thức: mA + mB = mC + mD - Tính đúng: = 18 (g) 0,75 điểm 0,25 điểm 1 điểm 2 (2 điểm) Lập đúng mỗi PTHH được 0,5 điểm. a/ Fe + O2 Fe3O4 b/ Al + CuSO4 Al2(SO4)3 + Cu c/ Na2CO3 + CaCl2 CaCO3 + NaCl d/ FeS2 + O2 Fe2O3 + SO2 0,5 điểm 0,5 điểm 0,5 điểm 0,5 điểm 3 (2 điểm) a/ Fe + 2HCl g FeCl2 + H2 1mol 2mol 0,05mol g 0,1mol b/ Theo PTHH, ta có: g 0,25 điểm 0,25 điểm 0,75 điểm 0,75 điểm
Tài liệu đính kèm:
 De_KT_HK1_mon_Hoa_8_20152016.doc
De_KT_HK1_mon_Hoa_8_20152016.doc





