Kiểm tra thi học kỳ I - Năm học: 2015 – 2016 môn: Hóa học khối: 9 (đề A)
Bạn đang xem tài liệu "Kiểm tra thi học kỳ I - Năm học: 2015 – 2016 môn: Hóa học khối: 9 (đề A)", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
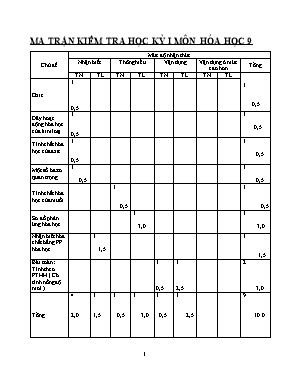
MA TRẬN KIỂM TRA HỌC KỲ I MÔN HÓA HỌC 9 Chủ đề Mức độ nhận thức Nhận biết Thông hiểu Vận dụng Vận dụng ở mức cao hơn Tổng TN TL TN TL TN TL TN TL 1 0,5 Oxit 1 0,5 Dãy hoạt động hóa học của kim loại 1 0,5 1 0,5 Tính chất hóa học của axit 1 0,5 1 0,5 Một số bazơ quan trọng 1 0,5 1 0,5 Tính chất hóa học của muối 1 0,5 1 0,5 Sơ đồ phản ứng hóa học 1 3,0 1 3,0 Nhận biết hóa chất bằng PP hóa học 1 1,5 1 1,5 Bài toán : Tính theo PTHH ( Có tính nồng độ mol ) 1 0,5 1 2,5 2 3,0 Tổng 4 2,0 1 1,5 1 0,5 1 3,0 1 0,5 1 2,5 9 10.0 Lớp: Thứ ..ngày..tháng năm 2015 Họ và tên:. KIỂM TRA THI HỌC KỲ I Năm học: 2015 – 2016 Môn: Hóa Học Khối: 9 ( ĐỀ A ) Thời gian: 45 phút SBD SỐ TỜ CHỮ KÝ GIÁM THỊ I CHỮ KÝ GIÁM THỊ II CHỮ KÝ GIÁM KHẢO I CHỮ KÝ GIÁM KHẢO II ĐIỂM LỜI PHÊ CỦA GIÁO VIÊN Phần I: Trắc nghiệm khách quan ( 3,0 điểm ) Chọn mỗi phương án đúng được 0,5 điểm ( học sinh làm trên giấy thi ) Câu 1: Oxit khi tan trong nước làm giấy quỳ chuyển thành màu đỏ là : A. MgO B. P2O5 C. K2O D. CaO Câu 2: Dãy kim loại nào sau đây được sắp xếp đúng theo chiều hoạt động hóa học tăng dần? A. K, Mg, Cu, Al, Zn, Fe B. Fe, Cu, K, Mg, Al, Zn C. Cu, Fe, Zn, Al, Mg, K D. Zn, K, Mg, Cu, Al, Fe Câu 3: Dung dịch H2SO4 loãng tác dụng với chất nào sau đây tạo ra khí hiđro ? A. NaOH B. Fe C. Cu D. CO2 Câu 4: Dùng để sản xuất xà phòng là bazơ : A. NaOH B. Ca(OH)2 C. KOH D. Zn(OH)2 Câu 5: Cặp chất không thể tồn tại trong cùng một dung dịch là: A. NaCl và CuSO4 B. Na2CO3 và BaCl2 C. NaNO3 và MgCl2 D. MgCl2 và BaCl2 Câu 6: Thể tích dung dịch HCl 0,1M cần dùng để trung hòa 50ml dung dịch NaOH 0,2M là A. 0,1 lít B. 0,2 lít C. 0,3 lít D. 0,4 lít Hãy chọn phương án đúng nhất và trả lời vào bảng sau: Câu 1 2 3 4 5 6 Đáp án Phần II: Tự luận ( 7,0 điểm ) Câu 1: (3,0 điểm ). Viết phương trình hóa học cho những chuyển đổi hóa học sau ( ghi điều kiện phản ứng, nếu có ) Fe (1) FeCl3 (2) Fe(OH)3 (3) Fe2O3 (4) Fe (5) FeCl2 (6) Fe(OH)2 ...................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................... ...................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................... Câu 2: ( 1,5 điểm ). Bằng phương pháp hóa học hãy phân biệt 3 dung dịch đựng riêng biệt trong 3 lọ mất nhãn sau: CuSO4, H2SO4 , NaCl. Viết phương trình hóa học ( nếu có ) ...................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................... ...................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................... ...................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................... Câu 3: ( 2,5 điểm ). Biết 2,24 lít khí CO2 ( đktc ) tác dụng vừa đủ với 200 ml dung dịch Ba(OH)2 sinh ra chất kết tủa trắng BaCO3 và nước Viết phương trinh hóa học Tính nồng độ mol của dung dịch Ba(OH)2 đã dùng. Tính khối lượng chất kết tủa thu được. ( Cho: Ba = 137, C = 12, O = 16 ) ...................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................... ...................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................... ...................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................... ...................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................... ...................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................... ...................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................... Giáo viên bộ môn Võ Văn Lâm ĐÁP ÁN ĐỀ A MÔN HÓA HỌC 9 – HKI NĂM HỌC: 2015 - 2016 Phần I: Trắc nghiệm khách quan ( 3,0 điểm ). HS chọn đúng mỗi phương án được 0,5 điểm Câu 1 2 3 4 5 6 Đáp án B C B A B A Phần II: Tự luận: ( 7,0 điểm ) Câu 1: (3,0 điểm ). HS viết đúng mỗi PTHH được 0,5 điểm ( HS cân bằng sai hoặc thiếu điều kiện trừ 0,25 điểm ) 1) 2Fe + 3Cl2 t0 2FeCl3 2) FeCl3 + 3NaOH Fe(OH)3 + 3NaOH 3) 2Fe(OH)3 t0 Fe2O3 + 3H2O 4) Fe2O3 + 3CO t0 3Fe + 3CO2 5) Fe + 2HCl FeCl2 + H2 6) FeCl2 + 2NaOH Fe(OH)2 + 2NaCl Câu 2: ( 1,5 điểm ). Nhận biết hóa chất bằng phương pháp hóa học: - Trích mỗi dung dịch một ít làm mẫu thử. ( 0,25 đ ) - Cho giấy quỳ tím lần lượt vào 3 ống nghiệm, nếu ống nghiệm nào làm quỳ tím hóa đỏ là dung dịch H2SO4 ( dd CuSO4 và dd NaCl không làm quỳ tím đổi màu ) ( 0,25 đ ) - Tiếp tục dùng dung dịch BaCl2 cho vào 2 ống nghiệm còn lại . Nếu ống nghiệm nào có kết tủa trắng là dung dịch CuSO4. ( 0,25 đ ) BaCl2 + CuSO4 BaSO4 + CuCl2 ( 0,5 đ ) - Còn lại là dd NaCl. ( 0,25 đ ) Câu 3 : Bài toán ( 2,5 điểm ) Số mol CO2 (đktc) tác dụng là: ( 0,5 đ ) Phương trình hóa học: CO2 + Ba(OH)2 BaCO3 + H2O ( 0,5 đ ) mol 1 1 1 1 mol 0,1 0,1 0,1 ( 0,5 đ ) - Nồng độ mol của dung dịch Ba(OH)2 đã dung: ( 0,5 đ ) - Khối lượng chất kết tủa BaCO3 là: ( 0,5 đ ) Lớp: Thứ ..ngày..tháng năm 2015 Họ và tên:. KIỂM TRA THI HỌC KỲ I Năm học: 2015 – 2016 Môn: Hóa Học Khối: 9 ( ĐỀ B ) Thời gian: 45 phút SBD SỐ TỜ CHỮ KÝ GIÁM THỊ I CHỮ KÝ GIÁM THỊ II CHỮ KÝ GIÁM KHẢO I CHỮ KÝ GIÁM KHẢO II ĐIỂM LỜI PHÊ CỦA GIÁO VIÊN Phần I: Trắc nghiệm khách quan ( 3,0 điểm ) Chọn mỗi phương án đúng được 0,5 điểm ( học sinh làm trên giấy thi ) Câu 1: Dãy kim loại nào sau đây được sắp xếp đúng theo chiều hoạt động hóa học tăng dần? A. K, Mg, Cu, Al, Zn, Fe B.Cu, Fe, Zn, Al, Mg, K C. Fe, Cu, K, Mg, Al, Zn D. Zn, K, Mg, Cu, Al, Fe Câu 2: Dung dịch H2SO4 tác dụng với chất nào tạo ra khí hiđro ? A. NaOH B. CaO C. Zn D. CO2 Câu 3: Oxit khi tan trong nước làm giấy quỳ chuyển thành màu đỏ là : A. MgO B. CaO C. K2O D. SO3 Câu 4: Dùng để sản xuất xà phòng là bazơ : A. NaOH B. Ca(OH)2 C. KOH D. Zn(OH)2 Câu 5: Thể tích dung dịch HCl 0,1M cần dùng để trung hòa 50ml dung dịch NaOH 0,2M là A. 0,4 lít B. 0,3 lít C. 0,2 lít D. 0,1 lít Câu 6: Cặp chất không thể tồn tại trong cùng một dung dịch là: A. Na2CO3 và BaCl2 B. NaCl và CuSO4 C. NaNO3 và MgCl2 D. MgCl2 và BaCl2 Hãy chọn phương án đúng nhất và trả lời vào bảng sau: Câu 1 2 3 4 5 6 Đáp án Phần II: Tự luận ( 7,0 điểm ) Câu 1: (3,0 điểm ). Viết phương trình hóa học cho những chuyển đổi hóa học sau ( ghi điều kiện phản ứng, nếu có ) Fe (1) FeCl3 (2) Fe(OH)3 (3) Fe2O3 (4) Fe (5) FeCl2 (6) Fe(OH)2 ...................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................... ...................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................... Câu 2: ( 1,5 điểm ). Bằng phương pháp hóa học hãy phân biệt 3 dung dịch đựng riêng biệt trong 3 lọ mất nhãn sau: CuSO4, HCl , NaCl. Viết phương trình hóa học ( nếu có ) ...................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................... ...................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................... ...................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................... Câu 3: ( 2,5 điểm ). Biết 5,6 lít khí SO2 ( đktc ) tác dụng vừa đủ với 200 ml dung dịch Ba(OH)2 sinh ra chất kết tủa trắng BaSO3 và nước Viết phương trinh hóa học Tính nồng độ mol của dung dịch Ba(OH)2 đã dùng. Tính khối lượng chất kết tủa thu được. ( Cho: Ba = 137, S = 32, O = 16 ) ...................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................... ...................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................... ...................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................... ...................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................... ...................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................... ...................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................... Giáo viên bộ môn Võ Văn Lâm ĐÁP ÁN ĐỀ B MÔN HÓA HỌC 9 – HKI NĂM HỌC: 2015 - 2016 Phần I: Trắc nghiệm khách quan ( 3,0 điểm ). HS chọn đúng mỗi phương án được 0,5 điểm Câu 1 2 3 4 5 6 Đáp án B C D A D A Phần II: Tự luận: ( 7,0 điểm ) Câu 1: (3,0 điểm ). HS viết đúng mỗi PTHH được 0,5 điểm ( HS cân bằng sai hoặc thiếu điều kiện trừ 0,25 điểm ) 1) 2Fe + 3Cl2 t0 2FeCl3 2) FeCl3 + 3NaOH Fe(OH)3 + 3NaOH 3) 2Fe(OH)3 t0 Fe2O3 + 3H2O 4) Fe2O3 + 3CO t0 3Fe + 3CO2 5) Fe + 2HCl FeCl2 + H2 6) FeCl2 + 2NaOH Fe(OH)2 + 2NaCl Câu 2: ( 1,5 điểm ). Nhận biết hóa chất bằng phương pháp hóa học: - Trích mỗi dung dịch một ít làm mẫu thử. ( 0,25 đ ) - Cho giấy quỳ tím lần lượt vào 3 ống nghiệm, nếu ống nghiệm nào làm quỳ tím hóa đỏ là dung dịch HCl ( dd CuSO4 và dd NaCl không làm quỳ tím đổi màu ) ( 0,25 đ ) - Tiếp tục dùng dung dịch BaCl2 cho vào 2 ống nghiệm còn lại . Nếu ống nghiệm nào có kết tủa trắng là dung dịch CuSO4. ( 0,25 đ ) BaCl2 + CuSO4 BaSO4 + CuCl2 ( 0,5 đ ) - Còn lại là dd NaCl. ( 0,25 đ ) Câu 3 : Bài toán ( 2,5 điểm ) Số mol SO2 (đktc) tác dụng là: ( 0,5 đ ) Phương trình hóa học: SO2 + Ba(OH)2 BaSO3 + H2O ( 0,5 đ ) mol 1 1 1 1 mol 0,25 0,25 0,25 ( 0,5 đ ) - Nồng độ mol của dung dịch Ba(OH)2 đã dung: ( 0,5 đ ) - Khối lượng chất kết tủa BaSO3 là: ( 0,5 đ )
Tài liệu đính kèm:
 De_thi_HK_I_Hoa_hoc_9.doc
De_thi_HK_I_Hoa_hoc_9.doc





