Kiểm tra học kì II môn Hóa 9 - Năm 2014 - 2015
Bạn đang xem tài liệu "Kiểm tra học kì II môn Hóa 9 - Năm 2014 - 2015", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
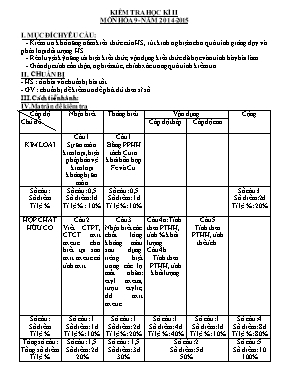
KIỂM TRA HỌC KÌ II MƠN HĨA 9- NĂM 2014-2015 I. MỤC ĐÍCH YÊU CẦU: - Kiểm tra khả năng nắm kiến thức của HS, rút kinh nghiệm cho quá trình giảng dạy và phân loại đối tượng HS. - Rèn luyện kỹ năng tái hiện kiến thức, vận dụng kiến thức đã học vào trình bày bài làm. - Giáo dục tính cẩn thận, nghiêm túc, chính xác trong quá trình kiểm tra. II. CHUẨN BỊ - HS : ơn bài và chuẩn bị bài tốt . - GV : chuẩn bị đề kiểm tra để phát đủ theo sĩ số III.Cách tiến hành: IV.Ma trận đề kiểm tra Cấp độ Chủ đề Nhận biết Thơng hiểu Vận dụng Cộng Cấp độ thấp Cấp độ cao KIM LOAI Câu 1 Sự ăn mịn kim loại, biện pháp bảo vệ kim loại khơng bị ăn mịn Câu 1 Bằng PPHH tách Cu ra khỏi hỗn hợp Fe và Cu. Số câu: Số điểm Tỉ lệ % Số câu: 0,5 Số điểm:1đ Tỉ lệ % : 10% Số câu: 0,5 Số điểm: 1đ Tỉ lệ %: 10% Số câu:1 Số điểm:2đ Tỉ lệ %: 20% HỢP CHẤT HỮU CƠ Câu 2 Viết CTPT, CTCT axit axetic. cho biết tại sao axit axetic cĩ tính axit Câu 3 Nhận biết các chất lỏng khơng màu sau đựng riêng biệt trong các lọ mất nhãn: etyl axetat, rượu etylic, dd axit axetic. Câu 4a: Tính theo PTHH, tính % khối lượng Câu 4b Tính theo PTHH, tính khối lượng Câu 5 Tính theo PTHH, tính thể tích. Số câu: Số điểm Tỉ lệ % Số câu: 1 Số điểm: 1đ Tỉ lệ %: 10% Số câu: 1 Số điểm: 2đ Tỉ lệ %: 20% Số câu: 1 Số điểm: 4đ Tỉ lệ %: 40% Số câu: 1 Số điểm:1đ Tỉ lệ %: 10% Số câu: 4 Số điểm: 8đ Tỉ lệ %: 80% Tổng số câu: Tổng số điểm Tỉ lệ % Số câu: 1,5 Số điểm: 2đ 20% Số câu: 1,5 Số điểm: 3đ 30% Số câu: 2 Số điểm: 5đ 50% Số câu: 5 Số điểm: 10 100% V>Đề kiểm tra: Trường THCS Hịa Đơng ĐỀ KIỂM TRA HỌC KÌ II Họ và tên: Mơn: Hĩa học ( Khối 9) Lớp:. Thời gian:45’(khơng kể thời gian phát đề) ---------------o0o---------------- Câu 1 (2 điểm) - Thế nào là sự ăn mịn kim loại? Nêu một số biện pháp để bảo vệ kim loại khỏi bị ăn mịn? - Bằng phương pháp hĩa học hãy tách Cu ra khỏi hỗn hợp Fe và Cu. Câu 2 (1 điểm) Viết cơng thức phân tử và cơng thức cấu tạo của axit axetic và cho biết tại sao axit axetic cĩ tính axit Câu 3: (2 điểm) Trình bày phương pháp hĩa học nhận biết các chất lỏng khơng màu sau đựng riêng biệt trong các lọ mất nhãn: etyl axetat, rượu etylic, dd axit axetic. Câu 4 (4 điểm) Cĩ 5,8 gam hỗn hợp A gồm axit axetic và rượu etylic cho tác dụng với Natri dư thì được 1344ml khí hiđro (ở đktc). Tính thành phần % khối lượng mỗi chất trong hỗn hợp A. Nếu cho thêm H 2 SO 4 đặc vào hỗn hợp A và đun nĩng thì sau phản ứng thu được những sản phẩm gì? Khối lượng là bao nhiêu gam? Câu 5: (1 điểm) Tính thể tích khí oxi (đktc) cần dùng cho sự lên men giấm hồn tồn 1 lit rượu vang 9,20 (biết Drượu nguyên chất = 0,8g/ml) VI -ĐÁP ÁN Đáp án Thang điểm Câu 1: -Sự ăn mịn kim loại là sự phá hủy kim loại, hợp kim do tác dụng hĩa học trong mơi trường. + Biện pháp: Ngăn khơng cho kim loại tiếp xúc với mơi trường, chế tạo các hợp kim ít bị ăn mịn. - Cho axit du vào hỗn hợp 2 kim loại → nhận Fe phản ứng, tách được kim loại Cu Pt: Fe + 2HCl → FeCl 2 + H 2 Câu 2: Cơng thức phân tử C2H4O2, cơng thức cấu tạo Phân tử axit axêtic cĩ tính axit vì trong phân tử cĩ nhĩm – OH kết hợp với nhĩm >C=O tạo thành nhĩm –COOH Câu 3: Dùng quỳ tím nhận ra được axit axetic vì làm quỳ tím chuyển đỏ. Dùng kim loại natri nhận ra được rượu etylic vì phản ứng cĩ khí thốt ra. 2Na + 2C2H5OH 2C2H5ONa + H2 Chất lỏng khơng làm đổi màu quỳ tím và khơng phản ứng với kim loại natri là etyl axetat. Câu 4: a) 2CH 3 COOH + 2Na 2CH 3 COONa + H 2 2C 2 H 5 OH + 2Na 2C 2 H 5 ONa + H 2 H2SO4 đặc , t0 CH 3 COOH + C 2 H 5 OH CH 3 COOC 2 H 5 + H 2 O n H2 =0,06mol hệ pt: 60x + 46y = 5,8 x/2 + y/2 = 0,06 x= 0,02, y= 0,1 m axit axetic = 1,2 gam , m rượu = 4,6gam % CH 3 COOH = 20,69% , % C 2 H 5 OH = 79,31% b) Sản phẩm thu được là CH 3 COOC 2 H 5 , C 2 H 5 OH dư. mCH 3 COOC 2 H 5 = 0,02.88 = 1,76g m rượu dư = 0,08.46= 3,68g Câu 5: Thể tích rượu etylic nguyên chất : Số g rượu etylic nguyên chất: 92. 0,8 = 73,6g Số mol C2H5OH: = 1,6 mol PTHH: C2H5OH + O2 CH3COOH + H2O 1,6 1,6 (mol) Thể tích khí oxi cần dùng: 1,6. 22,4 = 35,84 lit 0,5đ 0,5đ 0,5đ 0,5đ 0,5đ 0,5đ 0,5đ 0,5đ 0,5đ 0,5đ 0,25đ 0,25đ 0,25đ 0,25đ 0,5đ 0,5đ 0,5đ 0,5đ 0,25đ 0,25đ 0,5đ 0,2đ 0,2đ 0,2đ 0,2đ 0,2đ
Tài liệu đính kèm:
 ĐỀ KIỂM TRA HỌC KÌ II - HOA 9 - 2014- 2015.doc
ĐỀ KIỂM TRA HỌC KÌ II - HOA 9 - 2014- 2015.doc





