Kiểm tra học kì I tiết 36 - Năm học : 2013- 2014 môn : Hóa học - Lớp 9 thời gian : 45 phút
Bạn đang xem tài liệu "Kiểm tra học kì I tiết 36 - Năm học : 2013- 2014 môn : Hóa học - Lớp 9 thời gian : 45 phút", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
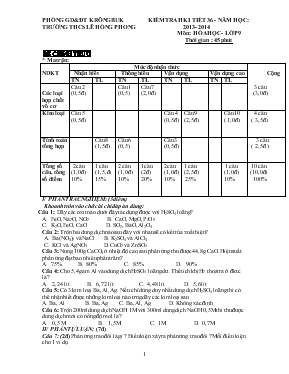
PHÒNG GD& ĐT KRÔNG BUK TRƯỜNG THCS LÊ HỒNG PHONG KIỂM TRA HKI TIẾT 36 - NĂM HỌC : 2013- 2014 Môn : HÓA HỌC - LỚP 9 Thời gian : 45 phút ĐỀ CHÍNH THỨC * Ma trận: NDKT Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng Vận dụng cao TN TL TN TL TN TL TN TL Các loại hợp chất vô cơ Câu 2 (0,5đ) Câu1 (0,5) Câu 7 (2,0đ) 3 câu (3,0đ ) Kim loại Câu 5 (0,5đ) Câu 4 (0,5đ) Câu 9 (2,5đ) Câu 10 ( 1,0đ) 4 câu ( 3,5 đ) Tính toán tổng hợp Câu 8 (1,5đ) Câu 6 (0,5) Câu3 (0,5đ) 3 câu ( 2,5 đ ) Tổng số câu, tổng số điểm 2câu (1,0đ) 10% 1 câu (1,5,đ) 15% 2 câu (1,0đ) 10% 1câu (2đ) 20% 2câu (1,0đ) 10% 1 câu (2,5đ) 25% 1 câu (1,0đ) 10% 10 câu (10,0đ) 100% I/ PHẦN TRẮC NGHIỆM: (3điểm) Khoanh tròn vào chữ cái chỉ đáp án đúng: Câu 1: Dãy các oxit nào dưới đây tác dụng được với H2SO4 loãng? A. FeO, Na2O, NO2 B. CaO, MgO, P2O5 C. K2O, FeO, CaO D. SO2, BaO, Al2O3 Câu 2: Trộn hai dung dịch nào sau đây với nhau sẽ có kết tủa xuất hiện? A. Ba(NO3)2 và NaCl B. K2SO4 và AlCl3 C. KCl và AgNO3 D.CuCl2 và ZnSO4 Câu 3: Nung 100g CaCO3 ở nhiệt độ cao, sau phản ứng thu được 44,8g CaO. Hiệu suất phản ứng đạt bao nhiêu phần trăm? A. 75% B. 80% C. 85% D. 90% Câu 4: Cho 5,4 gam Al vào dung dịch H2SO4 loãng dư. Thể tích khí H2 thoát ra ở đktc là? A. 2,24 lít B. 6,72 lít C. 4,48 lít D. 5,6 lít Câu 5: Có 3 kim loại Ba, Al, Ag. Nếu chỉ dùng duy nhất dung dịch H2SO4 loãng thì có thể nhận biết được những kim loại nào trng dãy các kim loại sau A. Ba, Al B. Ba, Ag C. Ba, Al, Ag D. Không xác định Câu 6: Trộn 200ml dung dịch NaOH 1M với 300ml dung dịch NaOH 0,5M thì thu được dung dịch mới có nồng độ mol là? A. 0,5 M B. 1,5M C. 1M D. 0,7M. II/ PHẦN TỰ LUẬN: (7đ) Câu 7: (2đ) Phản ứng trao đổi là gì ? Điều kiện xảy ra phản ứng trao đổi ? Mỗi điều kiện cho 1 ví dụ Câu 8: (2đ) Bằng phương pháp hóa học, hãy nhận biết các dung dịch sau: H2SO4, Na2SO4 , NaCl Câu 9:(2,5đ) Cho 14,6 gam hỗn hợp gồm Ag và Fe tác dụng với 300 ml dung dịch H2SO4 (vừa đủ) . Sau phản ứng thu được 2,24 lít khí ( đktc). a/ Tính thành phần % theo khối lượng mỗi kim loại trong hỗn hợp ban đầu b/Tính nồng độ của dung dịch H2SO4 cần dùng ? c/ Tính nồng độ mol của sản phẩm tạo thành sau phản ứng ? Coi thể tích dung dịc thay đổi không đáng kể ? (H = 1 ; S = 32 ; O = 16 ; Fe = 56 ; Ag = 108 ) Câu 10: (1 đ ) Cho 8 gam 1 oxit của kim loại hóa trị II tác dụng vừa đủ với 200ml dung dịch H2SO4 1M. Xác định công thức oxit kim loại ? (HS chỉ được sử dụng bảng tuần hoàn các nguyên tố hóa học) * Đáp án: I/ PHẦN TRẮC NGHIỆM: ( 3 đ) Câu 1 2 3 4 5 6 Đáp án C C B B C D II/ PHẦN TỰ LUẬN: ( 7đ) Câu 7: (2 đ) – Khái niệm: Là PUHH trong đó hai chất tham gia phản ứng trao đổi với nhau những thành phần cấu tạo của chúng để tạo ra những hợp chất mới. ( 0,5 đ ) - Điều kiện:Chỉ xảy ra nếu sản phẩm tạo thành có chất không tan hoặc chất khí ( 0,5 đ) - Ví dụ: CuSO4 + 2NaOH Cu(OH)2 + Na2SO4 ( 0,5 đ ) Na2CO3 + H2SO4 Na2SO4 + CO2 + H2O ( 0,5 đ) (Mọi ví dụ khác đúng đều đạt điểm tối đa) Câu 8: ( 1,5 đ) - Cho quỳ tím vào dung dịch trên , dung dịch nào làm quỳ tím hóa đỏ là H2SO4, không có hiện tượng gì là NaCl, Na2SO4 ( 0,5 đ) - Cho dung dịch BaCl2 vào, dung dịc nào có kết tủa trắng là Na2SO4, không có hiện tượng gì là NaCl ( 0,5 đ) PTHH: Na2SO4 + BaCl2 BaSO4 + 2NaCl ( 0,5 đ) Câu 9 : ( 2 đ) Chỉ có Fe tác dung với dd H2SO4 sinh ra chất khí, Ag không phản ứng PT: Fe + H2SO4 (loãng) FeSO4 + H2 (0,5 đ) 0,1mol 0,1mol 0,1 mol 0,1 mol a/ mFe = 0.1 . 56 = 5,6 gam % mFe = x 100% = 38,36% ( 0,5 đ) % mAg = 100% - 38,36 % = 61,64 % ( 0,5 đ) b/ CM H2SO4 = = 0,33 M ( 0,5 đ) c/ CM FeSO4 = = 0,33 M ( 0,5 đ) Câu 10: ( 1 đ) n H2SO4 = V. CM = 0,2 . 1 = 0,2 ( mol) - RO + H2SO4 RSO4 + H2O ( 0,5 đ) 0,1 (mol) 0,1(mol) MRO = = 40 R + 16 = 40 R = 24 ( Mg) . CT oxit: MgO ( 0,5 đ) Lưu ý : HS giải theo cách khác nếu đúng cũng cho điểm tối đa Duyệt tổ chuyên : GV ra đề: Bùi Thị Hồng Hạnh Đặng thị Lợi
Tài liệu đính kèm:
 Matran_de_va_dap_an_thi_HKI.doc
Matran_de_va_dap_an_thi_HKI.doc





