Kiểm tra học kì 1 năm 2016 - 2017 Môn Hóa học 8
Bạn đang xem tài liệu "Kiểm tra học kì 1 năm 2016 - 2017 Môn Hóa học 8", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
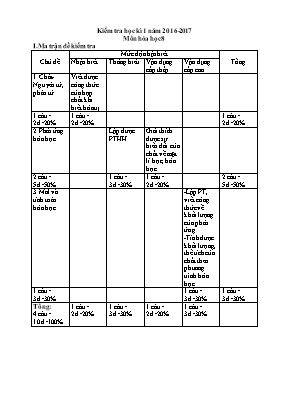
Kiểm tra học kì 1 năm 2016-2017 Môn hóa học 8 I.Ma trận đề kiểm tra Chủ đề Mức độ nhận biết Tổng Nhận biết Thông hiểu Vận dụng cấp thấp Vận dụng cấp cao 1.Chất-Nguyên tử, phân tử Viết được công thức của hợp chất khi biết hóa trị 1 câu= 2đ=20% 1 câu= 2đ=20% 1 câu= 2đ=20% 2.Phản ứng hóa học Lập được PTHH Giải thích được sự biến đổi của chất về mặt lí học, hóa học 2 câu= 5đ=50% 1 câu= 3đ=30% 1 câu= 2đ=20% 2 câu= 5đ=50% 3.Mol và tính toán hóa học -Lập PT, viết công thức về khối lượng của phản ứng. -Tính được khối lượng, thể tích của chất theo phương trình hóa học 1 câu= 3đ=30% 1 câu= 3đ=30% 1 câu= 3đ=30% Tổng: 4 câu= 10đ=100% 1 câu= 2đ=20% 1 câu= 3đ=30% 1 câu= 2đ=20% 1 câu= 3đ=30% II.Đề kiểm tra Đề 1: I. Lý thuyết (7 điểm) Câu 1(2đ): Viết công thức hóa học của các chất trong các trường hợp sau: Cu(II) và Cl b)Al(III) và SO4(II) c) K và (OH)(I) d) Ca(II) và O Câu 2(3đ): Lập phương trình hóa học của phản ứng sau: a) S + O2 → SO2 b) H2 + N2 → NH3 c) Na2O + H2O → NaOH d) Zn + HCl → ZnCl2 + H2 . e) Fe + O2 → Fe3O4 f) Na2SO4 + BaCl2 → BaSO4 + NaCl Câu 3 (2đ) Trong các trường hợp sau,trường hợp nào xảy ra hiện tượng vật lí, hoá học?Vì sao? a. Khói tạo ra từ các nhà máy, xí nghiệp b. Băng ở Nam cực tan dần ra II. Bài toán (3điểm) Để điều chế một lượng khí hiđro trong một giờ thực hành, bạn An cho 5,6g Sắt vào dung dịch axit Clohiđric (HCl ) thu được Sắt (II) Clorua (FeCl2) và khí hiđro (H2). Em hãy giúp bạn : a. Viết công thức về khối lượng của phản ứng? b. Tính thể tích khí hiđro tạo ra (ở đktc) c. Tính khối lượng HCl đã dùng III. Hướng dẫn chấm Đề 1: Nội dung đánh giá Điểm I. Lý thuyết (7 điểm) Câu 1 HS viết mỗi công thức đúng đạt 0,5đ a)CuCl2 b)Al2(SO4)3 c) KOH d) CaO 0,5.4=2đ Câu 2 HS lập mỗi phương trình đúng đạt 0,5đ a) S + O2 → SO2 b) 3H2 + N2 → 2NH3 c) Na2O + H2O → 2NaOH d) Zn + 2HCl → ZnCl2 + H2 . e) 3Fe + 2O2 → Fe3O4 f) Na2SO4 + BaCl2 → BaSO4 + NaCl 0,5đ.6=3,0đ Câu 3 -Trường hợp a) xảy ra hiện tượng hóa học do có chất mới tạo ra -Trường hợp b) xảy ra hiện tượng vật lí do không có chất mới tạo ra Lưu ý: HS nêu đúng sự biến đổi của chất mỗi ý đạt 0,5đ; giải thích đúng mỗi ý đạt 0,5đ 1đ 1đ II. Bài toán (3điểm) a)Phương trình: Fe + 2HCl→ FeCl2 + H2 Công thức về khối lượng: mFe +mHCl = mFeCl2 + mH2 b) nFe=5,6/56=0,1 mol PT: Fe + 2HCl→ FeCl2 + H2 0,1 0,2 0,1 0,1 (mol) VH2(đkc) =0,1.22,4 = 2,24 lit c) mHCl =0,2. 36,5 = 7,3 g 0,5đ 0,5đ 0,5đ 0,25đ 0,25đ 0,5đ 0,5đ Đề 2: I. Lý thuyết (7 điểm) Câu 1(2đ): Viết công thức hóa học của các chất trong các trường hợp sau: H và O b)Al(III) và (CO3)(II) c) Na và (OH)(I) d) K(I) và O Câu 2(3đ): Lập phương trình hóa học của phản ứng sau: a) Al + Cl2 → AlCl3 b) H2 + P → PH3 c) K2O + H2O → KOH d) Zn + HCl → ZnCl2 + H2 . e) Fe2O3 + H2 → Fe + H2O f) H2SO4 + BaCl2 → BaSO4 + HCl Câu 3 (2đ) Trong các trường hợp sau,trường hợp nào xảy ra hiện tượng vật lí, hoá học?Vì sao? a. Thức ăn để lâu bị ôi, thiu b. Dòng điện chạy qua dây tóc bóng đèn điện làm dây tóc nóng và sáng lên. II. Bài toán (3điểm) Để điều chế một lượng khí hiđro trong một giờ thực hành, bạn Hoa cho 6,5g kẽm vào dung dịch axit sunfuric (H2SO4 ) thu được kẽm sunfat (ZnSO4) và khí hiđro (H2). Em hãy giúp bạn : a. Viết công thức về khối lượng của phản ứng? b. Tính khối lượng H2SO4 đã dùng c. Tính thể tích khí hiđro tạo ra (ở đktc) III. Hướng dẫn chấm : Đề 2 Câu Nội dung đánh giá Điểm I.Lý thuyết (7 điểm) Câu 1 HS viết mỗi công thức đúng đạt 0,5đ a)H2O b)Al2(CO3)3 c) NaOH d) K2O 0,5.4=2đ Câu 2 HS lập mỗi phương trình đúng đạt 0,5đ a) 2Al + 3Cl2 → 2AlCl3 b) 3H2 + 2P → 2PH3 c) K2O + H2O → 2KOH d) Zn + 2HCl → ZnCl2 + H2 . e) Fe2O3 + 3H2 → 2Fe + 3H2O f) H2SO4 + BaCl2 → BaSO4 + 2HCl 0,5đ.6=3,0đ Câu 3 -Trường hợp a) xảy ra hiện tượng hóa học do có chất mới tạo ra -Trường hợp b) xảy ra hiện tượng vật lí do không có chất mới tạo ra Lưu ý: HS nêu đúng sự biến đổi của chất mỗi ý đạt 0,5đ; giải thích đúng mỗi ý đạt 0,5đ 1đ 1đ II. Bài toán (3điểm) a)Phương trình: Zn + H2SO4 → ZnSO4 + H2 Công thức về khối lượng: mZn +mH2SO4 = mZnSO4 + mH2 b) nFe=6,5/65=0,1 mol PT: Zn + H2SO4 → ZnSO4 + H2 0,1 0,1 0,1 0,1 (mol) Þ mH2SO4 =0,1. 98 = 9,8 g c)VH2(đkc) =0,1.22,4 = 2,24 lit 0,5đ 0,5đ 0,5đ 0,25đ 0,25đ 0,5đ 0,5đ
Tài liệu đính kèm:
 WBKTHKI_Hoa_8_1617.doc
WBKTHKI_Hoa_8_1617.doc





