Kiểm tra hóa 9 tiết 20 Thời gian 45 phút
Bạn đang xem tài liệu "Kiểm tra hóa 9 tiết 20 Thời gian 45 phút", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
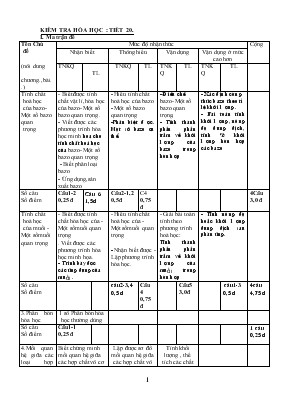
KIỂM TRA HÓA HỌC : TIẾT 20. I. Ma trận đề Tên Chủ đề (nôi dung chương.,bài..) Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng Vận dụng ở mức cao hơn TNKQ TL TNKQ TL TNKQ TL TNKQ TL Tính chất hoá học của bazo- Một số bazo quan trọng - Biết được tính chất vật lí, hóa học của bazo- Một số bazo quan trọng . - Viết được các phương trình hóa học minh ho¹ cho tÝnh chÊt ho¸ häc cña bazo- Một số bazo quan trọng - Biết phân loại bazo - Ứng dụng,sản xuất bazo - Hiểu tính chất hoá học của bazo - Một số bazo quan trọng -Ph©n biÖt ®îc. Mét sè bazo cô thÓ. - §iÒu chÕ bazo- Một số bazo quan trọng. - TÝnh thµnh phÇn phÇn tr¨m vÒ khèi lîng cña bazo trong hçn hîp - X¸c ®Þnh c«ng thøc bazo theo tØ lÖ khèi lîng. - Bµi to¸n tÝnh khèi lîng, nång ®é dung dÞch, tÝnh % khèi lîng hçn hîp c¸c bazo Số câu Số điểm Câu1-2 0,25 đ C©u 6 1,5® Câu2-1,2 0,5đ C4 0,75 đ 4Câu 3,0 đ Tính chất hoá học của muối - Một sốmuối quan trọng - Biết được tính chất hóa học của - Một sốmuối quan trọng . Viết được các phương trình hóa học minh họa. - Tr×nh bµy ®îc c¸c øng dông cña muối . - Hiểu tính chất hoá học của - Một sốmuối quan trọng - Nhận biết được - Lập phương trình hóa học. - Giải bài toán tính theo phương trình hoá học: TÝnh thµnh phÇn phÇn tr¨m vÒ khèi lîng cña muối trong hçn hîp - TÝnh nång ®é hoÆc khèi lîng dung dÞch sau ph¶n øng. Số câu Số điểm c©u2-3,4 0,5 ® Câu4 0,75đ Câu5 3,0đ c©u1-3 0,5 ® 4c©u 4,75 ® 3.Phân bón hóa học 1 số Phân bón hóa học thường dùng Số câu Số điểm Câu1-1 0,25 đ 1 c©u 0,25 ® 4.Mối quan hệ giữa các loại hợp chất vô cơ Biết chứng minh mối quan hệ giữa các hợp chất vô cơ Lập được sơ đồ mối quan hệ giữa các hợp chất vô cơ- viết Ptpu Tính khối lượng , thể tích các chất trong hỗn hợp rắn, lỏng, khí Số câu Số điểm 1 c©u 2,0 ® 1 c©u 2,0 ® Tổng số câu Tổng sốđiểm Tỉ lệ% 2 c©u 0,5 ® 5% 1 c©u 1, 5 ® 15 % 2 c©u 1 ® 10% 2 c©u 3,5 ® 35% 1 câu 3,0 đ 30% 1 c©u 0,5 ® 5% 9câu 10 đ 100% Họ và tên:.............................................. Kiểm tra hóa 9 tiết 20 Lớp :9:....................... Thời gian 45 phút Điểm: Lời phê Đề 1 Phần I: TRẮC NGHIỆM KHÁCH QUAN (2,0 điểm) Câu 1: (1,0 điểm) Khoanh tròn vào một chữ cái trước câu trả lời đúng: 11) Dãy chất nào sau đây đều là phân bón đơn? A. NaNO3, NH4Cl, Ca3PO4, (NH4)2HPO4; B. KNO3, NH4Cl, Ca3PO4, CO(NH2)2; C. (NH4)2HPO4, KNO3, CO(NH2)2; D. KCl, NH4Cl, Ca3PO4, CO(NH2)2. 2) Dãy chất nào sau đây đều tác dụng được với Ba(OH)2? A. ZnCl2, Mg(NO3)2, HCl, CO2; B. HCl, BaCl2, Ca(OH)2, H2SO4; C. HCl, CaO, NaCl, CO2; D. H2SO4, NaCl, CuCl2, Al2SO4. 3) Cần pha thêm bao nhiêu gam dung dịch NaCl có nồng độ 20% vào 400 gam dung dịch NaCl có nồng độ 15% để được dung dịch NaCl có nồng độ 16%? A. 150 gam; B.300 gam; C. 100 gam; D. 20 gam. Câu 2: (1,0 điểm)Hãy ghép các cặp phản ứng ở cột A với các hiện tượng ở cột B để được đáp án đúng nhất. Cột A Cột B 1. Zn (dây) + CuSO4 a. Tạo ra kết tủa có màu xanh. 2. Cu(dây) + FeSO4 b. Kim loại Cu bám ngoài , dung dịch có mầu xanh lam bị nhạt dần. 3. Fe(OH)3 + HCl c. Không có hiện tượng gì 4. CuCl2 + KOH d. Kim loại Fe bám ngoài dây đồng. e. Tạo ra dung dịch có màu vàng nâu. Lựa chọn 1 + ; 2 +; 3 +; 4 +.; Phần II: TỰ LUẬN (8,0 điểm) Câu 3: (2,0 điểm) Viết các PTHH để thực hiện các chuyển đổi trong sơ đồ sau: Cu(OH)2 CuO CuCl2 Cu(NO3)2 NaNO3 Câu 4: (1,5 điểm) Trong phòng thí nghiệm có chỉ có quỳ tím và 5 lọ không nhãn, mỗi lọ đựng một dung dịch sau: K2SO4, HCl, Ba(OH)2, H2SO4, KNO3. Em làm thế nào để nhận biết được các dung dịch trên bằng phương pháp hóa học. Viết PTHH xảy ra (nếu có). Câu 5: (3,0 điểm) Trén 300 ml dung dÞch ZnCl2 1,5M víi 100 ml dung dÞch NaOH 1M sau ph¶n øng ta thu ®îc mét dung dÞch vµ mét chÊt kh«ng tan. a) TÝnh nång ®é mol cña c¸c chÊt trong dung dÞch sau khi ph¶n øng kÕt thóc. Cho r»ng thÓ tÝch dung dÞch thay ®æi kh«ng ®¸ng kÓ. b) Läc kÕt tña nung ë nhiÖt ®é cao ®Õn khèi lîng kh«ng thay ®æi. TÝnh khèi lîng chÊt r¾n thu ®îc sau khi nung. c) Nếu dùng HCl để trung hòa hết lượng NaOH ở trên thì cần bao nhiêu gam dung dịch HCl nồng độ 25%. Câu 6: (1,5 điểm). Nêu ứng dụng của NaOH trong đời sống và trong sản xuất công nghiệp? nêu phương pháp sản xuất NaOH, viết PTPU nếu có? (Cho biÕt : Na = 23 Ca = 40, O = 16, H = 1, S = 32, Zn = 65, Cl = 35,5 ) __________________________________________________________________ Họ và tên:............................................ KIỂM TRA HÓA TIÊT 20 Lớp 9:....... Thời gian:45 phút Điểm: Lời phê: Phần I: TRẮC NGHIỆM KHÁCH QUAN (2,0 điểm) Câu 1: (1,0 điểm) Khoanh tròn vào một chữ cái trước câu trả lời đúng 1) Dãy chất nào sau đây đều là phân bón kép? A. NaNO3, NH4Cl, Ca3PO4, (NH4)2HPO4; B. KNO3, NH4Cl, Ca3PO4, CO(NH2)2; C. (NH4)2HPO4, KNO3, (NH4)3PO4; D. KCl, NH4Cl, Ca3PO4, CO(NH2)2. 2) Dãy chất nào sau đây đều tác dụng được với Ba(OH)2? A. HCl, BaCl2, Ca(OH)2, H2SO4; B. MgCl2, Cu(NO3)2, HCl, CO2; C. HCl, CaO, NaCl, CO2; D. H2SO4, NaCl, CuCl2, Al2SO4. 3) Cần pha thêm bao nhiêu gam dung dịch NaNO3 có nồng độ 18% vào 400 gam dung dịch NaNO3 có nồng độ 13% để được dung dịch NaNO3 có nồng độ 14%? A. 150 gam; B. 100 gam; C. 300 gam; D. 20 gam. Câu 2: Hãy ghép các cặp phản ứng ở cột A với các hiện tượng ở cột B để được đáp án đúng nhất. Cột A Cột B 1. Fe(OH)3 + HCl a. Tạo ra kết tủa có màu xanh. 2. Cu(NO3)2 + KOH b. Kim loại Cu bám ngoài dây nhôm, dung dịch có mầu xanh lam bị nhạt dần. 3. Cu(dây) + ZnSO4 c. Không có hiện tượng gì 4. BaCl2 + K2SO4 d. Tạo ra kết tủa trắng lắng xuống đáy ống nghiệm e. Kim loại Cu bám ngoài dây kẽm. Trả lời: 1 + ; 2 +; 3 +; 4 +.; 5+; Phần II: TỰ LUẬN (8,0 điểm) Câu 3: (2,0 điểm)Viết các PTHH để thực hiện các chuyển đổi trong sơ đồ sau: Zn(OH)2 ZnO ZnCl2 Zn(NO3)2 KNO3 Câu 4: (1,5 điểm) Trong phòng thí nghiệm có chỉ có quỳ tím và 5 lọ không nhãn, mỗi lọ đựng một dung dịch sau: Ba(OH)2, H2SO4, Na2SO4, HCl , NaNO3. Em làm thế nào để nhận biết được các dung dịch trên bằng phương pháp hóa học. Viết PTHH xảy ra (nếu có). Câu 5: (3,0 điểm) Trén 200 ml dung dÞch MgCl2 3M víi 100 ml dung dÞch KOH 3M sau ph¶n øng ta thu ®îc mét dung dÞch vµ mét chÊt kh«ng tan. a) TÝnh nång ®é mol cña c¸c chÊt trong dung dÞch sau khi ph¶n øng kÕt thóc. Cho r»ng thÓ tÝch dung dÞch thay ®æi kh«ng ®¸ng kÓ. b) Läc kÕt tña nung ë nhiÖt ®é cao ®Õn khèi lîng kh«ng thay ®æi. TÝnh khèi lîng chÊt r¾n thu ®îc sau khi nung. c) Nếu dùng H2SO4 để trung hòa hết lượng KOH ở trên thì cần bao nhiêu gam dung dịch H2SO4 nồng độ 30%. Câu 6: (1,5 điểm) Nêu ứng dụng của NaCl trong đời sống và trong sản xuất công nghiệp? nêu phương pháp sản xuất NaCl, viết PTPU nếu có? (Cho biÕt : Na = 23,O = 16, H = 1, N = 14, S = 32, Mg = 24, Cl = 35,K= 39 ) _____________________________________________________________________ ĐÁP ÁN CHẤM BÀI KIỂM - Tiết 20 ĐỀ I- PhầnI: Trắc nghiệm khách quan (2,0 điểm) Câu 1: (1,0 điểm) - Mỗi ý 1, 2, đúng 0,25 điểm; ý 3 đúng 0,5 điểm Ý 1 2 3 Đáp án D B A Câu 2: (1,0 điểm) Mỗi ý đúng 0,25 điểm Ý 1 2 3 4 Đáp án b c f d Phần II: Tự luận (8,0 điểm) Câu Đáp án Điểm Câu 3 2,0 đ 1) Cu(OH)2 CuO + H2O 2) CuO +2 HCl CuCl2 + H2O 3) CuCl2 + 2AgNO3 Cu(NO3)2 + 2AgCl↓ 4) Cu(NO3)2 + 2NaOH 2NaNO3 + Cu(OH)2↓ 0,5đ 0,5đ 0,5đ 0,5đ Câu 4 1,5 đ - Dùng quỳ tím cho vào 5 mẫu thử của 5 dung dịch + Mẫu thử nào chuyển màu đỏ thì dung dịch ban đầu là HCl, H2SO4 + Mẫu thử nào chuyển màu xanh thì dung dịch ban đầu là Ba(OH)2 + Mẫu thử nào không làm quỳ tím chuyển màu thì là 2 muối: K2SO4 và KNO3 - Dùng dd Ba(OH)2 vừa tìm được nhỏ vào mẫu thử của 2 muối + Nếu mẫu thử nào xuất hiện kết tủa thì đó là K2SO4 còn lại là KNO3 K2SO4 + Ba(OH)2 BaSO4 ¯ + 2 KOH - Dùng dd Ba(OH)2 vừa tìm được nhỏ vào mẫu thử của 2 axit + Nếu mẫu thử nào xuất hiện kết tủa thì đó là H2SO4 còn lại là HCl H2SO4 + Ba(OH)2 BaSO4 ¯ + 2 H2O 2HCl + Ba(OH)2 BaCl2 + 2 H2O 0,5đ 0,5đ 0,5đ Câu 5 (3,0đ) - Số mol ZnCl2: nZnCl2 = 0,3 x 1,5 = 0,45 (mol) n NaOH = 0,1 x 1 = 0,1 mol ZnCl2 + 2NaOH 2NaCl + Zn(OH)2¯ (mol)0,05 0,1 0,1 0,05 - Xét tỉ lệ: 0,45/1 > 0,1/2 => ZnCl2 dư a) Nồng độ mol của các chất trong dd sau khi phản ứng kết thúc CM(NaCl) = 0,1/0,4= 0,25 M n ZnCl2 dư = 0,45 – 0,05 = 0,4 (mol) CM(ZnCl2) = 0,4/0,4 = 1M b) Zn(OH)2 ZnO + H2O 0,05 0,05 - Khối lượng ZnO thu được là: mZnO = 0,05 x 81 = 4,05 gam c) HCl + NaOH NaCl + H2O 0,1 0,1 - Khối lượng HCl cần dùng là:mH2SO4 = 0,1 x 36,5 = 3,65 gam - Khối lượng dd HCl nồng độ 25% là:m dd H2SO4 = (3,65 x 100) : 25 = 14,6 (g) 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ Câu 6 1,5đ - ứng dụng: - sản xuất: - viết PT 0,5 0,5 0,5 ĐỀ II PhầnI: Trắc nghiệm khách quan (2,0 điểm) Câu 1: (1,0 điểm) - Mỗi ý 1, 2 đúng 0,25 điểm; ý 3 đúng 0,5 điểm Ý 1 2 3 Đáp án C A B Câu 2: (1,5 điểm) - Mỗi ý đúng 0,25 điểm Ý 1 2 3 4 Đáp án f c b d Phần II: Tự luận (7,0 điểm) Câu Đáp án Điểm Câu 3 2,0 đ 1) Zn(OH)2 ZnO + H2O 2) ZnO +2 HCl ZnCl2 + H2O 3) ZnCl2 + 2AgNO3 Zn(NO3)2 + 2AgCl↓ 4) Zn(NO3)2 + 2NaOH 2NaNO3 + Zn(OH)2↓ 0,5đ 0,5đ 0,5đ 0,5đ Câu 4 1,5 đ - Dùng quỳ tím cho vào 5 mẫu thử của 5 dung dịch + Mẫu thử nào chuyển màu đỏ thì dung dịch ban đầu là HCl, H2SO4 + Mẫu thử nào chuyển màu xanh thì dung dịch ban đầu là Ba(OH)2 + Mẫu thử nào không làm quỳ tím chuyển màu thì là 2 muối: Na2SO4 và NaNO3 - Dùng dd Ba(OH)2 vừa tìm được nhỏ vào mẫu thử của 2 muối + Nếu mẫu thử nào xuất hiện kết tủa thì đó là Na2SO4 còn lại là NaNO3 Na2SO4 + Ba(OH)2 BaSO4 ¯ + 2 NaOH - Dùng dd Ba(OH)2 vừa tìm được nhỏ vào mẫu thử của 2 axit + Nếu mẫu thử nào xuất hiện kết tủa thì đó là H2SO4 còn lại là HCl H2SO4 + Ba(OH)2 BaSO4 ¯ + 2 H2O 2HCl + Ba(OH)2 BaCl2 + 2 H2O 0,5đ 0,5đ 0,5đ Câu 5 (3,0đ) - Số mol ZnCl2: nMgCl2 = 0,2 x 3 = 0,6 (mol) n NaOH = 0,1 x 3 = 0,3 mol MgCl2 + 2NaOH 2NaCl + Mg(OH)2¯ (mol) 0,15 0,3 0,3 0,15 - Xét tỉ lệ: 0,6/1 > 0,3/2 => MgCl2 dư a) Nồng độ mol của các chất trong dd sau khi phản ứng kết thúc CM(NaCl) = 0,3/0,3= 1 M n MgCl2 dư = 0,6 – 0,15 = 0,45 (mol) CM(MgCl2)dư = 0,45/0,3 = 1,5M b) Mg(OH)2 MgO + H2O (mol) 0,15 0,15 - Khối lượng MgO thu được là: mMgO = 0,15 x 40 = 6 gam c) H2SO4 + 2KOH K2SO4 + 2H2O 0,15 0,3 - Khối lượng H2SO4 cần dùng là: mH2SO4 = 0,15 x 98 = 14,7 gam - Khối lượng nồng độ 30% là: m dd H2SO4 = (14,7 x 100) : 30 = 49 (g) 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ 0,25 đ Câu 6 1,5đ - ứng dụng: - sản xuất: - viết PT 0,5 0,5 0,5
Tài liệu đính kèm:
 Kiem_tra_45_phut_hoa_9_tiet_20.docx
Kiem_tra_45_phut_hoa_9_tiet_20.docx





