Kiểm tra 1 tiết – Lần 2 (Năm học 2014 - 2015) môn : Hóa học 11 (chương trình nâng cao)
Bạn đang xem tài liệu "Kiểm tra 1 tiết – Lần 2 (Năm học 2014 - 2015) môn : Hóa học 11 (chương trình nâng cao)", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
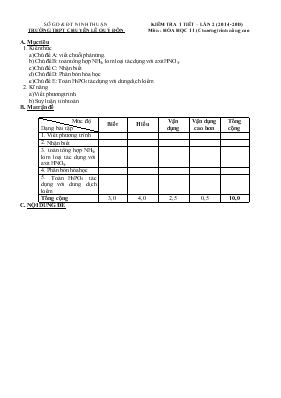
SỞ GD & ĐT NINH THUẬN TRƯỜNG THPT CHUYÊN LÊ QUÝ ĐÔN KIỂM TRA 1 TIẾT – LẦN 2 (2014-2015) Môn : HÓA HỌC 11 (Chương trình nâng cao) A. Mục tiêu 1. Kiến thức a) Chủ đề A: viết chuỗi phản ứng. b) Chủ đề B: toán tổng hợp NH3, kim loại tác dụng với axit HNO3. c) Chủ đề C: Nhận biết d) Chủ đề D: Phân bón hóa học e) Chủ đề E: Toán H3PO4 tác dụng với dung dịch kiềm 2. Kĩ năng a) Viết phương trình. b) Suy luận, tính toán. B. Ma trận đề Mức độ Dạng bài tập Biết Hiểu Vận dụng Vận dụng cao hơn Tổng cộng 1. Viết phương trình 2. Nhận biết 3. toán tổng hợp NH3, kim loại tác dụng với axit HNO3. 4. Phân bón hóa học 5. Toán H3PO4 tác dụng với dung dịch kiềm Tổng cộng 3,0 4,0 2,5 0,5 10,0 C. NỘI DUNG ĐỀ SỞ GD & ĐT NINH THUẬN TRƯỜNG THPT CHUYÊN LÊ QUÝ ĐÔN ĐỀ KIỂM TRA 1 TIẾT – LẦN 2 Năm học: 2014-2015 Môn : HÓA HỌC 11 (Chương trình Nâng cao) PHẦN CHUNG (7 điểm) Câu 1: (2 điểm) Hoàn thành chuỗi phản ứng sau, viết rõ điều kiện (nếu có): Phân urê → amoni cacbonat → amoniac → nitơ monooxit → nitơ đioxit Câu 2: (1 điểm) Bằng phương pháp hóa học, hãy trình bày cách nhận biết các dung dịch sau: HNO3loãng, H3PO4, H2SO4 đặc. Viết phương trình hóa học xảy ra trong lúc nhận biết. Câu 3: (4 điểm) Nén 5 mol N2 và 17 mol H2 vào bình kín với điều kiện phản ứng phù hợp để phản ứng tổng hợp NH3 xảy ra. Số mol của hỗn hợp khí thu được sau phản ứng là 18 mol. a) Tính hiệu suất của phản ứng tổng hợp NH3. b) Viết sơ đồ điều chế HNO3 từ NH3 c) Nếu lấy 50% lượng NH3 tạo thành ở trên thì có thể điều chế được bao nhiêu lít HNO3 67% (D = 1,4g/ml), biết hiệu suất quá trình điều chế HNO3 là 80%. d) Cho 25,6 gam một kim loại M có hóa trị n tan hết trong lượng HNO3 điều chế được ở câu c thu được 17,92 lít khí NO2 duy nhất (đkc). Xác định tên kim loại M. B. PHẦN RIÊNG (3 điểm) Dành cho lớp 11 A1,11A2 Câu 4: (1 điểm) Tại sao không được trộn supephotphat với vôi? Giải thích và viết phương trình hóa học của phản ứng. Câu 5: (2 điểm) Đốt cháy hoàn toàn 12,4 gam P với một lượng oxi dư. Sau đó cho toàn bộ lượng P2O5 hòa tan vào 80ml dung dịch NaOH 25% (D=1,28g/ml). Tính nồng độ phần trăm của dung dịch muối sau phản ứng. Dành cho lớp 11H Câu 6: (2 điểm) a) Phân tích cấu trúc của xiclopropan để chứng minh đây là hợp chất vòng rất kém bền. Viết 2 phương trình hóa học minh họa. b) Vẽ cấu trúc bền của vòng xiclopentan. c) Hoàn thành các phương trình phản ứng sau đây: CnH2n + KMnO4 + H2O → CnH2n(OH)2 + + C2H2 + KMnO4 → KOOC – COOK + MnO2 + KOH + H2O Câu 7: (1 điểm) Nhiệt phân C4H10 được hỗn hợp Y gồm có CH4, C3H6, C2H6, C2H4, H2, C4H8 và C4H10 dư. Biết MY = 36,25 gam/mol. Tính hiệu suất của phản ứng cracking. ( Cho Cu = 64;N = 14;Na = 23; Ba = 137; Al = 27; O = 16; P = 31) ------------HẾT------------ D. ĐÁP ÁN LỜI GIẢI TÓM TẮT Biểu điểm Câu 1: (2 điểm) Hoàn thành chuỗi phản ứng sau, viết rõ điều kiện (nếu có): Phân urê → amoni cacbonat → amoniac → nitơ monooxit → nitơ đioxit Viết đúng 4 phương trình phản ứng 0,5 x 4 Câu 2: (1 điểm) Bằng phương pháp hóa học, hãy trình bày cách nhận biết các dung dịch sau: HNO3loãng, H3PO4, H2SO4 đặc Dùng Cu - HNO3: dd có màu xanh, khí không màu hóa nâu ngoài không khí 3Cu +8HNO3→3Cu(NO3)2 + 2NO+4H2O - H2SO4: dd màu xanh, khí mùi xốc Cu + 2H2SO4đ,n→Cu(SO4)2 + SO2 + 2H2O Còn lại là H3PO4 0,5 0,5 Câu 3: (4 điểm) Nén 5 mol N2 và 17 mol H2 vào bình kín với điều kiện phản ứng phù hợp để phản ứng tổng hợp NH3 xảy ra. Số mol của hỗn hợp khí thu được sau phản ứng là 18 mol. a. Tính hiệu suất của phản ứng tổng hợp NH3. b. Viết sơ đồ điều chế HNO3 từ NH3 c. Nếu lấy 50% lượng NH3 tạo thành ở trên thì có thể điều chế được bao nhiêu lít HNO3 67% (D=1,4g/ml), biết hiệu suất quá trình điều chế HNO3 là 80%. d. Cho 25,6 gam một kim loại M có hóa trị n tan hết trong lượng HNO3 điều chế được ở câu c thu được 17,92 lít khí NO2 duy nhất (đkc). Xác định tên kim loại M. a. N2 + 3H2 2NH3 Bđ(mol) 5 17 0 Pư x 3x 2x [] 5-x 17-3x 2x Số mol sau phản ứng: 22-2x=18→x=2mol H=x.100%/5=40% 0,5 0,5 b. NH3→NO→NO2→HNO3 1 c. 50% lượng NH3 = 2mol→mHNO3 thực tế thu được =2.0,8.63 =100,8g khối lượng dd HNO3 =100,8.100/67=150,45g Thể tích dd HNO3 = 150,45/1,4=107,46ml=0,10746l 0,5 0,5 d. M + 2nHNO3 →M(NO3)n + nNO2 + nH2O số mol NO2 =0,8mol→số mol M = 0,8/n→M = 32n→ M là Cu 0,5 0,5 PHẦN RIÊNG Dành cho lớp 11A1,11A2 Câu 5: (1 điểm) Tại sao không được trộn supephotphat với vôi? Giải thích và viết phương trình hóa học của phản ứng. Khi trộn chung với vôi thì Ca(H2PO4)2: muối tan cây trồng hấp thụ được chuyển thành muối không tan là CaHPO4, Ca3(PO4)2: cây trồng không hấp thụ được 0,5 Ca(H 2PO4)2 + Ca(OH)2→2CaHPO4 + 2H2O Ca(H 2PO4)2 + 2Ca(OH)2→Ca3(PO4)2 + 4H2O 0,5 Câu 6: (2 điểm) Đốt cháy hoàn toàn 12,4 gam P với một lượng oxi dư. Sau đó cho toàn bộ lượng P2O5 hòa tan vào 80ml dung dịch NaOH 25% (D=1,28g/ml). Tính nồng độ phần trăm của dung dịch muối sau phản ứng. P→ P2O5 → H3PO4 Mol 0,4 →0,4 0,5 Số mol NaOH =0,64mol T = số mol NaOH/số mol H3PO4 =0,64/0,4=1,6→tạo ra 2 muối là NaH2PO4, Na2HPO4 0,5 H3PO4 + NaOH→NaH2PO4 + H2O H3PO4 + 2NaOH→Na 2HPO4 + H2O Gọị a, b lần lượt là số mol của NaH2PO4, NaHPO4. Ta có hệ phương trình 0,5 Khối lượng NaH2PO4 =19,2g, khối lượng Na2HPO4 = 34,08g →C%( NaH2PO4)= 19,2.100/130,8=14,68%; C%( Na2HPO4)=26,06% 0,5 Dành cho lớp 11H Câu 7: (2 điểm) a) Phân tích cấu trúc của xiclopropan để chứng minh đây là hợp chất vòng rất kém bền. Viết 2 phương trình hóa học minh họa. b) Vẽ cấu trúc bền của vòng xiclopentan. c) Hoàn thành các phương trình phản ứng sau đây: CnH2n + KMnO4 + H2O → CnH2n(OH)2 + + C2H2 + KMnO4 → KOOC – COOK + MnO2 + KOH + H2O - Xiclopropan là một vòng phẳng, có góc hóa trị CCC= 60o, tức là bị ép nhỏ rất nhiều so với góc hóa trị bình thường của Csp3 (109o28’). Ngoài ra các nguyên tử H ở hai Cacbon kề nhau luôn luôn che khuất nhau từng cặp một Do đó vòng xiclopropan là vòng kém bền nhất. 0,5 - Vòng Xiclopropan kém bền nên dễ tham gia phản ứng cộng mở vòng: 0,5 Cấu trúc dạng phong bì mở. 0,5 c. Hoàn thành đúng 2pt. 0,5 Câu 8. (1 điểm) Nhiệt phân C4H10 được hỗn hợp Y gồm có CH4, C3H6, C2H6, C2H4, H2, C4H8 và C4H10 dư. Biết MY = 36,25 gam/mol. Tính hiệu suất của phản ứng cracking. H = (MC4H10MY - 1).100% = (58/36,25 – 1).100% = 60% 1
Tài liệu đính kèm:
 Hoa_NC_(LE QUY DON)_2_11.doc
Hoa_NC_(LE QUY DON)_2_11.doc





