Hóa học 11 - Chương 1: Nguyên tử
Bạn đang xem 20 trang mẫu của tài liệu "Hóa học 11 - Chương 1: Nguyên tử", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
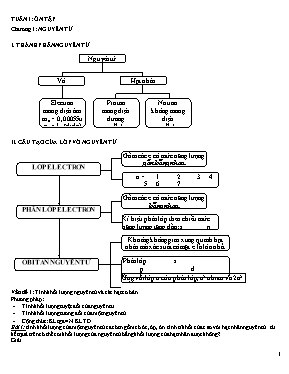
TUẦN 1: ÔN TẬP Chương 1: NGUYÊN TỬ I. THÀNH PHẦN NGUYÊN TỬ Hạt nhân Vỏ Nguyên tử Proton mang điện dương mp » 1u qe = 1+ (đtđv) Nơtron không mang điện mn » 1u qn = 0 Electron mang điện âm me = 0,00055u qe = 1- (đtđv) II. CẤU TẠO CỦA LỚP VỎ NGUYÊN TỬ Phân lớp s p d f Số AO 1 3 5 7 Số e tối đa 2 6 10 14 OBITAN NGUYÊN TỬ Khoảng không gian xung quanh hạt nhân mà xác suất có mặt e là lớn nhất (khoảng 90%) Gồm các e có mức năng lượng bằng nhau Kí hiệu phân lớp theo chiều mức năng lượng tăng dần: s p d f PHÂN LỚP ELECTRON LỚP ELECTRON n = 1 2 3 4 5 6 7 Tên lớp K L M N O P Q Gồm các e có mức năng lượng gần bằng nhau Ứng với lớp n có n phân lớp, n2 obitan và 2n2 e tối đa Vấn đề 1: Tính khối lượng nguyên tử và các hạt cơ bản. Phương pháp: Tính khối lượng tuyệt đối của nguyên tư. Tính khối lượng tương đối của một nguyên tử. Cộng thức: KLtgđ = N.KLTĐ Bài 1: tính khối lượng của một nguyên tử cacbon gồm có 6e, 6p, 6n. tính tỉ khối của e so với hạt nhân nguyên tử . từ kết quả trên có thể coi khối lượng của nguyên tử bằng khối lượng của hạt nhân được không? Giải Khối lượng của một nguyên tử cacbon là: mP = 6.1,67.10-24 =10,02.10-24g mn = 6.1,675.10-24 = 10,05.10-24g me = 6..9,1.10-28 = 54,6.10-28g ¾® khối lượng nguyên tử cacbon = 20,06.10-24g ¾® tỉ số khối lương là: 54,6.10-28/20,06.10-24 =3/10000 ¾® từ kết quả trên có thể coi khối lượng nguyên tử bằng khối lượng hạt nhân nguyên tử. Vấn đề 2: Tìm số khối, phần trăm đồng vị, nguyên tử khối trung bình. Phương pháp: hầu hết các nguyên tố hoá học là hỗn hợp của nhiều đồng vị nên nguyên tử khối của nguyên tố là nguyên tử khối trung bình của các đồng vị. Ap dụng công thức: Bài 2: tính nguyên tử khối trung bình của Ni biết Ni có 4 đồng vị: 58Ni(67,76%), 61Ni(2,42%), 62Ni(3,66%), 60Ni(26,16%) Giải Nguyên tử khối trung bình của Ni là = 58. 67,76 + 60. 26,16 +61. 2,42 + 62. 3,66/100 = 58,74 Vấn đề 3: Xác định tên nguyên tố thông qua các hạt tạo thành. Phương pháp: Tổng số hạt = N + Z + E Trong đó Z = E => tổng số hạt = 2Z + N Sử dụng bất đẳng thức đối với số proton: Từ đó ta lập bất đẳng thức kép để tìm giới hạn của Z. Bài 3: Nguyênt ử R có tổng số hạt là 13. xác định thành phần, viết cấu hình e của R. Giải Gọi số hạt proton, electron, nơtron là lược là Z, E, N Vậy Z + E + N = 13 Vì nguyên tử trung hoà về điện nên: Z = E 2Z + N = 13 => N = 13 – 2Z Mặt khác ta co: Vậy Vì Z là số nguyên dương nên: Z = 4, E = 4, N = 5. Cấu hình electron của R:1s22s2 Vấn đề 4: viết cấu hình e từ đó suy ra tính chất và vị trí nguyên tử các nguyên tố trong HTTH. Học sinh về nhà tự ôn. ôn tập Chương 2 và 3 Câu 1: Các liên kết trong phân tử nitơ gồm A. 1 liên kết p, 2 liên kết δ B. 1 liên kết δ, 2 liên kết p C. 3 liên kết p D. 3 liên kết δ Câu 2: Liên kết ion: A. Không có tính định hướng, không bão hòa B. Không có tính định hướng, có tính bão hòa C. Có tính định hướng, có tính bão hòa D. Có tính định hướng, không bão hòa Câu 3: Một nguyên tố R thuộc nhóm VA. Trong oxit cao nhất khối lượng oxi chiếm 74,07%. Nguyên tố R là: A. N B. S C. As D. P Câu 4: Khi cho 2,74 gam một kim loại nhóm IIA tác dụng với H2O thì có 0,448 lít khí H2 (đktc). Kim loại đó là: A. Mg B. Ca C. Na D. Ba Câu 5: Cấu hình e của ion X2+ là 1s22s22p63s23p63d7 .Trong bảng tuần hoàn các nguyên tố hóa học, Nguyên tố X thuộc: A. Chu kì 4, nhóm IIA B. Chu kì 4, nhóm VIIIA C. Chu kì 3, nhóm VIB D. Chu kì 4, nhóm VIIIB Câu 6: Nguyên tố X có cấu hình e ở phân lớp ngoài cùng là 3s23p1. Vị trí của X trong bảng tuần hoàn là A. Chu kì 3, nhóm IIIB B. Chu kì 3, nhóm IIA C. Chu kì 3, nhóm IIIA D. Chu kì 3, nhóm IA Câu 7: Cấu hình e ở phân lớp ngoài cùng của các nguyên tố là ns1 thì liên kết của các nguyên tố này với nguyên tố clo thuộc loại liên kết nào sau đây: A. Liên kết cộng hóa trị B. Liên kết cho - nhận C. Không xác định được D. Liên kết ion Câu 8: Một chất rắn không dẫn điện ở trạng thái rắn khan nhưng dẫn điện ở trạng thái nóng chảy. Vậy kiểu cấu tạo mạng tinh thể của chất rắn đó là: A. Mạng tinh thể ion B. mạng tinh thể lim loại C. Mang tinh thể cộng hóa trị D. Mạng tinh thể phân tử Câu 9: Dãy gồm các chất trong phân tử chỉ có liên kết cộng hóa trị phân cực là: A. HF, Cl2, H2O B. O2, H2O, NH3 C. HCl, O3, H2S D. H2O, HF, H2S Câu 10: Hai nguyên tố X và Y đều thuộc nhóm A, ở 2 chu kì liên tiếp có tổng số proton là 32. X và Y là: (Số hiệu nguyên tử của C= 6; N = 7; Na = 11; Mg = 12; Si = 14; P = 15; Ca = 20; K = 19 ) A. N và P B. Mg và Ca C. C và Si D. Na và K Câu 11: Nguyên tố X thuộc nhóm IIA và chu kì 4, Cấu hình e của X là: A. 1s22s22p63s23p63d24s0 B. 1s22s22p63s23p64s2 C. 1s22s22p63s23p63d14s1 D. 1s22s22p63s23p63d2 Câu 12: Bốn nguyên tố K, L, M, N có số hiệu nguyên tử là 9, 17, 35, 53. Các nguyên tố trên được sắp xếp theo chiều độ âm điện giảm dần là: A. K, L, M, N B. N, M, K, L C. N, M, L, K D. M, N, L, K Câu 13: Nguyên nhân gây ra sự biến đổi tuần hoàn tính chất các nguyên tố trong bảng tuần hoàn là: A. Khối lượng nguyên tử B. Số e lớp ngoài cùng C. Điện tích hạt nhân D. Số nơtron Câu 14: Trong ion NH có: A. 10e và 11p B. 11e và 11p C. 11e và 11p D. 11e và 12p Câu 15: Nguyên tố ở chu kì 4, nhóm VIIA có cấu hình e hóa trị là: A. 4s24p1 B. 4s24p5 C. 3d44s2 D. 4s23d4 Câu 16: một nguyên tố X có cấu hình e là 1s22s22p63s23p3. Công thức oxit cao nhất và công thức hợp chất với hiđro của X là: A. XO2 và XH4 B. X2O3 và XH3 C. X2O5 và XH3 D. XO và XH2 Câu 17: Hợp chất tạo thành giữa 2 nguyên tử ở trạng thái cơ bản có cấu hình e lớp ngoài cùng là 3s2 và 2s22p5 thì liên kết giữa chúng là: A. Liên kết kim loại. B. Liên kết cộng hóa trị không cực C. Liên kết cộng hóa trị có cực. D. Liên kết ion. Câu 18: Các nguyên tố X và Y phản ứng để tạo thành hợp chất Z theo phương trình hóa học: 4X + 3Y ¾® 2Z . Giả thiết X và Y vừa đủ, như vậy: A. 1 mol Z tạo thành từ 1/2 mol X B. 1 mol Y phản ứng với 3/4 mol X C. 1 mol Y tạo thành 2/3 mol Z D. 1 mol Z tạo thành từ 3 mol Y Câu 19: Theo qui luật biến đổi tính chất các nguyên tố trong bảng tuần hoàn thì: A. Kim loại mạnh nhất là liti B. Kim loại yếu nhất là xesi C. Phi kim mạnh nhất là Flo D. Phi kim mạnh nhất là Iot Câu 20: Số oxihóa của nguyên tử N trong N2, NO, NO, NH3 lần lượt là: A. 0, +3, -3, -5 B. 0, +4, +6, +3 C. 0, -3, +3, +5 D. 0, +3, +5, -3 Câu 21: Hai nguyên tố X và Y đều ở nhóm A; X có 1 electron lớp ngoài cùng, Y có 7 electron lớp ngoài cùng. X và Y có thể tạo thành hợp chất XY. Liên kết giữ các nguyên tử trong phân tử XY thuộc liên kết: A. Cho - nhận B. ion C. Cộng hóa trị không cực D. Cộng hóa trị có cực Câu 22: Cho 1,67 gam hỗn hợp 2 kim loại ở 2 chu kì liên tiếp thuộc nhóm IIA trong bảng tuần hoàn tác dụng với dung dịch HCl dư thoát ra 0,672 dm3 khí H2 (đktc). Hai kim loại đó là: A. Mg và Ca B. Sr và Ba C. Ca và Sr D. Be và Mg Câu 23: Trong các trường hợp sau đây: LiCl, NaF, CCl4 và KBr. Hợp chất có liên kết cộng hóa trị là: A. CCl4 B. LiCl C. KBr D. NaF Câu 24: Phân tử H2O có góc liên kết 104,50 do nguyên tử oxi ở trạng thái lai hóa: A. sp3 B. Không xác định được C. sp D. sp2 Câu 25: Dãy chất được sắp xếp theo chiều tăng dần sự phân cực liên kết trong phân tử Là: A. Cl2, HCl, NaCl B. Cl2, NaCl, HCl C. HCl, Cl2, NaCl D. NaCl, Cl2, HCl Học Câu 26: Nguyên tố ở chu kì 4, nhóm VIIA có cấu hình e hóa trị là: A. 4s24p5 B. 3d44s2 C. 4s23d4 D. 4s24p1 Câu 27: Liên kết ion: A. Có tính định hướng, không bão hòa B. Không có tính định hướng, không bão hòa C. Không có tính định hướng, có tính bão hòa D. Có tính định hướng, có tính bão hòa Câu 28: Cấu hình e ở phân lớp ngoài cùng của các nguyên tố là ns1 thì liên kết của các nguyên tố này với nguyên tố clo thuộc loại liên kết nào sau đây: A. Liên kết cộng hóa trị B. Không xác định được C. Liên kết ion D. Liên kết cho - nhận Câu 29: Theo qui luật biến đổi tính chất các nguyên tố trong bảng tuần hoàn thì: A. Kim loại yếu nhất là xesi B. Kim loại mạnh nhất là liti C. Phi kim mạnh nhất là Iot D. Phi kim mạnh nhất là Flo Câu 30: Cho 1,67 gam hỗn hợp 2 kim loại ở 2 chu kì liên tiếp thuộc nhóm IIA trong bảng tuần hoàn tác dụng với dung dịch HCl dư thoát ra 0,672 dm3 khí H2 (đktc). Hai kim loại đó là: A. Sr và Ba B. Ca và Sr C. Be và Mg D. Mg và Ca Câu 31: Các liên kết trong phân tử nitơ gồm A. 1 liên kết δ, 2 liên kết p B. 3 liên kết p C. 1 liên kết p, 2 liên kết δ D. 3 liên kết δ Câu 32: Nguyên tố X có cấu hình e ở phân lớp ngoài cùng là 3s23p1. Vị trí của X trong bảng tuần hoàn là A. Chu kì 3, nhóm IA B. Chu kì 3, nhóm IIIA C. Chu kì 3, nhóm IIA D. Chu kì 3, nhóm IIIB Câu 33: Một chất rắn không dẫn điện ở trạng thái rắn khan nhưng dẫn điện ở trạng thái nóng chảy. Vậy kiểu cấu tạo mạng tinh thể của chất rắn đó là: A. Mạng tinh thể phân tử B. Mang tinh thể cộng hóa trị C. mạng tinh thể lim loại D. Mạng tinh thể ion Câu 34: Hai nguyên tố X và Y đều ở nhóm A; X có 1 electron lớp ngoài cùng, Y có 7 electron lớp ngoài cùng. X và Y có thể tạo thành hợp chất XY. Liên kết giữ các nguyên tử trong phân tử XY thuộc liên kết: A. Cộng hóa trị có cực B. ion C. Cho - nhận D. Cộng hóa trị không cực TUẦN 2: SỰ ĐIỆN LI Câu 1. Viết PT điện li của các chất sau: a. HNO3, Ba(OH)2, NaOH, H2SO4, Ca(OH)2, Na2CO3, BaCl2, NaHCO3, H2S. b. CuSO4, Na2SO4 , Fe2(SO4)3, NaHPO4, Mg(OH)2, CH3COOH, H3PO4, HF. Câu 2: Viết phương trình điện li của các chất sau: 1. HBrO 2. Al2(SO4)3 3. Ba(OH)2 4. Na3PO4 5. Be(OH)2 6. (NH4)3PO4 7. K2Cr2O7 8. H2SO4 9. H3PO4 10. HNO2 Câu 3: Tính nồng độ mol của từng ion trong các dung dịch sau 1. Ba(NO3)2 0,2M 2. HNO3 0,015M 3. KOH 0,01M 4. NaClO4 0,02M 5. KMnO4 0,025M 6. Fe2(SO4)3 0,015M Câu 4. Dung dịch CH3COOH trong nước có nồng độ 0,1M , a = 1% có pH là: Câu 5. Cho dung dịch X chứa hỗn hợp gồm CH3COOH 0,1M và CH3COONa 0,1M. Biết ở 25 oC, Ka của CH3COOH là 1,75.10-5 và bỏ qua sự phân li của nước. Giá trị pH của dung dịch X ở 25 oC là A. 4,76. B. 1,00. C. 2,88. D. 4,24. Câu 6. Tính nồng độ các ion trong các dung dịch sau a. dd NaOH 0,1M b. dd BaCl2 0,2 M c. dd Ba(OH)2 0,1M Câu 7. Hòa tan 20 gam NaOH vào 500 ml nước thu được dung dịch A. a. Tính nồng độ các ion trong dung dịch A. b. Tính thể tích dung dịch HCl 2M để trung hòa dung dịch A. Câu 8. Trộn 100 ml dung dịch NaOH 2M với 200 ml dung dịch KOH 0,5M thu được dung dịch C. a. Tính nồng độ các ion trong dung dịch C. b. Trung hòa dung dịch C bằng 300 ml dung dịch H2SO4 CM. Tính CM. Câu 9. Trộn 100 ml dung dịch HCl 1M với 100 ml dung dịch H2SO4 0,5M thu được dung dịch D. a. Tính nồng độ các ion trong dung dịch D. b. Cho dung dịch D tác dụng với dung dịch BaCl2 dư thu được m gam kết tủa. Tính m. Câu 10. Trộn 100 ml dung dịch FeCl3 0.1M với 500 ml dung dịch NaOH 0.1 M thu được dung dịch D và m gam kết tủa. a. Tính nồng độ các ion trong D. b. Tính m Câu 11. Trộn lẫn 100ml dd K2CO3 0,5M với 100ml dd CaCl2 0,1M. a. Tính khối lượng kết tủa thu được. b. Tính CM các ion trong dd sau phản ứng Câu 12. Cho 100 ml dung dịch hỗn hợp A gồm H2SO4 0,015M; HCl 0,03M; HNO3 0,04M. Tính thể tích dung dịch NaOH 0,2M để trung hòa hết 200ml dung dịch A. Câu 13. Cho 100 ml dung dịch hỗn hợp X gồm Ba(OH)2 0.015M; NaOH 0.03 M; KOH 0.04M. Tính thể tích dung dịch HCl 0.2M để trung hòa dung dịch X. Câu 14. Chia 19,8 gam Zn(OH)2 thành hai phần bằng nhau: Cho 150 ml dung dịch H2SO4 1M vào phần một. Tính khối lượng muối tạo thành. Cho 150 ml dung dịch NaOH 1M vào phần hai. Tính khối lượng muối tạo thành. Câu 15. Cho 200 ml dung dịch gồm MgCl2 0,3M; AlCl3 0,45M; và HCl 0,55M tác dụng hoàn toàn với V lít dung dịch C gồm NaOH 0,02M và Ba(OH)2 0,01M. Hãy tính thể tích V để được kết tủa lớn nhất và lượng kết tủa nhỏ nhất? Tính lượng kết tủa đó? Câu 16. Để trung hòa 500 ml dung dịch X chứa hỗn hợp HCl 0,1M và H2SO4 0,3M cần bao nhiêu ml dung dịch hỗn hợp gồm NaOH 0,3M và Ba(OH)2 0,2M? TUẦN 3: LUYỆN TẬP pH - Tích số ion của nước là (ở 250C). Một cách gần đúng, có thể coi giá trị của tích số này là hằng số cả trong dung dịch loãng của các chất khác nhau. - Các giá trị [H+] và pH đặc trưng cho các môi trường Môi trường trung tính: [H+] = 1,0.10-7M hoặc pH = 7 Môi trường axit: [H+] > 1,0.10-7M hoặc pH < 7 Môi trường kiềm: [H+] 7 *Chú ý một số công thức Nếu [H+]= 10-a mol/l → pH= a hay pH =-lg[H+] và pOH=- lg[OH-], Ta có [H+].[OH-]=10-14 → pH +pOH =14 Câu 1. Tính pH của các dung dịch sau a. NaOH 0,001M b. HCl 0,001M c. Ca(OH)2 0,0005M d. H2SO4 0,0005M Câu 2.Trộn 100 ml dung dịch NaOH 0.1M với 100 ml dung dịch KOH 0.1M thu được dung dịch D. a. Tính nồng độ các ion trong dung dịch D. b. Tính pH của dung dịch D. c. Trung hòa dung dịch D bằng dung dịch H2SO4 1M. Tính thể tích dung dịch H2SO4 1M cần dùng. Câu 3. Trộn 200 ml dung dịch NaOH 0,1M với 300 ml dung dịch HCl 0,2M thu được dung dịch A. a. Tính nồng độ các ion trong dung dịch A. b. Tính pH của dung dịch A. Câu 4. Hỗn hợp dung dịch X gồm NaOH 0.1M và KOH 0.1M. Trộn 100 ml dung dịch X với 100 ml dung dịch H2SO4 0.2M thu được dung dịch A. a. Tính nồng độ các ion trong dung dịch A. b. Tính pH của dung dịch A. Câu 5. Trộn 50,0ml dd NaOH 0,40M với 50,0 ml dd HCl 0,20M được dd A. Tính pH của dd A Câu 6. Trộn lẫn 100ml dd HCl 0,03M với 100 ml dd NaOH 0,01M được dd A. a. Tính pH của dd A. b. Tính thể tích dd Ba(OH)2 1M đủ để trung hòa dd A .Câu 7. Trộn 50ml dung dịch HCl với 50ml dung dịch NaOH có pH = 13 thu được dung dịch X có pH = 2. Số mol của dung dịch HCl ban đầu là bao nhiêu? Câu 8. Cho dung dịch A gồm 2 chất HCl và H2SO4. Trung hoà 1000 ml dung dịch A thì cần 400ml dung dịch NaOH 0,5M. Cô cạn dung dịch tạo thành thì thu được 12,95 gam muối. a. Tính nồng độ mol/l của các ion trong dung dịch A. b. Tính pH của dung dịch A. Câu 9. Trộn 250 ml dung dịch hỗn hợp gồm HCl 0,08 mol/l và H2SO4 0,01 mol/l với 250 ml dung dịch NaOH a mol/l, thu được 500 ml dung dịch có pH = 12. Tính a. D. PHẦN BÀI TẬP NÂNG CAO Câu 1. Trộn 250 ml dd hỗn hợp HCl 0,08 mol/l và H2SO4 0,01 mol/l với 250 ml dd Ba(OH)2 có nồng độ x mol/l thu được m gam kết tủa và 500 ml dd có pH = 12. Hãy tím m và x. Giả sử Ba(OH)2 điện li hoàn toàn cả hai nấc. Câu 2. Trộn 300 ml dd hỗn hợp NaOH 0,1 mol/l và Ba(OH)2 0,025 mol/l với 200 ml dd H2SO4 có nồng độ x mol/l thu được m gam kết tủa và 500 ml dd có pH=2. Hãy tím m và x. Giả sử H2SO4 điện li hoàn toàn cả hai nấc. Câu 3. Dung dịch X chứa hỗn hợp KOH và Ba(OH) 2 có nồng độ tương ứng là 0,2M và 0,1M. Dung dịch Y chứa hỗn hợp H2SO4 và HCl có nồng độ lần lượt là 0,25M và 0,75M. Tính thể tích dung dịch X cần để trung hòa vừa đủ 40 ml dung dịch Y. Câu 4 (CĐA-2009). Cho dung dịch chứa 0,1 mol (NH4)2CO3 tác dụng với dung dịch chứa 34,2 gam Ba(OH)2. Sau phản ứng thu được m gam kết tủa và V lít khí (đktc). Xác định giá trị của V và m. Câu 6 (A-2010). Nhỏ từ từ từng giọt đến hết 30 ml dung dịch HCl 1M vào 100 ml dung dịch chứa Na2CO3 0,2M và NaHCO3 0,2M, sau phản ứng thu được V lít khí CO2 (đktc). Tính V. Câu 5 (A-07). Trộn 100 ml dung dịch (gồm Ba(OH)2 0,1M và NaOH 0,1M) với 400 ml dung dịch (gồm H2SO4 0,0375M và HCl 0,0125M), thu được dung dịch X. Tính pH của dung dịch X. Câu 6 (B-08). Trộn 100 ml dung dịch có pH = 1 gồm HCl và HNO3 với 100 ml dung dịch NaOH nồng độ a (mol/l) thu được 200 ml dung dịch có pH = 12. Xác định giá trị của a (biết trong mọi dung dịch [H+][OH-] = 10-14). TUẦN 4: PHẢN ỨNG TRAO ĐỔI ION TRONG DUNG DỊCH CÁC CHẤT ĐIỆN LI 1. Điều kiện xãy ra phản ứng - Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xãy ra khi các ion kết hợp lại với nhau tạo thành ít nhất một trong các chất sau: + Chất kết tủa: BaCl2 + H2SO4 → BaSO4↓ + 2HCl Ba2+ + → BaSO4↓ + Chất bay hơi: Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O + 2H+ → CO2↑ + H2O + Chất điện li yếu: CH3COONa + HCl → CH3COOH + NaCl CH3COO - + H+ → CH3COOH 2. Bản chất phản ứng - Phản ứng trao đổi ion trong dung dịch các chất điện li là phản ứng giữa các ion Câu 1. Viết phương trình phân tử và ion rút gọn (nếu có) khi trộn lẫn các chất a. dd HNO3 và CaCO3. b. dd KOH và dd FeCl3. c. dd H2SO4 và dd NaOH. d. dd Ca(NO3)2 và dd Na2CO3. e. dd NaOH và Al(OH)3. f. dd NaOH và Zn(OH)2. g. FeS và dd HCl. h. dd CuSO4 và dd H2S. i. dd NaHCO3 và HCl j. Ca(HCO3)2 và HCl. Câu 2. Nhận biết các dung dịch của các chất sau bằng phương pháp hóa học. a. NH4NO3, (NH4)2CO3, Na2SO4, NaCl. b. NaOH, NaCl, Na2SO4, NaNO3. c. NaOH, H2SO4, BaCl2, Na2SO4, NaNO3 (chỉ dùng thêm quỳ tím). Câu 3. Viết phương trình phân tử ứng với phương trình ion thu gọn của các phản ứng a. Ba2+ + CO32– → BaCO3↓. b. NH4+ + OH– → NH3 + H2O. c. S2– + 2H+ → H2S↑. d. Fe3+ + 3OH– → Fe(OH)3↓. e. Ag+ + Cl– → AgCl↓. f. H+ + HCO3– → CO2 + H2O. Câu 4. Hoàn thành phương trình dạng phân tử và viết phương trình ion rút gọn theo sơ đồ sau: a. Pb(NO3)2 + ? → PbCl2↓ + ? b. FeCl3 + ? → Fe(OH)3 + ? c. BaCl2 + Na2SO4 → ?↓ + ? d. HCl + ? → ? + CO2↑ + H2O. e. NH4NO3 + ? → ? + NH3↑ + H2O. f. H2SO4 + ? → ? + H2O. Câu 5: Viết PT phân tử và ion rút gọn của các phản ứng (nếu có) khi trộn lẫn các chất sau: a. dd HNO3 và CaCO3 b. dd KOH và dd FeCl3 c. dd H2SO4 và dd NaOH d. dd Ca(NO3)2 và dd Na2CO3 e. dd NaOH và Al(OH)3 f. dd Al2(SO4)3 và dd NaOH vừa đủ g. dd NaOH và Zn(OH)2 h. FeS và dd HCl i. dd CuSO4 và dd H2S k. dd NaOH và NaHCO3 l. dd NaHCO3 và HCl m. Ca(HCO3)2 và HCl Câu 6: Viết phương trình phân tử ứng với phương trình ion thu gọn của các phản ứng sau a. Ba2+ + CO32- -> BaCO3 b. NH4 + + OH- ->NH3 + H 2O c. S2- + 2H+ -> H2S↑ d. Fe3+ + 3OH- ->Fe(OH)3↓ e. Ag+ + Cl- -> AgCl↓ f. H+ + OH- -> H2O Câu 7: Viết PTPƯ dạng phân tử và ion rút gọn (nếu có ) khi cho dung dịch Ba(OH)2 (dư) tác dụng lần lượt với các dung dịch: HCl, MgSO4, KHSO4, Fe(NO3)3 , MgCl2, Ba(HCO3)2, Zn(OH)2, (NH4)2CO3 Câu 8: Hoàn thành các PTHH sau dưới dạng phân tử và ion thu gọn ? 1. BaCl2 + ? → BaSO4 + ? 2. Ba(OH)2 + ? → BaSO4 + ? 3. Na2SO4 + ? → NaNO3 + ? 4. NaCl + ? → NaNO3 + ? 5. FeCl3 + ? → Fe(OH)3 +? 6. CaCO3 + ? → CaCl2 + ? 7. HPO42_ + ? → H3PO4 + ? 8. Be(OH)2 + ? → Na2BeO2 + ? 9. Al2(SO4)3 + ? → Na2SO4 + ? 10. NaHCO3 + ? → CaCO3 + ? 11. FeS + ? → H2S + ? 12. HClO + ? → NaClO + ? Câu 9. Viết PTHH (duới dạng phân tử và ion thu gọn ) của phản ứng trao đổi ion tạo thành từng chất sau : BaCO3, Cr(OH)3, Fe(OH)2, AgCl, H2O, CdS, Mg(OH)2 ? Câu 10: Hãy dẫn ra phản ứng giữa dung dịch các chất điện li tạo ra: a. hai chất kết tủa b. một chất kết tủa và một chất khí ? Viết các phương trình hoá học TUẦN 5: LUYỆN TẬP CHƯƠNG SỰ ĐIỆN LI BT ÁP DỤNG ĐỊNH LUẬT BẢO TOÀN ĐIỆN TÍCH - PHƯƠNG TRÌNH ION RÚT GỌN Câu 1. Dung dịch X có chứa a mol Ca2+, b mol Mg2+, c mol Cl- và d mol NO3-. Biểu thức nào sau đây đúng ? A. 2a - 2b = c + d B. 2a + 2b = c + d C. 2a + 2b = c - d D. a + b = 2c + 2d Câu 2. Dung dịch Y chứa 0,01 mol Na+, 0,02 mol Mg2+, 0,015 mol SO42-, và x mol Cl-. Vậy x có giá trị là: A. 0,015 B. 0,02 C. 0,01 D. 0,035 Câu 3. Dung dịch X có chứa 0,2 mol Ca2+, 0,2mol Na+, 0,4 mol Cl- và 0,2 mol NO3- . Cô cạn dd thu được khối lượng muối khan là A. 34,8g B. 39,2g C. 32,9g D. 78,4g Câu 4. Dung dịch A có 0,02 mol NH4+, x mol Fe3+, 0,01mol Cl-, và 0,02mol SO42-. Cô cạn dd thu được khối lượng muối khan là A. 3,915g B. 3,195g C. 2,85g D. 4,71g Câu 5. Dung dịch X chứa 0,02mol Cu2+, 0,01 mol Zn2+, x mol Cl- và y mol SO42- . Cô cạn dung dịch được 4,31g chất rắn. Vậy x, y lần lượt là A. x = 0,02; y = 0,02 B. x = 0,01; y = 0,02 C. x = 0,005; y = 0,03 D. x = 0,04; y = 0,01 Câu 6. Dung dịch X chứa 0,07 mol Na+; 0,02 mol SO42- 4 và x mol OH-.Dung dịch Y có chứa ClO4- , NO3- và y mol H+; tổng số mol ClO4- và NO3- là 0,04. Trộn X và Y được 100 ml dung dịch Z.Dung dịch Z có pH (bỏ qua sự điện li của H2O) là A. 2. B. 12 C. 13. D. 1. Câu 7. Thể tích dd NaOH tối thiểu cần cho vào dd hỗn hợp chứa 0,01 mol HCl và 0,02 mol MgCl2 để lượng kết tủa thu được là cực đại là A. 200 ml B. 300ml C. 400ml D. 500ml Câu 8: Dung dịch hỗn hợp B gồm KOH 1M và Ba(OH)2 0,75M. Cho từ từ dung dịch B vào 100ml dung dịch Zn(NO3)2 1M thấy cần dùng ít nhất V(ml) dung dịch B thì không còn kết tủa. V
Tài liệu đính kèm:
 boi_duong_11.doc
boi_duong_11.doc





