Giáo án Tuần 6 - Tiết 11: Đề kiểm tra 1 tiết môn : Hóa học 9
Bạn đang xem tài liệu "Giáo án Tuần 6 - Tiết 11: Đề kiểm tra 1 tiết môn : Hóa học 9", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
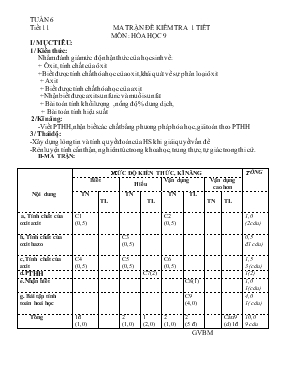
TUẦN 6 Tiết 11 MA TRẬN ĐỀ KIỂM TRA 1 TIẾT MÔN : HÓA HỌC 9 I/ MỤC TIÊU: 1/ Kiến thức: Nhằm đánh giá mức độ nhận thức của học sinh về: + Ôxit , tính chất của ôxit +Biết được tính chất hóa học của oxit,khái quát về sự phân loại ôxit + Axit + Biết được tính chất hóa học của axit +Nhận biết được axit sunfuric và muối sunfat + Bài toán tính khối lượng ,nồng độ % dung dịch, + Bài toán tính hiệu suất 2/Kĩ năng: -Viết PTHH,nhận biết các chất bằng phương pháp hóa học,giải toán theo PTHH 3/ Thái độ: -Xây dựng lòng tin và tính quyết đoán của HS khi giải quyết vấn đề -Rèn luyện tính cẩn thận, nghiêm túc trong khoa học, trung thực, tự giác trong thi cử. II-MA TRẬN: Nội dung MỨC ĐỘ KIẾN THỨC, KĨ NĂNG TỔNG Biết Hiểu Vận dụng Vận dụng cao hơn TN TL TN TL TN TL TN TL a, Tính chất của oxit axit C1 (0,5) C2 (0,5) 1,0 (2câu) b, Tính chất của oxit bazo C3 (0,5) 0,5 đ1 câu) c, Tính chất của axit C4 (0,5) C5 (0,5) C6 (0,5) 1,5 3 (câu) d.PTHH C7(2) 1(2) e.Nhận biết C8(1) 1,0 1(câu) g. Bài tập tính toán hoá học C9 (4,0) 4,0 1( câu) Tổng 1đ (1,0) 2 (1,0) 1 (2,0) 2 (1,0) 2 (5 đ) Câu9 (d) 1đ 10,0 9 câu GVBM Nguyễn Văn Hùng Phòng GD & ĐT Thị xã Buôn hồ ĐỀ KIỂM TRA 1 TIẾT ( Tiết 11) Trường THCS Hùng vương Môn Hóa học 9 NH : 2014 -2015 Họ và tên: . Lớp 9a Điểm Nhận xét của giáo viên: I/ TRẮC NGHIỆM : (3đ) Em hãy khoanh tròn vào một trong các chữ cái A, B, C, D mà em cho là câu trả lời đúng. Câu 1 : Dãy ôxit nào sau đây đều tác dụng với nước tạo thành dung dịch Axit A- CO2, K2O, Na2O, BaO B- CaO, K2O, P2O5, BaO C- K2O, Na2O, SO3,CaO C- CO2, SO3, P2O5, N2O5 Câu 2 : Dãy các chất tác dụng với lưu huỳnh đioxit là: A. Na2O, CO2, NaOH, Ca(OH)2 B. CaO, K2O, KOH, Ca(OH)2 C. HCl, Na2O, Fe2O3, Fe(OH)3 D. Na2O, CuO, SO3, CO2 Câu 3 : Dãy oxit vừa tác dụng nước, vừa tác dụng với dung dịch kiềm là: A.CuO, Fe2O3, SO2, CO2 B. CaO, CuO, CO, N2O5 C. SO2, MgO, CuO, Ag2O D. CO2, SO2, P2O5, SO3 Câu 4: Khi cho điphotpho pentaoxit tác dụng với nước ta được dung dịch không màu , nhúng giấy quỳ tím vào dung dịch thu được , quỳ tím sẽ : A, không đổi màu B) đổi thành màu đỏ C, đổi thành màu xanh D) mất màu Câu 5 : Trong công nghiệp và thủ công nghiệp vôi sống được sản xuất bằng cách nhiệt phân: A. Canxi nitrat B. Canxi photphat C. Canxi cacbonat D. Canxi sunfat Câu 6. Axit sunfuric loãng tác dụng được với dãy chất nào sau đây. a. Zn, CO2, NaOH ,CaO b. Zn, Cu, CaO , Al2O3 c. Zn, H2O, SO3 ,CuO d. Zn, NaOH, Na2O ,CuO II/ TỰ LUẬN : ( 7đ ) : Câu 7:(1,5đ) Cho những chất sau: H2O ; KOH ; Na2O ; CO2 . Có bao nhiêu cặp chất có thể phản ứng với nhau ?Viết PTHH Câu 8 .(1,5đ) Bằng phương pháp hóa học hãy phân biệt các dung dịch mất nhãn sau: NaCl, H2SO4, HCl ,Ba(OH)2 Viết PTHH minh họa . Câu 9(3đ) Hòa tan 2,4 gam CuO bằng 100gam dung dịch H2SO4 29,4% Viết phương trình phản ứng xảy ra. Tính khối lượng H2SO4 tham gia phản ứng Tính nồng độ phần trăm các chất có trong dung dịch thu được. Câu 10 (1đ) Hòa tan 19,5gam Zn vào 250 ml dung dịch H2SO4 2,4M .Tính thể tích khí hiđrô sinh ra biết rằng hiệu suất của phản ứng là 90%. ( Biết : Zn = 65 , H = 1 , O =16 , S = 32 ,Cu = 64 ) BÀI LÀM : ĐÁP ÁN VÀ THANG ĐIỂM TRẮC NGHIỆM: (3đ) Câu 1 2 3 4 5 6 Chọn C B D B C D II/ TỰ LUẬN : ( 7Đ) Câu 7 (2đ) Học sinh viết đúng mỗi cặp chất cho 0,25đ và viết đúng mỗi phương trình cho 0,25đ ( Nếu sai trừ nửa số điểm của câu đó.) 1, Na2O + H2O 2NaOH 2, CO2 + H2O H2CO3 3, Na2O + CO2 Na2CO3 4, CO2 + 2 KOH K2CO3 + H2O Câu:8 (1đ) Nhỏ lần lượt từ 2-3 giọt các dung dịch vào 3 mẫu giấy quỳ tím tương ứng. Mẫu giấy quỳ tím nào chuyển màu đỏ là có dd HCl, H2SO4 , không chuyển màu là NaCl (0,5 điểm) -Tiếp tục nhỏ vài giọt dd BaCl2 vào 2 mẫu làm quì tím hoá đỏ thấy mẫu nào xuất hiện kết tủa trắng thì đó là H2SO4 ,mẫu còn lại là HCl. (0,25đ) PTHH : BaCl2 + H2SO4 BaSO4 + 2HCl (0,25đ) Câu :9. (3đ) nCuO=và (0,5đ) a. PTHH: CuO + H2SO4 CuSO4 + H2O (0,5đ) 1 1 1 1 0,03 0,3 Trong phản ứng: 0,03 0,03 (0,5đ) Sau phản ứng: 0 0,27 0,03 b. Khối lượng H2SO4 đã phản ứng: m H2SO4 = 0,03x98 = 2,94 (gam) (0,5đ) c ,Nồng độ mol các chất trong dd sau phản ứng . Dd sau phản ứng gồm : CuSO4 = 0,03 mol và H2SO4 = 0,27mol Khối lượng dd thu được sau phản ứng :mCuO + m H2SO4 = 2,94 +100=102,4(gam) (0,5đ) Vậy C% ddCuSO4 = C% dd (0,5đ) Câu :10 (1đ) Học sinh tính được số mol cho 0,25đ PTHH 0,25đ Tính thể tích 0,25đ Tính hiệu suất 0,25đ = ========================Hết==========================
Tài liệu đính kèm:
 DE_KIEM_TRA_HOA_9_TIET_11_NH_20152016.doc
DE_KIEM_TRA_HOA_9_TIET_11_NH_20152016.doc





