Giáo án Tuần 10 - Tiết 20 - Kiểm tra 45 phút môn hóa học 9
Bạn đang xem tài liệu "Giáo án Tuần 10 - Tiết 20 - Kiểm tra 45 phút môn hóa học 9", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
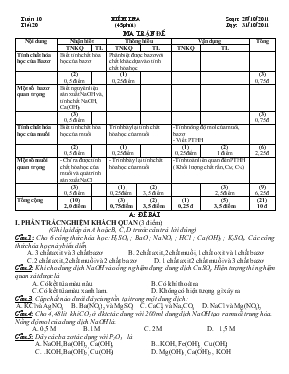
TuÇn 10 kiÓm tra So¹n: 28/10/2011 TiÕt 20 (45phót) D¹y: 31/10/2011 MA TRẬN ĐÒ Nội dung Nhận biết Thông hiểu Vận dụng Tổng TNKQ TL TNKQ TL TNKQ TL Tính chất hóa học của Bazơ Biết tính chất hóa học của bazơ Phân biệt được bazơ với chất khác dựa vào tính chất hóa học (2) 0,5 điểm (1) 0,25 điểm (3) 0,75 đ Một số bazơ quan trọng Biết nguyên liệu sản xuất NaOH và, tính chất NaOH, Ca(OH)2 (3) 0,5 điểm (3) 0,75 đ Tính chất hóa học của muối Biết tính chất hóa học của muối Trình bày lại tính chất hóa học của muối -Tính nồng độ mol của muối, bazơ - Viết PTHH (2) 0,5 điểm (1) 0,25điểm (1) 0,25điểm (2) 1 điểm (6) 2,25 đ Một số muối quan trọng - Chỉ ra được tính chất hóa học của muối và quá trình sản xuất NaCl - Trình bày lại tính chất hóa học của muối -Tính toán liên quan đến PTHH ( Khối lượng chất rắn, CM, C%) (3) 0,5 điểm (1) 0,25điểm (2) 3,5 điểm (3) 2,5 điểm (9) 6,25 đ Tổng cộng (10) 2,0 điểm (3) 0,75điểm (2) 3,5 điểm (1) 0,25 đ (5) 3,5 điểm (21) 10 đ A: ®Ò bµi I. PHẦN TRẮC NGHIỆM KHÁCH QUAN (3 điểm) (Ghi lại đáp án A hoặc B, C, D trước câu trả lời đúng) Câu 1: Cho 6 công thức hóa học: H2SO4 ; BaO ; NaNO3 ; HCl ; Ca(OH)2 ; K2SO4. Các công thức hóa học này biểu diễn A. 3 chất axit và 3 chất bazơ B. 2chất axit, 2chất muối, 1chất oxit và 1chất bazơ C. 2 chất axit, 2chất muối và 2 chất ba zơ D. 1 chất axit 2 chất muối và 3 chất bazơ Câu 2: Khi cho dung dịch NaOH vào ống nghiệm đựng dung dịch CuSO4. Hiện tượng thí nghiệm quan sát được là A. Có kết tủa màu nâu B. Có khí thoát ra C. Có kết tủa màu xanh lam. D. Không có hiện tượng gì xảy ra Câu 3: Cặp chất nào dưới đây cùng tồn tại trong một dung dịch: A. KClvà AgNO3 B. Ba(NO3)2 và MgSO4 C. CaCl2 và Na2CO3 D. NaCl và Mg(NO3)2 Câu 4: Cho 4,48 lít khí CO2 ở đktc tác dung với 200 ml dung dịch NaOH tạo ra muối trung hòa. Nồng độ mol của dung dịch NaOH là: A. 0,5 M B. 1M C. 2M D. 1,5 M Câu 5: Dãy các ba zơ tác dụng với P2O5 là A. NaOH, Ba(OH)2 , Ca(OH)2 B.. KOH, Fe(OH)2 , Cu(OH)2 C. .KOH, Ba(OH)2 , Cu(OH)2 D. Mg(OH)2 , Ca(OH)2 , KOH Câu 6: Cho sơ đồ phản ứng sau: K2SO4 + KCl + Chất cần điền vào chỗ dấu() lần lượt là: A. HCl , H2SO4 B. BaCl2 , BaSO4 C. MgCl2 và MgSO4 D. NaCl và Na2SO4 Câu 7: Dùng thuốc thử nào dưới đây có thể phân biệt 2 dung dịch natri sunfat và natri cacbonat A. Dung dịch bari clorua B. Dung dịch natri hyđroxit C. Dung dịch bạc nitrat D. Dung dịch axit clohiđric Câu 8: Trong các cặp chất dưới đây cặp chất nào có phản ứng với nhau A. KOH và H2SO4 B. Na2S và KCl C. BaCl2 và NaNO3 D.BaCl2 và H2S Câu 9: Biến đổi nào sau đây có thể thực hiện được A. Cu CuO Cu(OH)2 CuCl2 B. CuCuO CuCl2 Cu(OH)2 Cu Cu(OH)2 CuO CuCl2 D. Cu CuCl2 CuO CuCl2 Câu 10: Dãy gồm các muối không tan trong nước là A. CaSO4 ; CuCl2 ; CuSO4 B. AgNO3 ; BaCl2 ; Na2CO3 C. Na2SO4 ; Na3PO4; CaCl2 D. AgCl ; BaSO4 ; MgCO3 Câu 11: Trong các loại phân bón dưới đây, chất thuộc loại phân đạm là A. Ca(H2PO4)2 B. KNO3 C. CO(NH2)2 D. Ca3(PO4)2 Câu 12: Chất nào sau đây có thể dùng làm thuốc thử để phân biệt dung dịch axit clohiđric và dung dịch axit sunfuric. A. BaCl2 B. AlCl3 C. NaCl D. Na2CO3 II. PHẦN TỰ LUẬN (7 điểm) Câu 1 (2 điểm ) Viết các phương trình hóa học thực hiện biến đối hóa học sau Mg MgO MgSO4 MgCl2 Mg(OH)2 Câu 2 (2 điểm ) Chỉ dùng thêm quỳ tím, nêu phương pháp nhận biết các dung dịch sau và viết các phương trình hoá học của phản ứng xảy ra : H2SO4 ; NaCl ; Na2SO4 ; BaCl2 ; NaOH Câu 3 (3 điểm ) Để hòa tan vừa đủ 8 g Fe2O3 cần 200g dung dịch HCl thu được dung dịch A. Cho dung dịch A tác dụng vừa đủ với 200 ml dung dịch NaOH tạo ra a g kết tủa. Viết các phương trình hóa học xảy ra 2. Tính C% dung dịch HCl 3. Tính nồng độ mol của dung dịch NaOH và khối lượng của a. (C = 12 ; O = 16 ; Na = 23 ; H = 1 ; Fe = 56 ; Cl = 35,5) B: ®¸p ¸n vµ biÓu ®iÓm C©u ý §¸p ¸n §iÓm 1 Mỗi đáp án đúng 0,5 điểm Đ. Án 1 2 3 4 5 6 7 8 9 10 11 12 Điểm B C D C A B D A B D C A 3.0 2 2.0 2Mg + O2 2MgO MgO + H2SO4 MgSO4 + H2O MgSO4 + BaCl2 BaSO4 + MgCl2 MgCl2 + 2NaOH Mg(OH)2 + 2NaCl 0,5 0,5 0,5 0,5 3 2.0 - Dïng quú tÝm: + H2SO4 ®æi mµu quú tÝm thµnh ®á. + NaOH ®æi mµu quú tÝm thµnh xanh. + Na2SO4, NaCl, BaCl2 kh«ng lµm ®æi mµu quú tÝm. - Dïng H2SO4: + BaCl2 t¹o kÕt tña tr¾ng. + Na2SO4, NaCl Kh«ng t¹o kÕt tña. - Dïng BaCl2 + Na2SO4 t¹o kÕt tña tr¾ng. + NaCl Kh«ng t¹o kÕt tña. PTHH: BaCl2+ H2SO4® BaSO4+ 2H2O BaCl2+ Na2SO4® BaSO4+ 2NaOH 0,5 0,5 0,5 0,25 0,25 4 3.0 1 1,0 PTHH: Fe2O3 + 6HCl ® 2FeCl3 + 3H2O (1) FeCl3 + 3NaOH ® Fe(OH)3 + 3NaCl (2) 0,5 0,5 2 1,0 nFeO = Theo pt(1): nHCl = 6nFeO = 6 x 0,05 = 0,3(mol) mHCl = 0,3 x 36,5 = 10,95(g) C%HCl = 0,25 0,25 0,5 3 1,0 Theo pt(1),(2): nNaOH = 0,3(mol) Vdd NaOH = 200ml = 0,2(l) CMNaOH = Theo pt(1),(2): nFe(OH) = 0,1(mol) mFe(OH) = 0,1 x 107 = 10,7(g) 0,25 0,25 0,25 0,25
Tài liệu đính kèm:
 TUẦN 10 - TIẾT 20.doc
TUẦN 10 - TIẾT 20.doc





