Giáo án Kiểm tra học kì I môn: Hóa học 9
Bạn đang xem tài liệu "Giáo án Kiểm tra học kì I môn: Hóa học 9", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
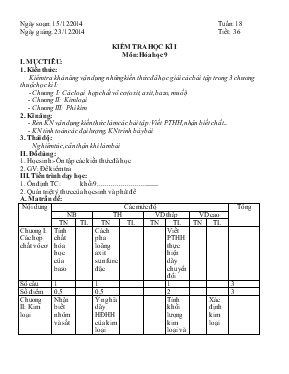
Ngày soạn: 15/12/2014 Tuần: 18 Ngày giảng: 23/12/2014 Tiết: 36 KIỂM TRA HỌC KÌ I Môn: Hóa học 9 I. MỤC TIÊU: 1. Kiến thức: Kiểm tra khả năng vận dụng những kiến thức đã học giải các bài tập trong 3 chương thuộc học kì I: - Chương I: Các loại hợp chất vô cơ(oxit, axit, bazo, muối) - Chương II: Kim loại - Chương III: Phi kim 2. Kĩ năng: - Rèn KN vận dụng kiến thức lám các bài tập: Viết PTHH, nhận biết chất... - KN tính toán các đại lượng, KN trình bày bài 3. Thái độ: Nghiêm túc, cẩn thận khi làm bài II. Đồ dùng: 1. Học sinh:- Ôn tập các kiến thức đã học 2. GV: Đề kiểm tra III. Tiến trình dạy học: 1. Ổn định TC: khối 9..................................... 2. Quán triệt ý thưc của học sinh và phát đề A. Ma trần đề: Nội dung Các mức độ Tổng NB TH VD thấp VD cao TN TL TN TL TN TL TN TL Chương I: Các hợp chất vô cơ Tính chất hóa học của bazo Cách pha loãng axit sunfuric đặc Viết PTHH thực hiện dãy chuyển đổi Số câu 1 1 1 3 Số điểm 0,5 0,5 2 3 Chương II: Kim loại Nhận biết nhôm và sắt Ý nghĩa dãy HĐHH của kim loại Tính khối lượng kim loại và thể tích dd axit Xác định kim loại Số câu 1 1 1 1 4 Số điểm 0,5 0,5 2,5 1 4,5 Chương III: Phi kim Điều chế clo Nhận biết các khí Số câu 1 1 2 Số điểm 0,5 2 2,5 Tổng 3c 1,5 đ 3c 3 đ 2 c 4,5 đ 1c 1 đ 9 c 10 đ B. ĐỀ KIỂM TRA: TRẮC NGHIỆM KHÁCH QUAN: (2,5 đ) Hãy khoanh tròn một trong các chữ cái A, B, C hoặc D ở các câu sau đây, nếu đúng. Câu 1: Các chất không tác dụng với dung dịch muối CuSO4 ở nhiệt độ thường là: A. Al B. Ag C. Fe D. Mg Câu 2: Có hai chất bột, màu tương tự nhau, đựng trong các lọ riêng biệt đã mất nhãn là nhôm và sắt. Hóa chất dùng để nhận biết các lọ hóa chất đó là: A. H2SO4 đặc, nguội. B. dung dịch HCl C. dung dịch CuSO4 D. dung dịch NaOH. Câu 3: Sau khi làm thí nghiệm điều chế và thử tính chất của clo, khí clo dư được loại bỏ bằng cách sục khí clo dư vào: A. Dung dịch NaCl B. Dung dịch NaOH C. Dung dịch HCl D. Nước cất Câu 4: Cho các bazơ: Ca(OH)2, Cu(OH)2, NaOH, Fe(OH)3, Mg(OH)2 Số các bazơ bị nhiệt phân hủy là A. 5 B. 2 C. 3 D. 4 Câu 5: Khi pha loãng dung dịch axit sunfuric thì phải rót từ từ : A. Dung dịch axxit sunfuric đặc vào nước B. Nước vào dung dịch axit sunfuric đặc C. Dung dịch axit sunfuric loãng vào dung dịch axit sunfuric đặc D. Cho SO3 vào dung dịch axit sunfuric loãng TỰ LUẬN: (7,5 đ). Câu 1 (2đ): Viết phương trình hoá học theo dãy chuyển đổi hóa học sau : (ghi rõ điều kiện phản ứng – nếu có): Al(OH)3 Al2O3 Al Al2(SO4)3 AlCl3 Câu 2 (2đ): Có ba chất khí đựng riêng biệt trong ba lọ đã mất nhãn là: Clo, hidro clorua và oxi. Chỉ dùng quì tím ẩm hãy trình bày cách nhận biết ba lọ khí này, viết phương trình hóa học (nếu có). Câu 3: (2.5đ) Cho Zn vào dung dịch HCl 2M thấy có 6,72 lit khí thoát ra. a. Viết PTHH b. Tính khối lượng Zn cần dùng c. Tính thể tích dung dịch axit cần dùng. Câu 4: (1.0đ) Đốt cháy hoàn toàn 0,03375 gam một kim loại M (chưa biết hóa trị) trong bình chứa khí clo dư thu được 0,166875 gam muối clorua. Xác định kim loại M. C. ĐÁP ÁN: TRẮC NGHIỆM: Mỗi câu đúng được 0,5 đ 1 2 3 4 5 B D B C A TỰ LUẬN: Câu 1: Mỗi PTHH viết đúng được 0,5 đ to 2Al(OH)3 Al2O3 + 3H2O (1) (2) 2 Al2O3 → 4 Al + 3 O2 (3) 2 Al + 3 H2SO4 l → Al2(SO4)3 + 3 H2 (4) Al2(SO4)3 + 3BaCl2 → 2 AlCl3 + 3 BaSO4 Lưu ý: - Các phản ứng 1 và 2 không ghi điều kiện trừ 0,25đ cho mỗi PTHH. Không cân bằng, trừ 0,25đ cho mỗi phản ứng. Nếu bị cả 2 lỗi trên thì chỉ trừ một lỗi. - Phương trình 3 có thể thay H2SO4 loãng bằng muối sunfat tan của những kim loại kém hoạt động hơn nhôm. Câu 2: 2 điểm 1 Nêu cách nhận biết: Dùng quì tím ẩm đưa vào miệng các lọ khí, hiện tượng: Quì tím không đổi màu là lọ khí oxi. Quì tím hóa đỏ là lọ khí HCl. Quì tím hóa đỏ rồi mất màu ngay là lọ khí clo. 1,5đ 2 Viết PTHH: Cl2 + H2O HCl + HClO 0,5đ Câu 3: a. pthh: Zn + 2HCl → ZnCl2 + H2 (0,5 đ) b. - Số mol H2 thu được(đktc): n= V/22,4 = 6,72 / 22,4 = 0,3 (mol) - Theo PTHH=> Số mol Zn bằng số mol hidro => nZn = 0,3 (mol) - Khối lượng kẽm cần dùng là: mZn == n x M= 0,3 x 65= 19,5 (g) (1đ) c. Theo PTHH => nHCl = 2x 0,3 = 0,6 (mol) - Thể tích dd HCl cần dùng là: VHCl = n x 22,4 = 0,6 x 22,4 = 13,44 (l) (1đ) Câu 4: 1 Gọi CTHH đươc tạo ra giữa kim loại M và clo là MCln. (n là hóa trị của M, giá trị n là 1 hoặc 2 hoặc 3) PTHH: 2M + nCl2 2MCln mol: 0,001875 0,25đ 0,25đ 2 Số mol khí clo phản ứng : 0,25đ 3 Vậy; Phương trình trên nghiệm đúng với n = 3 suy ra M = 27(g) suy ra nguyên tử khối M bằng 27. Vậy kim loại cần tìm là nhôm KHHH: Al. 0,25đ 3. Thu bài. Nhận xét giờ kiểm tra: 4. Dặn dò:- Đọc trước bài sau RÚT KINH NGHIỆM: XÁC NHẬN CỦA BAN GIÁM HIỆU ĐỀ THI KIỂM TRA HỌC KÌ I Môn: Hóa học 9 Thời gian: 45 phút TRẮC NGHIỆM KHÁCH QUAN: (2,5 đ) Hãy khoanh tròn một trong các chữ cái A, B, C hoặc D ở các câu sau đây, nếu đúng. Câu 1: Các chất không tác dụng với dung dịch muối CuSO4 ở nhiệt độ thường là: A. Al B. Ag C. Fe D. Mg Câu 2: Có hai chất bột, màu tương tự nhau, đựng trong các lọ riêng biệt đã mất nhãn là nhôm và sắt. Hóa chất dùng để nhận biết các lọ hóa chất đó là: A. H2SO4 đặc, nguội. B. dung dịch HCl C. dung dịch CuSO4 D. dung dịch NaOH. Câu 3: Sau khi làm thí nghiệm điều chế và thử tính chất của clo, khí clo dư được loại bỏ bằng cách sục khí clo dư vào: A. Dung dịch NaCl B. Dung dịch NaOH C. Dung dịch HCl D. Nước cất Câu 4: Cho các bazơ: Ca(OH)2, Cu(OH)2, NaOH, Fe(OH)3, Mg(OH)2 Số các bazơ bị nhiệt phân hủy là A. 5 B. 2 C. 3 D. 4 Câu 5: Khi pha loãng dung dịch axit sunfuric thì phải rót từ từ : A. Dung dịch axxit sunfuric đặc vào nước B. Nước vào dung dịch axit sunfuric đặc C. Dung dịch axit sunfuric loãng vào dung dịch axit sunfuric đặc D. Cho SO3 vào dung dịch axit sunfuric loãng TỰ LUẬN: (7,5 đ). Câu 1 (2đ): Viết phương trình hoá học theo dãy chuyển đổi hóa học sau : (ghi rõ điều kiện phản ứng – nếu có): Al(OH)3 Al2O3 Al Al2(SO4)3 AlCl3 Câu 2 (2đ): Có ba chất khí đựng riêng biệt trong ba lọ đã mất nhãn là: Clo, hidro clorua và oxi. Chỉ dùng quì tím ẩm hãy trình bày cách nhận biết ba lọ khí này, viết phương trình hóa học (nếu có). Câu 3: (2.5đ) Cho Zn vào dung dịch HCl 2M thấy có 6,72 lit khí thoát ra. a. Viết PTHH b. Tính khối lượng Zn cần dùng c. Tính thể tích dung dịch axit cần dùng. Câu 4: (1.0đ) Đốt cháy hoàn toàn 0,03375 gam một kim loại M (chưa biết hóa trị) trong bình chứa khí clo dư thu được 0,166875 gam muối clorua. Xác định kim loại M.
Tài liệu đính kèm:
 DE_THI_HOC_KI_I_HOA_HOC_9.doc
DE_THI_HOC_KI_I_HOA_HOC_9.doc





