Giáo án Hóa học Lớp 9 - Tiết 20: Kiểm tra 1 tiết
Bạn đang xem tài liệu "Giáo án Hóa học Lớp 9 - Tiết 20: Kiểm tra 1 tiết", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
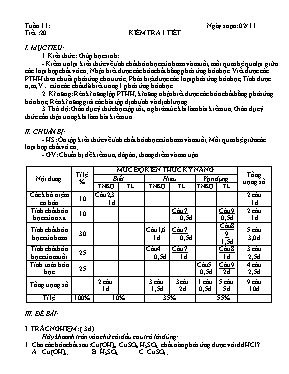
Tuần 11: Ngày soạn: 02/ 11. Tiết :20 . KIỂM TRA 1 TIẾT I. MỤC TIÊU: 1.Kiến thức : Giúp học sinh: - Kiểm tra lại kiến thức về tính chất hóa học của bazơ và muối, mối quan hệ qua lại giữa các loại hợp chất vô cơ; Nhận biết được các hóa chất bằng phản ứng hóa học. Viết được các PTHH theo chuỗi phản ứng cho trước; Phân biệt được các loại phản ứng hóa học; Tính dược n,m,V của các chất đã biết trong 1 phản ứng hóa học. 2. Kĩ năng: Rèn kĩ năng lập PTHH, kĩ năng nhận biết được các hóa chất bằng phản ứng hóa học; Rèn kĩ năng giải các bài tập định tính và định lượng. 3.Thái độ: Giáo dục ý thức học tập tốt, nghiêm túc khi làm bài kiểm tra; Giáo dục ý thức cẩn thận trong khi làm bài kiểm tra. II. CHUẨN BỊ: - HS: Ôn tập kiến thức về tính chất hóa học của bazơ và muối; Mối quan hệ giữa các loại hợp chất vô cơ; - GV: Chuẩn bị đề kiểm tra, đáp án, thang điểm và ma trận. Nội dung Tỉ lệ % MỨC ĐỘ KIẾN THỨC KỸ NĂNG Tổng trọng số Biết Hiểu Vận dụng TNKQ TL TNKQ TL TNKQ TL Các khái niệm cơ bản 10 Câu2,3 1đ 2 câu 1đ Tính chất hóa học của oxit 10 Câu 7 0,5đ Câu 9 0,5đ 2 câu 1đ Tính chất hóa học của bazơ 30 Câu1,6 1đ Câu 7 0,5đ Câu89 1,5đ 5 câu 3,0 đ Tính chất hóa học của muối 25 Câu4 0,5đ Câu 7 1đ Câu 8 1đ 3 câu 2,5đ Tính toán hóa học 25 Câu5 0,5đ Câu 9 2đ 4 câu 2,5đ Tổng trọng số 2 câu 1đ 3 câu 1,5đ 3câu 2đ 1 câu 0,5đ 5 câu 5đ 9 câu 10đ Tỉ lệ 100% 10% 35% 55% III. ĐỀ BÀI: I. TRẮC NGHIỆM: ( 3đ) Hãy khoanh tròn vào chữ cái đầu câu trả lời đúng: 1. Cho các hóa chất sau: Cu(OH)2, CuSO4, H2SO4. chất nào phản ứng được với dd HCl? A. Cu(OH)2 ; B. H2SO4; C. CuSO4 ; 2. Trong các PTHH sau, phương trình nào thuộc phản ứng trung hòa? A.CuO(r) + 2HCl(dd) CuCl2(dd) + H2O(l) B. 2Fe(OH)3(r) Fe2O3( r) + 3H2O(h) C. 2NaOH (dd) + H2SO4(dd) Na2SO4( dd) + 2H2O(l) D. 2NaOH (dd) + CuSO4( dd) Cu(OH)2(r) + Na2SO4( dd) 3. Trong các PTHH sau, phương trình nào thuộc phản ứng trao đổi? A. Cu(OH)2(r) CuO(r) + H2O(h) B. AgNO3(dd) + NaCl(dd) AgCl(r) + NaNO3(dd) C. 2NaOH (dd) + CO2(k) Na2CO3( dd) + H2O(l) D. CuSO4( dd) + Fe(r) FeSO4(dd) + Cu(r) 4. Chất nào trong những chất thử sau đây có thể dùng để phân biệt dd Na2SO4 và dd Na2CO3? A. dd BaCl2 ; B. dd AgNO3 ; C. dd HCl; D. dd NaOH 5. Để có dd NaCl 16% cần phải lấy bao nhiêu gam nước để hòa tan 20g NaCl? A.125g B.105g C. 145g D. 107g 6. Có những bazơ sau: Ba(OH)2, Cu(OH)2, NaOH. Bazơ nào bị nhiệt phân hủy ? A. Ba(OH)2 ; B. Cu(OH)2 ; C. NaOH; D. Cả A và B II. TỰ LUẬN: ( 7đ) 7. Viết các PTHH cho dãy chuyển đổi hóa học sau: (2đ) Na2O NaOH Na2CO3 Na2SO4 NaCl 8. Có 3 lọ mất nhãn đựng các dd sau: NaOH, Ba(OH)2, NaCl. Hãy trình bày cách nhận biết chất đựng trong mỗi lọ bằng phương pháp hóa học. Viết các PTHH ( nếu có).( 2đ) 9. Cho 3,1 gam Natri oxit tác dụng với nước, thu được 1 lít dung dịch A. (3đ) a. Viết PTHH xảy ra? b. Dung dịch A là dung dịch axit hay bazơ ? Tính nồng độ mol của dung dịch A ? c. Tính khối lượng của dung dịch H2SO4 20% cần dùng để trung hòa hết lượng dung dịch A? Cho biết: Na = 23; O = 16; H = 1; S = 32. IV. ĐÁP ÁN - THANG ĐIỂM: Phần I. TRẮC NGHIỆM KHÁCH QUAN:(4đ) Câu 1 2 3 4 5 6 Đáp án A C B C B B Điểm 0,5 0,5 0,5 0,5 0,5 0,5 Phần II. TỰ LUẬN: (6đ) Câu 7 Đáp án Biểu điểm 1 Na2O(r) + H2O(l) g 2NaOH(dd) 0,5 2 2NaOH(dd) + CO2(k) g Na2CO3(dd) + H2O(l) 0,5 3 Na2CO3(dd) + H2SO4(dd) g Na2SO4(dd) + CO2(k) + H2O(l) 0,5 4 Na2SO4(dd) + BaCl2(dd) g BaSO4(r) + 2NaCl(dd) 0,5 Câu 8 (1đ) Đáp án Biểu điểm * Thử bằng quì tím g Xanh là NaOH và Ba(OH)2 ; g Tím là NaCl. 0,5 0,25 * Thử bằng H2SO4(dd) g Kết tủa trắng (BaSO4) là Ba(OH)2 : H2SO4(dd) + Ba(OH)2(dd) + BaSO4(r) + 2 H2O(l) * Lọ còn lại không kết tủa là NaOH. 0,5 0,5 0,25 Câu 9: (3đ) Câu Đáp án Biểu điểm a - PTHH: Na2O(r) + H2O(l) 2NaOH(dd) (1) H2SO4(dd) + 2NaOH(dd) Na2SO4(dd) + H2O(l) (2) 1,0 b - A là dung dịch bazơ ( NaOH ). - Tính CM(A) = ? + nNa2O = 3,1 : 62 = 0,05 ( mol ) + Theo PTHH, ta có: nNaOH = 2.nNa2O = 2.0,05 = 0,1 (mol) Vậy: CM(NaOH) = 0,1.1 = 0,1 M 1,0 c - PTHH: H2SO4(dd) + 2NaOH(dd) Na2SO4(dd) + H2O(l) (2) 0,05 mol 0,1 mol - Tính mH2SO4 = ? + Ta có: mH2SO4 = 0,05.98 = 4,9 g. mH2SO4 = (4,9 . 100) : 20 = 24,5 g. 1,0 MA TRẬN KT HK I Nội dung Tỉ lệ % MỨC ĐỘ KIẾN THỨC KỸ NĂNG Tổng trọng số Biết Hiểu Vận dụng TNKQ TL TNKQ TL TNKQ TL Tính chất hóa học của oxit 15 Câu 2 0,5 đ c.1(2) 1,0 đ 2 câu 1,5 đ Tính chất hóa học của axit 5 Câu 1 0,5 đ 1 câu 0,5 đ Tính chất hóa học của bazơ 10 Câu 3 0,5 đ c.2(B) 0,5 đ 2 câu 1,0 đ Tính chất hóa học của muối 15 c.1(3);2(A) 1,5 đ 2 câu 1,5 đ Tính chất hóa học của nhôm 20 c.1(1) 1,0 đ c.3(a) 1,0 đ 2 câu 2,0 đ Nhận biết 10 Câu 5 0,5 đ Câu 4 0,5 đ 2 câu 1,0 đ Dãy hoạt động hóa học của kim loại 5 Câu 6 0,5 đ 1 câu 0,5 đ Tính toán 20 c.3(b,c) 2,0 đ 2 câu 2,0 đ Tổng trọng số 3 câu 1,5 đ 3 câu 1,5 đ 5 câu 4,0 đ 3 câu 3,0 đ 9 câu 10,0 đ Tỉ lệ 100% 15% 55% 30%
Tài liệu đính kèm:
 giao_an_hoa_hoc_lop_9_tiet_20_kiem_tra_1_tiet.docx
giao_an_hoa_hoc_lop_9_tiet_20_kiem_tra_1_tiet.docx






