Giáo án Chương 5: Nhóm Halogen
Bạn đang xem tài liệu "Giáo án Chương 5: Nhóm Halogen", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
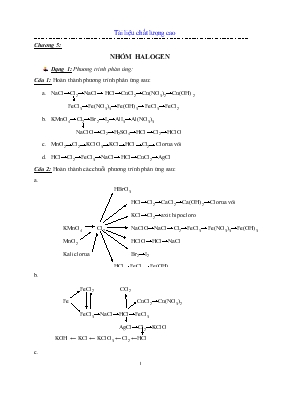
Chương 5: NHÓM HALOGEN Dạng 1: Phương trình phản ứng: Câu 1: Hoàn thành phương trình phản ứng sau: NaCl→Cl2→NaCl→ HCl→CuCl2→Cu(NO3)2→Cu(OH)2 FeCl3→Fe(NO3)3→Fe(OH)3→FeCl3→FeCl2 KMnO4→Cl2→Br2→I2→AlI3→Al(NO3)3 NaClO→Cl2→H2SO4→HCl→Cl2→HClO MnO2→Cl2→KClO3→KCl→HCl→Cl2→Clorua vôi HCl→Cl2→FeCl3→NaCl→HCl→CuCl2→AgCl Câu 2: Hoàn thành các chuỗi phương trình phản ứng sau: HBrO3 HCl→Cl2→CaCl2→Ca(OH)2→Clorua vôi KCl→Cl2→axit hipocloro KMnO4 Cl2 NaClO→NaCl→Cl2→FeCl3→Fe(NO3)3→Fe(OH)3 MnO2 HClO→HCl→NaCl Kaliclorua Br2→I2 HCl→FeCl2→Fe(OH)2 FeCl2 CO2 Fe CuCl2→Cu(NO3)2 FeCl3→NaCl→HCl→FeCl3 AgCl→Cl2→KClO KOH ← KCl ← KClO3 ← Cl2 ←HCl HCl→Cl2→I2→NaI→NaBr→Br2→HBr→HNO3 Br2 → FeBr3 → Fe(OH)3 → FeCl3 → Fe(NO3)3 Kaliclorat→KCl→Cl2→CaCl2→Ca→CaF2→HF→SiF4 F2→O2→H2O nuoc Giaven HF→H2O→HCl→clorua vôi Câu 3: Bổ túc và hoàn thành các PTHH sau: A + HCl → MnCl2 + B + H2O B + C → Kaliclorat + D + H2O D + H2O → B + E + C B + E → G G + Fe → E + H H + B → I Fe + B → I NaCl + H2SO4 → A + B A + MnO2 → C + D + E F + E → C + H + I H + C → Nuoc Giaven KClO3 A + B A + MnO2 + H2SO4 → C + D + E + F A → G + C G + H2O → L + M C + L → KClO + A + F C + L → KClO3 + A + F M + C → J J + Fe → L + M C + Fe → I L + C → I Câu 4: Hãy điền các hợp chất của clo vào các phản ứng sau: ? + H2SO4 → ? + Na2SO4 ? + CuO → ? + CuCl2 ? + CuSO4 → ? + BaSO4 ? + AgNO3 → ? HNO3 ? + Na2S → ? + H2S ? + Pb(NO3)2 → ? + KNO3 ? + Mg(OH)2 → ? + H2O ? + CaCO3 → ? + H2O + CO2 ? + FeS → ? + H2S Câu 5: Bổ túc các phương trình phản ứng sau: Cl2 + A → B B + Fe → C + H2 C + Cl2 → D D + E → F + NaCl Dạng 2: Viết phương trình phản ứng chứng minh và điều chế: Câu 6: Viết 5 phương trình phản ứng điều chế trực tiếp Cl2, 4 phản ứng trực tiếp điều chế HCl Câu 7: Dẫn khí Cl2 vào trong dung dịch KOH ở nhiệt độ thường và ở 100oC. Cho biết vai trò của Cl2 trong phản ứng trên. Câu 8: Dẫn ra các phản ứng chứng tỏ rằng: HCl có thể tham gia phản ứng oxi hoá – khử với vai trò: Chất oxi hoá, chất khử, làm môi trường. HCl có thể tham gia phản ứng trao đổi. Câu 9: Viết phương trình phản ứng chứng minh: Cl2 có tính oxi hoá (5 phản ứng) Cl2 vừa thể hiện tính khử và tính oxi hoá HCl là chất khử HCl là chất oxi hoá HCl không phải là chất khử và cũng không phải là chất oxi hoá Br2 có tính oxi hoá Br2 vừa thể hiện tính khử và tính oxi hoá Br2 có tính khử HBr có tính khử HI có tính khử và tính khử của HI > HBr HBr không phải là chất khử và cũng không phải là chất oxi hoá Tính oxi hoá Cl2 > Br2 > I2 I2 có tính khử NaCIO có tính oxi hoá mạnh Tính axit H2CO3 mạnh hơn HClO Câu 10: Từ các chất vô cơ cần thiết và điều kiện thích hợp. Hãy viết các PTHH để điều chế các hợp chất sau Từ MnO2 , HCl đặc, Fe. Viết các phương trình điều chế: FeCl2 và FeCl3 Từ đá vôi, muối ăn, nước. Viết các PTHH điều chế Clorua vôi, xút ăn da và axit Clohidric Từ H2O, H2SO4 đặc, NaCl tinh thể, Fe. Viết các PTHH điều chế FeCl3; FeCl2; Fe(OH)2 ; Fe(OH)3. Câu 11: Trong phòng thí nghiệm người ta có thể điều chế khí clo bằng những phản ứng sau. Hãy viết các phương trình hoá học Dùng MnO2 oxi hoá dung dịch HCl đặc Dùng KMnO4 oxi hoá dung dịch HCl đặc Dùng H2SO4 đặc tác dụng với hỗn hợp NaCl và MnO2 Câu 12: Những hidro halogenua nào có thể điều chế được khi cho axit sunfuric đặc tác dụng lần lượt với các muối Natri florua Natri clorua Natri bromua Natri iotua Giải thích và viết phương trình hoá học Dạng 3: Nhận biết và phân biệt: Câu 13: Phân biệt các dung dịch sau: NaCl, HCl, NaNO3, KOH K2CO3, AgNO3, K2SO4 (dùng 1 hoá chất) Na2S, AgNO3, KI, KCl CaCl2, CaBr2, HNO3, NaOH, NaNO3 Các chất ở dạng bột: BaSO4, K2SO4, KCl, KNO3 Câu 14: Bằng phương pháp hoá học, hãy phân biệt các lọ mất nhãn: 5 dd: KOH, K2SO4, KCl, K2SO3, KNO3 4 dd: HCl, NaOH, Ba(OH)2, Na2SO4 4 dd: HCl, HNO3, H2SO4, HBr 4 dd: KCl, K2SO4, KNO3, KI, NaBr 4 dd: BaCl2, K2SO4, Al(NO3)3, Na2CO3 4 dd: HCl, KCl, KBr, NaI 4 dd: I2, Na2CO3, NaCl, NaBr Dd: KOH, HCl, HNO3, K2SO4, BaCl2 Chất rắn: CaCO3, K2CO3, NaCl, KNO3 Chất rắn: AgCl, KCl, BaCO3, KI 4 dd: BaCl2, NaBr, Na2CO3, AgNO3 4 dd: MgCl2, NaBr, Ca(NO3)2, HI 5 chất rắn: KNO3, BaCl2, BaCO3, Na2SO4, BaSO4 Chỉ dùng 1 hoá chất: NaCl, NaBr, NaI Dạng 4: Toán điều chế và hiệu suất phản ứng: Câu 15: Điện phân hoàn toàn dung dịch chứa 11,7 g NaCl với điện cực trơ, màng ngăn xốp. Số lít clo thu được (đktc) là bao nhiêu? Câu 16: Cho 17,4 gam MnO2 tác dụng hết với dung dịch HCl. Toàn bộ khí Cl2 sinh ra cho hấp thụ vào 145,8 gam dung dịch NaOH 20% ở nhiệt độ thường. Tính nồng độ % các chất sau phản ứng Câu 17: Cho 3,16 gam kalipemanganat tác dụng với 17 gam dd HCl 36,5%. Tính thể tích khí clo (đkc) thoát ra và nồng độ % các chất trong dd thu được sau phản ứng Câu 18: Cho 69,6 gam mangandioxit tác dụng hết với dd Clohidric đặc. Toàn bộ lượng clo sinh ra được hấp thụ hết vào 500 ml dd NaOH 4M. Xác định nồng độ mol của các chất trong dd thu được sau phản ứng. (Coi thể tích dd không thay đổi) Câu 19: Khi bị nung nóng, KClO3 đồng thời phân huỷ theo 2 cách: Tạo O2 và KCl (a) Tạo kalipeclorat và KCl (b) Tính xem có bao nhiêu % về khối lượng KClO3 đã phân huỷ theo phản ứng (a) và phản ứng (b) biết rằng khi phân huỷ 73,5 g KClO3 thu được 33,525g KCl Câu 20: Một hỗn hợp gồm 108 gam H2, 800 gam O2 và 284 gam Cl2. Người ta thực hiện phản ứng nổ trong bình kín. Tính C% của dung dịch thu được. Câu 21: Cho 10 lít H2 và 6,72 lít Clo (đkc) tác dụng với nhau rồi hoà tan sản phẩm vào 385,4 gam nước thu được dd A. Lấy 50 gam dd A cho tác dụng với dd AgNO3 dư thu được 7,175 gam kết tủa. Tính hiệu suất của phản ứng giữa H2 và Cl2 Câu 22: Tính thể tích khi clo thu được (đkc) khi cho 15,8 gam KMnO4 tác dụng với axit clohidric Câu 23: Hoà tan 11,2 lít khí HCl vào m gam dd HCl 16% thu được dd HCl 21,11%. Tính khối lượng m. Câu 24: Đốt AI trong bình Cl2 thì thu được 26,7 gam muối. Hỏi có bao nhiêu gam clo đã phản ứng. Câu 25: Đem nung 2,8 (g) Fe rồi cho vào bình đựng 1,344 (l) khí Cl2 (ở đkc). Sau một thời gian, ngừng phản ứng thì thu được 4,875 (g) một muối sắt. Hãy tính hiệu suất của phản ứng trên Câu 26: Cho 2,7 (g) Al tác dụng với 36,5 (g) dd HCl 40% thu được 0,336 (l) khí H2. Tính hiệu suất của phản ứng. Câu 27: Cho 9,6 (g) Cu tác dụng với khí Cl2 dư. Tính khối lượng sản phẩm tạo thành biết hiệu suất phản ứng là 90% Câu 28: Cho 8,4 gam sắt tác dụng với khí clo dư. Tính khối lượng sản phẩm tạo thành. Biết hiệu suất phản ứng là 90% Câu 29: Tính khối lượng KMnO4 và nồng độ % của dd HCl (D=1,123 g/ml) cần dùng để điều chế 5,6 lít khí clo (đkc). Biết hiệu suất phản ứng 80% và thể tích dd HCl đã dùng là 130 ml Câu 30: Cho 50(g) dd NaOH 30% tác dụng với 200ml dd HCl 2M. Tính khối lượng muối thu được biết hiệu suất phản ứng là 96% Câu 31: Tính khối lượng Clo và H2 cần dùng để tạo nên 25 tấn HCl. Biết hiệu suất phản ứng chỉ đạt 80%. Dạng 5: Tìm tên Halogen: Câu 32: Cho lượng dư dung dịch AgNO3 tác dụng với 100ml dung dịch hỗn hợp NaF 0,05M và NaCl 0,1M. Tính khối lượng kết tủa thu được? Câu 33: Cho 4,6 gam Na tác dụng với 1 halogen X thu được 11,7 gam muối. Xác định X Câu 34: Chất A là muối Canxi halogenua. Cho dung dịch chứa 0,200gam A tác dụng với lượng dư dung dịch AgNO3 thu 0,376 g kết tủa bạc halogenua. Xác định công thức chất A. Câu 35: Cho 1,03 gam muối NaX tác dụng với dung dịch AgNO3 dư thu được 1,88 gam kết tủa. Xác định NaX. Câu 36: Cho 31,84 gam hỗn hợp 2 muối natrihalogenua của 2 halogen thuộc 2 chu kỳ liên tiếp nhau vào dung dịch AgNO3 dư thu 57,34 gam ↓. Xác định công thức 2 halogen và khối lượng mỗi muối Câu 37: Cho hỗn hợp 2 muối kali halogenua của 2 halogen thuộc 2 chu kỳ liên tiếp nhau vào 0,35 mol AgNO3 vừa đủ thu được 59,125 gam hỗn hợp ↓. Xác định tên 2 muối và khối lượng mỗi muối. Câu 38: 15,92 gam hỗn hợp 2 muối NaX tác dụng hoàn toàn với AgNO3 thu được 28,67 gam ↓. Xác định 2 halogen biết 2 halogen thuộc 2 chu kỳ liên tiếp. Câu 39: 2,2 gam hỗn hợp 2 muối NaX tác dụng vừa đủ với 150 ml dung dịch AgNO3 thu được m gam hỗn hợp ↓. Xác định m và tên 2 halogen kế tiếp. Câu 40: Cho m gam hỗn hợp muối clorua của 1 kim loại kiềm và 1 kim loại kiềm thổ tác dụng vừa đủ với dung dịch AgNO3 thu được 7,175 gam ↓ đồng thời khối lượng dung dịch giảm 3,83 gam. Tính m (biết 2 muối được trộn theo tỉ lệ mol 3:1) Khối lượng nguyên tử kim loại kiềm kém kim loại kiềm thổ 1 u. Xác định công thức 2 muối Câu 41: Cho 13,35 gam muối nhôm halogenua tác dụng với dung dịch AgNO3 vừa đủ thu được ↓. Đưa ↓ ra ngoài ánh sáng thu được 32,4 gam Ag. Xác định tên halogen Câu 42: Cho m gam đơn chất halogen X tác dụng với Mg dư thu được 19 gam MgX2. Cũng m gam halogen trên tác dụng với Al dư thu được 17,8 gam AlX3. Xác định halogen Câu 43: Hoà tan 4,25 gam 1 muối halogen của kim loại kiềm vào H2O được 200 ml dung dịch A. Lấy 10 ml dung dịch A cho phản ứng với 1 lượng dư dung dịch AgNO3 thu 0,7175 gam ↓. Xác định công thức muối đã dùng. Dạng 6: Toán nồng độ: Câu 44: Cho 2,35 gam oxit của 1 kim loại nhóm IA tác dụng hết với 47,65 gam nước được dd X. Để trung hoà dung dịch X thì cần 100 ml dung dịch HCl 0,5M. Xác định kim loại và tính nồng độ % của dd X Câu 45: Hoà tan m (g) 1 kim loại hoá trị 3 vào bình chứa 109,5 g dd HCl, phản ứng vừa đủ, sau phản ứng thu được 3,36 lít khí (đkc), đồng thời khối lượng bình cũng tăng lên 2,4g. Tính m(g) và xác định tên kim loại Tính C% của dung dịch axit và dung dịch muối tạo thành Câu 46: Hoà tan 18,4 gam hỗn hợp Al và Zn trong dung dịch HCl dư thu được 11,2 lít khí (đktc). Tính % khối lượng mỗi kim loại Câu 47: Hoà tan hoàn toàn 20g hỗn hợp Mg và Fe bằng dung dịch axit HCl dư, sau phản ứng thu được 11,2 lít khí (đktc) và dung dịch X. Cô cạn X thu được bao nhiêu gam muối khan? Câu 48: Cho 20g hỗn hợp Zn và Cu tác dụng với HCl dư thu được 4,48 lít H2 (đktc). Tính % khối lượng của mỗi kim loại Tính V dung dịch HCl 2M đã dùng biết lấy dư 25% so với lượng cần thiết. Câu 49: Hoà tan 23,8 (g) hợp kim Cu, Al và Fe dưới dạng bột vào 500 (g) dung dịch HCl có dư thu được 4,48 l khí (0oC, 2atm), dung dịch A và chất rắn cân nặng 12,8 (g) Tính phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu. Tính nồng độ phần trăm của dd HCl ban đầu, biết rằng lượng axit lấy dư 25% so với lý thuyết cần dùng. Tính C% của dung dịch A Câu 50: Hoà tan 25 g hh Bạc, Kẽm và Magiê vào 800 cm3 dung dịch HCl 2M có dư. Sau phản ứng thu được 6,5 g chất rắn không tan. Lượng axit dư có thể hoà tan được 16 g Đồng oxit. Tính phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu. Câu 51: Hoà tan 12,1 gam hỗn hợp 2 kim loại Fe và Zn trong 400 ml dung dịch HCl 1,5M thu được dung dịch A. Sau phản ứng thì cần 100 ml dung dịch Ba(OH)2 1M để trung hoà dung dịch A và thu được dung dịch B Tính hàm lượng của Fe có trong hỗn hợp Tính khối lượng muối thu được khi cô cạn dung dịch B Câu 52: Hoà tan 29,4 gam hỗn hợp Al, Cu, Mg vào 600 g dung dịch HCl 7,3% thu được 5,6 lít khí (0oC, 2 atm), dung dịch B và 19,2 gam chất không tan Tính khối lượng mỗi kim loại Cho dung dịch B tác dụng với AgNO3 dư. Tính khối lượng kết tủa tạo thành Câu 53: Hoà tan m(g) hỗn hợp Al và Mg vào dung dịch HCl 37% (d=1,19) thu được 7,84 lít khí (đktc) và 32,35 g hh muối khan Tính m Tính thể tích dung dịch HCl cần dùng Câu 54: Hoà tan hỗn hợp Sắt và Kẽm cần dùng 500ml dung dịch HCl 1M. Sau phản ứng thu được dd X, cô cạn dung dịch X thu được 33,55g muối khan. Tính phần trăm khối lượng mỗi kim loại trong hỗn hợp. Câu 55: Cho 6,4g hỗn hợp Ca và Mg vào 250cm3 dung dịch HCl 2M thì hỗn hợp hoà tan hoàn toàn. Biết rằng lượng axit dư 20% Tính % mỗi kim loại trong hỗn hợp ban đầu Tính CM của dung dịch sau phản ứng Tính thể tích khí thoát ra sau phản ứng Dạng 7: Toán tỉ khối: Câu 56: Hoà tan m gam hỗn hợp Fe và FeS trong dung dịch HCl dư thu được 8,96 lít hỗn hợp khí X (đktc) có tỉ khối hơi so với H2 là 5. Tính m Trộn 8,96 lít hỗn hợp X với V lít N2 ta thu được hỗn hợp khí Y có tỉ khối với H2 = 8. Tính V (các khí đo ở điều kiện tiêu chuẩn) Câu 57: Cho 14g hh Ca và CaCO3 vào 200cm3 dung dịch HCl thì phản ứng xảy ra vừa đủ thu được hỗn hợp khí X và dung dịch Y. Dung dịch Y đem cô cạn thì thu được 43,8g muối CaCl2.6H2O. Tính %m mỗi chất trong hỗn hợp ban đầu Tính tỉ khối của hỗn hợp X so với hidro Tính nồng độ dung dịch HCl ban đầu Dạng 8: Toán tổng hợp: Câu 58: Cho 20g hỗn hợp X gồm Al, Cu, Mg phản ứng với HCl dư tạo ra 11,2 lít khí (đkc) và 9,8 g chất rắn C Tính %m mỗi kim loại trong hỗn hợp đầu Tính khối lượng dung dịch HCl 27% đã dùng, biết lấy dư 25% so với lý thuyết. Nếu lấy hỗn hợp X phản ứng với Cl2 thì cần bao nhiêu thể tích khí Cl2 đo ở 27oC; 1,5 atm Câu 59: Cho 12 (g) hh A gồm Fe và Cu tác dụng với dd HCl dư thu được 0,2 (g) khí B Tính thành phần phần trăm khối lượng từng chất trong hh A Tổng hợp toàn bộ khí B sinh ra với 1,12 (l) khí Cl2 (ở đkc), cho sản phẩm sinh ra vào 46,715(g) nước thu được dd có nồng độ 6,75%. Tính hiệu suất của phản ứng. Câu 60: Hoà tan 7,8g hỗn hợp Al và Mg bằng dung dịch HCl dư. Sau phản ứng, khối lượng dung dịch axit tăng thêm 7g. Xác định khối lượng mỗi kim loại trong hỗn hợp ban đầu Câu 61: Hoà tan hoàn toàn hỗn hợp A gồm Zn, ZnO phải dùng hết 336 ml dung dịch HCl 3,65% thu được dung dịch B và 2,24 lít khí thoát ra ở đktc. Cho toàn bộ dung dịch B tác dụng với dung dịch AgNO3 dư được 57,4 gam kết tủa Tính phần trăm khối lượng mỗi chất trong hỗn hợp A Tính khối lượng riêng của dung dịch HCl đã dùng Câu 62: Cho 9,2g hh CuO và Mg phản ứng vừa đủ với 500ml dung dịch HBr 0,6M. Tính %m mỗi chất trong hỗn hợp ban đầu. Câu 63: Cho 3,72g hỗn hợp Nhôm và Nhôm oxit tác dụng với 131,4g dung dịch HCl (d=1,04) thì vừa đủ thu được 3,36 lít khí (đkc) Tính khối lượng mỗi chất trong hỗn hợp Tính nồng độ phần trăm và nồng độ mol/lít của dung dịch HCl ban đầu và dung dịch muối thu được Câu 64: Điện phân 500ml dung dịch NaCl 1M có màng ngăn (hiệu suất phản ứng điện phân đạt 80%). Cho khí Cl2 sinh ra tác dụng với 11,2 gam Fe. Tính khối lượng muối tạo thành Câu 65: Dung dịch A có chứa đồng thời 2 axit là HCl và H2SO4. Để trung hoà 40 ml dung dịch A thì cần 60 ml dung dịch NaOH 1M. Cô cạn dung dịch thu được 3,76 gam muối khan. Tính nồng độ mol của các axit trong dung dịch A Câu 66: Một hỗn hợp gồm NaCl và KCl có khối lượng 45,53 gam. Đun nóng hỗn hợp này với H2SO4 đ nóng dư thu được 1 chất khí. Hoà tan khí này vào nước thu được dung dịch A. Dung dịch A tác dụng với Zn thì được 0,74 gam H2 . Tính khối lượng mỗi muối trong hỗn hợp ban đầu. Câu 67: Hỗn hợp khí A gồm Cl2 và O2. A phản ứng vừa hết với 1 hh gồm 4,8 gam Mg và 8,1 gam Al tạo ra 37,08 gam hh các muối clorua và oxit của 2 kim loại. Xác định thành phần % theo khối lượng và theo thể tích của hỗn hợp A. Câu 68: 11,2 lít ở đkc hh khí A gồm Cl2 và O2 td vừa hết với 16,98 gam hh B gồm Mg và Al tạo ra 42,34 gam hh muối clorua và oxit của 2 kim loại Tính % theo thể tích từng chất trong A Tính % theo khối lượng từng chất trong B Dạng 9: Một số Halogen khác: Câu 69: Điều chế Br2 bằng cách cho H2SO4 tác dụng với hỗn hợp rắn KBr và MnO2 . Điều chế I2 bằng cách cho H2SO4 đ tác dụng với hỗn hợp rắn NaI và MnO2. Viết phương trình phản ứng và nêu vai trò của từng chất trong phản ứng Tính khối lượng mỗi chất cần dùng để điều chế 32g Br2 Câu 70: Trong việc sản xuất Brom từ các bromua có trong tự nhiên, để thu được 1 tấn Br2 phải dùng hết 0,6 tấn clo. Hỏi việc tiêu hao Cl2 như vậy vượt bao nhiêu % so với lượng cần dùng theo lý thuyết. Câu 71: Cần dùng bao nhiêu lít dung dịch NaBr với hàm lượng 40g/l và bao nhiêu lít khí Cl2 (đkc) để điều chế 3 lít Br2 lỏng (D=3,12kg/l). Câu 72: Chia dung dịch nước Br2 có màu vàng thành 2 phần. Dẫn khí A không màu đi qua phần 1 thì dung dịch mất màu. Dẫn khí B không màu đi qua phần 2 thì dung dịch sẫm màu hơn. Cho biết khí A, B có thể là chất gì? Câu 73: Hoà tan hoàn toàn hỗn hợp khí gồm HCl và HBr vào H2O thu được dung dịch chứa 2 axit với nồng độ % bằng nhau. Tính thành phần % theo thể tích của từng chất trong hỗn hợp khí ban đầu. Câu 74: Thêm 78ml dung dịch AgNO3 10% (D=1,09g/ml) vào một dung dịch chứa 3,88g hỗn hợp KBr và NaI, lọc bỏ kết tủa, nước lọc phản ứng vừa đủ với 13,3 ml dd HCl 1,5 mol/l. Xác định thành phần % khối lượng từng chất trong hỗn hợp muối ban đầu và tính thể tích HCl ở điều kiện chuẩn cần dùng để tao ra lượng HCl đã dùng. ĐỂ DOWNLOAD ĐẦY ĐỦ (FILE WORD) VÀO LINK:
Tài liệu đính kèm:
 DE_CUONG_HOA_LOP_10_HK2.doc
DE_CUONG_HOA_LOP_10_HK2.doc





