Giáo án Chương 1: Nguyên tử - môn hóa học
Bạn đang xem 20 trang mẫu của tài liệu "Giáo án Chương 1: Nguyên tử - môn hóa học", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
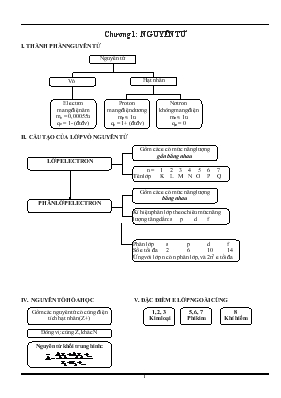
Chương 1: NGUYÊN TỬ I. THÀNH PHẦN NGUYÊN TỬ Hạt nhân Vỏ Nguyên tử Proton mang điện dương mp » 1u qe = 1+ (đtđv) Nơtron không mang điện mn » 1u qn = 0 Electron mang điện âm me = 0,00055u qe = 1- (đtđv) II. CẤU TẠO CỦA LỚP VỎ NGUYÊN TỬ Gồm các e có mức năng lượng bằng nhau Kí hiệu phân lớp theo chiều mức năng lượng tăng dần: s p d f PHÂN LỚP ELECTRON LỚP ELECTRON n = 1 2 3 4 5 6 7 Tên lớp K L M N O P Q Gồm các e có mức năng lượng gần bằng nhau Phân lớp s p d f Số e tối đa 2 6 10 14 Ứng với lớp n có n phân lớp, và 2n2 e tối đa IV. NGUYÊN TỐ HÓA HỌC V. ĐẶC ĐIỂM E LỚP NGOÀI CÙNG 8 Khí hiếm 5, 6, 7 Phi kim 1, 2, 3 Kim loại Gồm các nguyên tử có cùng điện tích hạt nhân (Z+) Đồng vị: cùng Z, khác N Nguyên tử khối trung bình: BÀI 1 THÀNH PHẦN NGUYÊN TỬ Câu 1Các hạt cấu tạo nên hạt nhân của hầu hết các nguyên tử gồm : A. Electron và proton B. Proton và notron C. Notron và electron D. Electron ,proton và notron. Câu 2Các hạt cấu tạo nên hầu hết các nguyên tử gồm : A. Electron và proton B. Proton và nơtron C. Nơtron và electron D. Electron ,proton và nơtron. Câu 3Nguyên tử luôn trung hoà điện nên A. tổng số hạt electron luôn bằng tổng số hạt proton B. tổng số hạt nơtron luôn bằng tổng số hạt electron C. tổng số hạt nơtron luôn bằng tổng số hạt proton C. tổng số hạt nơtron và proton luôn bằng tổng số hạt electron Câu 4Trong nguyên tử hạt mang điện tích gồm : A. chỉ có hạt proton. B. chỉ có hạt electron. C. Hạt nơtron và electron D. hạt electron và proton. Câu 5 Khối lượng của 1 electron bằng : A. 9,1094 . 10-31kg B. 1,6726 . 10-27kg C. 1,6748 . 10-27kg Câu 6 Điện tích của 1 proton bằng : A.+1,602 10-19C B. 0 C. -1,602 . 10-19c Câu 7 Điện tích của 1 electron bằng : A. +1,602 . 10-19c B. 0 C.-1,602 . 10-19c Câu 8 Điện tích của 1 nơtron bằng : A. +1,602 . 10-19c B. 0 C. -1,602 . 10-19c BÀI 2 : HẠT NHÂN NGUYÊN TỬ- NGUYÊN TỐ HÓA HỌC - ĐỒNG VỊ Câu 1Nguyên tử luôn trung hòa về điện nên A.Số hạt proton bằng số hạt electron B.Số hạt nơtron bằng số hạt electron C.Số hạt electron bằng số hạt proton D. Số hạt proton bằng số hạt eletron bằng bằng số hạt nơtron Câu 2Nếu hạt nhân nguyên tử có Z hạt proton thì A.Số đơn vị điện tích hạt nhân là Z+ B.Điện tích hạt nhân là Z C.Số hạt nơtron là Z D.Tổng số hạt mang điện trong nguyên tử là 2Z Câu 3 Kí hiệu nguyên tử biểu thị đầy đủ đặc trưng cho nguyên tử của một nguyên tố hóa học vì nó cho biết A.số hiệu nguyên tử Z B.Số khối A C.Số khối A và số hiệu nguyên tử Z D.Nguyên tử khối và nguyên tử gam của một nguyên tố Câu 4 Nguyên tử photpho có Z= 15, A = 31 nên nguyên tử photpho có A.15 hạt proton, 16 hạt electron, 31 hạt nơtron B.15 hạt electron, 31 hạt nơtron, 15 hạt proton C.15 hạt proton, 15 hạt electron, 16 hạt nơtron D.Khối lượng nguyên tử là 46u Câu 5Trong dãy kí hiệu các nguyên tử sau, dãy nào chỉ cùng một nguyên tố hóa học: A. 6A 14 ; 7B 15 B. 8C16; 8D 17; 8E 18 C. 26G56; 27F56 D. 10H20 ; 11I 22 Câu 6 Nguyên tử nào sau đây có 30 hạt mang điện dương A. B. C. D. Câu 7 Tổng số hạt proton, nơtron, electron có trong nguyên tử là: A. 123 B. 159 C. 65 D. 94 Câu 8 Cho các kí hiệu nguyên tử sau: . Chọn phát biểu đúng A.Nguyên tử Mg và Ca đều có số nơtron gấp đôi số proton B.Nguyên tử F có số đơn vị điện tích hạt nhân là 9+ C.Nguyên tử Li có số khối là 10 D. Nguyên tử Li và F có tổng số hạt không mang điện là 14 Câu 9 Nguyên tử nào trong các nguyên tử sau đây chứ đồng thời 20 nơtron, 19 proton và 19 electron A. B. C. D. Câu 10 Nguyên tử kali có kí hiệu là . Tìm phát biểu sai A.Nguyên tử có 38 hạt mang điện B.Nguyên tử có số khối là 40 C.Hạt nhân nguyên tử có 19 hạt D.Tổng số hạt các loại trong nguyên tử là 59 Câu 11 Số hiệu nguyên tử của một nguyên tố là 53. Nguyên tử đó có A.53 electron và 53 proton B.53 electron và 53 nơtron C.53 proton và 53 nơtron D.53 nơtron Câu 12 Kí hiệu có điện tích hạt nhân A) 35+ B) 40+ C) 80+ D) 55+ Câu 13 Một nguyên tử M có 75 electron và 110 nơtron. Kí hiệu của nguyên tử M là A. B. C. D. Câu 14 Nguyên tử của một nguyên tố có 19e và 20n. Kí hiệu của nguyên tử của nguyên tố A) B) C) D) Câu 15 Nguyên tử nào trong các nguyên tử dưới đây chứa đồng thời 20 nơtron, 19 proton và 19 electron A. B. C. D. Câu 16 Nguyên tử của nguyên tố có tổng số hạt proton, nơtron, elctron là 115. Số hạt mang điện nhiều hơn số hạt không mang điện là 25. Kí hiệu nguyên tử của nguyên tố đó A. B. C. D. Câu 17 Nguyên tử nguyên tố X cố tổng số hạt là 40. Số khối nhiều hơn số hạt mang điện là 1 hạt. Kí hiệu nguyên tử X A. B. C. D. Câu 18 Tổng số hạt proton ,electron, nơtron trong nguyên tử bằng 34 trong đó số hạt mang điện tích nhiều hơn số hạt không mang điện tích là 10 . Số nơtron trong nguyên tử A. 11 B.12 C.13 D. 34 Câu 19 Tổng số hạt proton ,electron, nơtron trong nguyên tử bằng 58 trong đó số hạt mang điện tích nhiều gấp 1.9 lần số hạt không mang điện tích .Số proton trong nguyên tử A. 18 B.19 C.20 D. 21 Câu 20 Nguyên tử X có tổng số hạt proton, nơtron, electron là 34. Biết số nơtron nhiều hơn số proton là 1. Số khối của X A. 11 B. 19 C. 21 D. 23 Câu 21Tổng số hạt proton, nơtron, electron của nguyên tử nguyên tố X là 10. Số khối của nguyên tử X A. 10 B. 6 C. 5 D. 7 Câu 22 Nguyên tử nguyên tố X có tổng số các hạt p,e,n bằng 58, số hạt prôton chênh lệch với hạt nơtron không quá 1 đơn vị. Số hiệu nguyên tử của X là: A. 17 B. 16 C. 19 D. 20 Câu 23 Tổng số hạt P , N ,E trong nguyên tử của nguyên tố là 16 . Nguyên tử khối của nguyên tố trên A. 5 B. 11 C.7 D. 10 Câu 24 Nguyên tử Beri có tổng số hạt proton, nơtron, electron là 13. Kí hiệu nguyên tử A. B. C. D. Câu 25 Câu nào sau đây sai ? A.Các đồng vị phải có số khối khác nhau B.Các đồng vị phải có số nơtron khác nhau C.Các đồng vị phải có cùng điện tích hạt nhân D.Các đồng vị phải có số electron khác nhau Câu 26 Có 3 nguyên tử sau: Chọn phát biểu sai A.Đó là 3 đồng vị của hiđro B.Nguyên tử chỉ là một hạt proton C.Tổng số hạt của 3 nguyên tử là 9 D. chỉ có trong nước nẳng rất hiếm gặp Câu 27 Đồng và oxi các các đồng vị sau: Số công thức có thể có của đồng (II) oxit A. 3 B. 4 C. 5 D. 6 Câu 28 Iridi có 2 đồng vị . Các đồng vị này A.Có cùng số proton B.Khác cấu hình electron C.Cùng số proton D.Có điện tích hạt nhân khác nhau Câu 29 Nguyên tố Mg có 3 đồng vị bền: (78,99%); (10,00%) v (11,01%). Nguyên tử khối trung bình của Mg A. 24,004 B. 24,3202 C. 24,011 D. 24,055 Câu 30 Liti trong tự nhiên có 2 đồng vị : ( 94% ) ; ( 6% ). Nguyên tử khối trung bình của liti A.9,64 B.6,94 C.3,18 D. 13 Câu 31 Oxi trong tự nhiên có 3 đồng vị : (99,757% ); (0,039% ); (0,204%). Nguyên tử khối trung bình A.16,24 B.32,42 C.15,96 D. 16.01 Câu 32 Cu có 2 đồng vị:& .Có nguyên tử khối trung bình là 63.54 . Thành phần % của từng đồng vị trong tự nhiên A. 63 % B.73 % C.27 % D.33 % Câu 33 R có 2 loại đồng vị là R1 và R2 . Tổng số hạt (p, n, e) trong R1 là 54 hạt.Số nơtron của R1 nhiều hơn R2 là 2 đơn vị. Biết R1 chiếm 25% và R2 chiếm 75%. Nguyên tử khối trung bình của R là: A.35 B. 36 C. 37 D. 35,5 Câu 34 Nguyên tử khối trung bình của nguyên tố R là 79,91. R có hai đồng vị. Biết 79zR chiếm 54,5%. Nguyên tử khối của đồng vị thứ 2 A. 80 B. 81 C. 82 D. 80,5 Câu 35 Nguyên tố X có 3 dồng vị là X1 chiếm 92,23 %, X2 chiếm 4,67 % và X3 chiếm 3,10 %. Tổng số khối của 3 đồng vị bằng 87. Số nơtron trong X2 nhiều hơn trong X1 một hạt. Nguyên tử khối trung bình của X là AX = 28,0855. Số khối của X1, X2, X3 lần lượt là: A. 28,29,30. B. 29,30,31 C. 29,30,28 Câu 36 Magiê có hai đồng vị là X và Y. Đồng vị X có nguyên tử khối là 24. Đồng vị Y hơn đồng vị X một nơtron. Biết rằng nguyên tử của hai đồng vị có tỉ lệ X : Y = 3 : 2. Nguyên tử khối trung bình của Mg là: A. 24 B. 24,4 C. 24,2 BÀI TẬP TỰ LUẬN CHỦ ĐỀ 1: TOÁN VỀ CÁC LOẠI HẠT TRONG NGUYÊN TỬ - Tổng số hạt S = P + E + N. Ta có P = E è S = 2P + N - Hạt mang điện: proton (P) và electron (E). - Hạt không mang điện: notron (N) - Số đơn vị điện tích hạt nhân = số proton = số electron=STT=Số HNT - Số khối A = Z + N - Từ nguyên tố thứ 2 đến 82 trong bảng tuần hoàn thì: S/3,5 ≤ Z ≤ S/3 Bài tập 1:Một nguyên tử R có tổng số hạt p, n, e là 115. Số hạt mang điện nhiều hơn số hạt không mang điện là 25 hạt. Xác định điện tích hạt nhân của R . Tên ngtử R ? Bài tập 2 : Tổng số hạt p, n, e trong nguyên tử X là 10. Tìm số khối của nguyên tử X. Bài tập 3:Xác định cấu tạo hạt (tìm số e, số p, số n), viết kí hiệu nguyên tử của các nguyên tử sau, biết: Tổng số hạt cơ bản là 13. Bài tập 4 : Cho biết tổng số hạt p, n, e trong nguyên tử của nguyên tố X là 52, trong đó số hạt không mang điện ít hơn số hạt mang điện là 16 hạt. Tìm số hiệu nguyên tử, nguyên tử khối của X. Viết cấu hình e từ đó xác định vị trí X trong BTH ? Bài tập 5 : Xác định số khối , số hiệu nguyên tử của 2 loại nguyên tử sau : a. Nguyên tử nguyên tố X câú tạo bởi 36 hạt cơ bản ( p,n,e) trong đó số hạt mang điện tích nhiều gấp đôi số hạt không mang điện tích. b. Nguyên tử nguyên tố Y có tổng các phần tử tạo nên là 155 , số hạt mang điện nhiều hơn số hạt không mang điện là 33 . Bài tập 6 : Kim loại A có hóa trị I, có tổng p, n, e là 34. Tìm kim loại A. Bài tập 7 : Hãy xác định: Số khối, số hiệu nguyên tử, số đơn vị điện tích hạt nhân, điện tích hạt nhân, số nơtron của từng nguyên tố. , , , , , , , , , , , , , , , , , , , , , Bài tập 8 :Tổng số hạt proton, nơtron, electron có trong một loại nguyên tử của ,nguyên tố Y là 54, trong đó tổng số hạt mang điện nhiều hơn số hạt không mang điện là 1,7 lần. Hãy xác định số hiệu nguyên tử, số khối và viết kí hiệu nguyên tử X. Bài tập 9 :Biết rằng tổng số các loại hạt (p, n, e) trong nguyên tử R là 40, trong đó hạt không mang điện kém hơn số hạt mang điện là 12. Xác định tên của nguyên tố R và viết kí hiệu nguyên tử R. Bài tập 10: Nguyên tử Y có tổng số hạt là 36. Số hạt không mang điện thì bằng một nửa hiệu số giữa tổng số hạt và số hạt mang điện tích âm. CHỦ ĐỀ 2: TOÁN VỀ ĐỒNG VỊ Nguyên tử khối trung bình : + Tính theo tỉ lệ % mỗi đồng vị: A, B là NTK của các đvị A, B a,b là tỉ lệ % số nguyên tử của đvị A,B + Tính theo tỉ lệ số nguyên tử của mỗi đồng vị: A, B là NTK của các đvị A, B a,b là tỉ lệ số nguyên tử của đvị A,B Bài tập 1 :Trong tự nhiên nguyên tố brôm có 2 đồng vị là 7935Br và 8135Br. Biết đồng vị 7935Br chiếm 54,5% số nguyên tử. Tìm khối lượng nguyên tử trung bình của Br. Bài tập 3 : Đồng trong tự nhiên gồm 2 đồng vị 6329Cu và 6529Cu. Nguyên tử khối trung bình của đồng là 63,54. Tính thành phần % số nguyên tử của mỗi đồng vị ? 12/ Brom có 2 đồng vị và , biết = 79,82 . Tính % của mỗi đồng vị. 13/ Kẽm có 2 đồng vị và , biết = 65,41 . Tính % của mỗi đồng vị. 14/ Antimon (Sb) có 2 đồng vị và , biết = 121,75 . Tính % của mỗi đồng vị. Tính nguyên tử khối trung bình của nguyên tố Magie, biết Magie có 3 đồng vị : 78,99% ; 10,00% ; 11,01% . 2/ Tính nguyên tử khối trung bình của nguyên tố Oxi, biết Oxi có 3 đồng vị : 99,757% ; 0,039% ; 0,204% . 3/ Tính nguyên tử khối trung bình của nguyên tố Clo, biết Clo có 2 đồng vị chiếm 75,53%; chiếm 24,47% . 4/ Tính nguyên tử khối trung bình của nguyên tố Kali, biết kali có 3 đồng vị : 93,26% ; 0,17% ; 6,57% . 10/ Ar có 3 đồng vị chiếm 0,34% , chiếm 0,06% và , biết = 39,98 . Tính số khối đồng vị thứ 3. 11/ Ag có 2 đồng vị chiếm 56% và , biết = 107,87 . Tính số khối đồng vị thứ 2. 9/ Cu có 2 đồng vị chiếm 73% và , biết = 63,64 . Tính số khối đồng vị thứ 2. 15/ Nguyên tử nguyên tố X có tổng số hạt là 82, biết số hạt mang điện nhiều hơn số hạt không mang điện là 22 hạt. Tính Z, A, viết kí hiệu nguyên tử. 16/ Nguyên tử nguyên tố X có tổng số hạt là 58, biết số hạt mang điện nhiều hơn số hạt không mang điện là 14 hạt. Tính Z, A, viết kí hiệu nguyên tử. 17/ Nguyên tử nguyên tố X có tổng số hạt là 48, biết số hạt mang điện nhiều hơn số hạt không mang điện là 16 hạt. Tính Z, A, viết kí hiệu nguyên tử. 18/ Nguyên tử nguyên tố X có tổng số hạt là 126, biết số nơtron nhiều hơn số electron là 12 hạt. Tính Z, A, viết kí hiệu nguyên tử. 19/ Nguyên tử nguyên tố X có tổng số hạt là 54, biết số nơtron nhiều hơn số electron là 3 hạt. Tính Z, A, viết kí hiệu nguyên tử. 20/ Nguyên tử nguyên tố X có tổng số hạt là 34, biết số nơtron nhiều hơn số proton là 1 hạt. Tính Z, A, viết kí hiệu nguyên tử. 21/ Nguyên tử nguyên tố X có tổng số hạt là 13. a/ Xác định nguyên tử khối. b/ Viết cấu hình electron . 22/ Nguyên tử nguyên tố X có tổng số hạt là 36. a/ Xác định nguyên tử khối. b/ Viết cấu hình electron . 23/ Nguyên tử nguyên tố X có tổng số hạt là 34. a/ Xác định nguyên tử khối. b/ Viết cấu hình electron . Bài tập 12. Trong tự nhiên oxi tồn tại 3 đồng vị bền : ; ; và hiđro có ba đồng vị bền là : , và . Hỏi có bao nhiêu phân tử nước được tạo thành . Bài tập 2 : Đồng trong tự nhiên gồm 2 đồng vị 6329Cu và 6529Cu với tỉ lệ số nguyên tử tương ứng là 105 :245. Tính khối lượng nguyên tử trung bình của đồng. Bài tập 4 : Nguyên tử khối trung bình của B là 10,81. B có 2 đồng vị 105B và 115B. Hỏi có bao nhiêu % 115B trong axit boric H3BO3 . Cho MH3BO3 = 61,84. Bài tập 5: Đồng có 2 đồng vị và . Nguyên tử khối trung bình của đồng là 63,54. Tìm tỉ lệ khối lượng của trong CuCl2 . Bài tập 6: Clo có hai đồng vị là . Tỉ lệ số nguyên tử của hai đồng vị này là 3 : 1. Tính nguyên tử lượng trung bình của Clo Bài tập 7: Brom có hai đồng vị, trong đó đồng vị 79Br chiếm 54,5%. Xác định đồng vị còn lại, biết . Bài tập 8: Trong tự nhiên đồng vị 37Cl chiếm 24,23,% số nguyên tử clo.Tính thành phần phần trăm về khối lượng 37Cl có trong HClO4 ( với hidro là đồng vị 1H, oxi là đồng vị 16O). Cho khối lượng nguyên tử trung bình của Clo là 35,5. Bài tập 9: Trong tự nhiên Clo có 2 đồng vị là 35Cl và 37Cl có nguyên tử khối trung bình là 35,5. Tính số nguyên tử của đồng vị 37Cl, trong 3,65g HCl. Bài tập 10:. Trong tự nhiên Brom có 2 đồng vị là 79Br và 81Br có nguyên tử khối trung bình là 79,92. Thành phần phần trăm về khối lượng của 81Br trong NaBr là bao nhiêu. Bài tập 11. Cho một dung dịch chứa 8,19 gam muối NaX tác dụng một lượng dư dung dịch AgNO3 thu được 20,09 gam kết tủa . 6/ Tính nguyên tử khối trung bình của nguyên tố Mg. Biết Mg có 3 đồng vị. Trong 5000 nguyên tử Mg có 3930 đồng vị ; 505 đồng vị ; còn lại là đồng vị . 7/ Tính nguyên tử khối trung bình của nguyên tố Bo, biết Bo có 2 đồng vị có 47 nguyên tử; có 203 nguyên tử. 8/ Một nguyên tố X có 2 đồng vị có số nguyên tử tỉ lệ với nhau là 31:19. Đồng vị 1 có 51 proton, 70 nơtron. Đồng vị 2 hơn đồng vị 1 là 2 nơtron. Tính nguyên tử khối trung bình. 9/ Một nguyên tố Y có 2 đồng vị. Đồng vị 1 có 35 proton, 44 nơtron chiếm 54,5%. Đồng vị 2 hơn đồng vị 1 là 2 nơtron. Tính nguyên tử khối trung bình. Bài 4 CẤU TẠO VỎ NGUYÊN TỬ Câu 1 Lớp M ( n = 3 ) thì có bao nhiêu phân lớp A. 3 B. 5 C. 8 D.2 Câu 2 Lớp thứ n = 2, 4, 6 có kí hiệu A. L , N , P B. K, L, M C. L . M. O D. M , P , Q Câu 3 Số electron tối đa lớp O (n = 5) l A. 25 B. 30 C. 45 D. 50 Câu 4 Ở phân lớp 3d số e tối đa là: A. 6 B. 18 C. 10 D. 14 Câu 5 Số e tối đa trong phân lớp p A. 2 B. 6 C. 10 D. 14 Câu 6 Số electron có trong nguyên tử Clo (Z = 17) là: A. 35 B. 18 C. 10 D. 14 Câu 7 Số đơn vị ĐTHN của nguyên tử flo là 9 .Trong nguyên tử flo,số e ở phân mức NL cao nhất là: A. 2 B. 5 C. 8 D.9 Câu 8 Các e của nguyên tử nguyên tố X được phân bố trên 3 lớp, lớp thứ 3 có 6e .Số đơn vị ĐTHN nguyên tử của nguyên tố X là: A.6 B.8 C.14 D.16 Câu 9 Kí hiệu nào trong số các kí hiệu của các phân lớp sau là sai? A. 4s, 4f B. 2d, 3f C. 2p, 3d D. 1s, 2p Câu 10 Một nguyên tử có tổng cộng 7e ở phân lớp p. Số proton trong hạt nhân của nguyên tử đó là: A. 10 B. 11 C. 12 D. 13 Câu 11 Nguyên tử cuả nguyên tố X có tổng số electron trong các phân lớp p là 7. Nguyên tử của nguyên tố Y có tổng số hạt mang điện nhiều hơn tổng số hạt mang điện của X là 8. X và Y là các nguy ên tố: A. Al và Br B. Mg và Cl C. Al và Cl D. Si và Br Câu 12 Các e của nguyên tử nguyên tố Y được phân bố trên 4 lớp, lớp thứ 4 có 6e .Số đơn vị ĐTHN nguyên tử của nguyên tố Y là: A.28 B.34 C.52 D.16 Câu 13 Các e của nguyên tử nguyên tố Z được phân bố trên 4 lớp, lớp thứ 4 có 2e .Số đơn vị ĐTHN nguyên tử của nguyên tố Z là: A.28 B.20 C.22 D.18 Bài 5 CẤU HÌNH ELECTRON CỦA NGUYÊN TỬ Câu 1 Nguyên tố có số hiệu nguyên tử bằng 13 thì cấu hình e A 1s 2s 2p 3s 3p B.1s 2s2p3s3pC.1s 2s 2p D. 1s 2s 2p 3s 3p Câu 2 Có kí hiệu K có cấu hình e là: A. 1s 2s2p 3s 3p 3d B.1s 2s2p 3s 3p 4s C.1s 2s2p 3s 3p 4s D.1s 2s2p 3s 3p Câu 3 Nguyên tố có cấu hình e 1s 2s2p 3s 3p nguyên tố đó là : A.He B. Ne C. Ar D. Ca Câu 4 Nguyên tố có cấu hình e 1s 2s2p là nguyên tố : A. s B. p C.d D. f Câu 5 Cấu hình e nào là của nguyên tố s A. 1s 2s2p B. 1s 2s2p 3s 3p C.1s 2s2p 3s 3p4s Câu 6 Nguyên tố X có STT = 8 . Có cấu hình e là : A. 1s22s22p3 B. 1s12s22p5 C. 1s22s12p5 D. 1s22s22p4 Câu 7 Nguyên tố có phân lớp e lớp ngoài cùng 3s nguyên tố đó có cấu hình e đầy đủ là : A. 1s 2s2p 3s B. 1s 2p 3s C. 1s 2s2p 3s D. 2s2p 3s Câu 8 Có kí hiệu Ca có cấu hình lớp e ngoài cùng như sau : A. 3p B.4s C.4s D.3d Câu 9 Các nguyên tố kim loại có số e lớp ngoài cùng : A.4 B. 5, 6 ,7 C. 8 D. 1, 2 ,3 . Câu 10 Các nguyên tố phi kim có số e lớp e ngoài cùng : A. 4 B. 8 C. 5, 6, 7 D. 1, 2, 3. Câu 11 Các nguyên tố sau nguyên tố nào khí hiếm : A. Li , Na , K B. He , Ar , Ne C. O , S , Cl Câu 12 Các nguyên tố sau nguyên tố nào phi kim : A. Li , Na , K B. He , Ar , Ne C. O , S , Cl Câu 13 Nguyên tố có cấu hình e 1s 2s2p 3s 3p .Nguyên tố là A.Kim loại B.phi kim C. khí hiếm Câu 14 Tổng số hạt p , n , e trong nguyên tử của 1 nguyên tố là 34 . Cấu hình e nguyên tử của nguyên tố A.1s 2s 2p B.1s 2s 2p 3s C.1s 2s 2p 3s D.1s 2s 2p 3s 3p Câu 15 Tổng số hạt p , n ,e trong nguyên tử của nguyên tố là 40, trong đó tổng số hạt mang điện tich nhiều hơn số hạt không mang điện tích là 12 . Số hiệu nguyên tử của nguyên tố là : A. 12 B. 40 C. 13 D. 15 Câu 16 1s 2s2plà cấu hình e nguyên tử của: A. B B. C C. N D. Al Câu 17 1s 2s2p 3s 3p là cấu hình e nguyên tử của: A.Na B. Al C. Si D. Cl Câu 18 1s 2s2p 3s 3p4s là cấu hình e nguyên tử của: A.Cl B. Ar C.K D. Ca Câu 19 Nguyên tố có phân lớp e ngoài cùng là 2p . Nguyên tố đó có số hiệu nguyên tử là : A. 7 B. 9 C. 18 D. 10 Câu 20 Electron cuối cùng của một nguyên tố M điền vào phân lớp 3d3. Số electron hóa trị của M là A. 3 B. 2 C. 5 D.4 Câu 21 Nguyên tử nguyên tố X có e cuối cùng điền vào phân lớp 3p1. Nguyên tử nguyên tố Y có e cuối cùng điền vào phân lớp 3p3. Số proton của X, Y lần lượt là: A. 13 và 15 B. 12 và 14 C. 13 và 14 D. 12 và 15 Câu 22 Electron cuối cùng của nguyên tử nguyên tố X phân bố vào phân lớp 3d 6. X A. Zn B. Fe C. Ni D. S Câu 23 Một nguyên tử X có 3 lớp. Ở trạng thái cơ bản số electron tối đa trong lớp M A. 2 B. 8 C. 18 D. 32 Câu 24 Nguyên tố mà nguyên tử có phân lớp electron cuối cùng là 3p3. Tên nguyên tố trên A. Photpho B. Natri C. Nitơ D. Clo Câu 25 Ion có 18 electron và 16 proton, mang số điện tích nguyên tố là: A. 18+ B. 2- C. 18- D. 2+ Câu 26 Nguyên tử hay ion nào sau đây có số proton nhiều hơn số electron? A. Nguyên tử Na B. Ion Ca2+ C. Nguyên tử S D. Ion Cl- BÀI TẬP TỰ LUẬN Bài tập 1 : Hãy viết cấu hình e của nguyên tử trong các trường hợp sau : a. Có tổng số e trong phân lớp p là 7. b. Có tổng số e trong phân lớp p là 5 c. Là nguyên tố p, có 4 lớp, 3 e lớp ngoài cùng. d. Là nguyên tố d, có 4 lớp,1 e lớp ngoài cùng.e. e. Là nguyên tố s, có 4 lớp, 1 e lớp ngoài cùng. f.Nguyên tử X có 3 lớp e, lớp e ngoài cùng có 5 e g.Nguyên tử Z có số e ở phân lớp d bằng phân nửa số e ở phân lớp 4s Bài tập 2 : Viết cấu hình e và xác định tên nguyên tố trong các trường hợp sau: H (H=1), Li (Z=3), Na (Z=11) He (Z=2), Ne (Z=10), Ar (Z=18) F (Z=9), Cl (Z=17), Br (Z=35) O (Z=8), S (Z=16), P (Z=15), N (Z=7), C (Z=6), Si (Z=14) Al (Z=13), Mg (Z=12), Na (Z=11), Ca (Z=20), K (Z=19), Li (Z=3) Be (Z=4), B (Z=5) Bài tập 3 : Phân lớp cuối cùng của các nguyên tử có cấu hình
Tài liệu đính kèm:
 dung_xemban_se_bi_me_hoac.doc
dung_xemban_se_bi_me_hoac.doc





