Đề thi thử THPT Quốc gia lần 4 môn Hóa học - Năm học 2016-2017 - Trường THPT chuyên Khoa học Tự nhiên (Có đáp án)
Bạn đang xem tài liệu "Đề thi thử THPT Quốc gia lần 4 môn Hóa học - Năm học 2016-2017 - Trường THPT chuyên Khoa học Tự nhiên (Có đáp án)", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
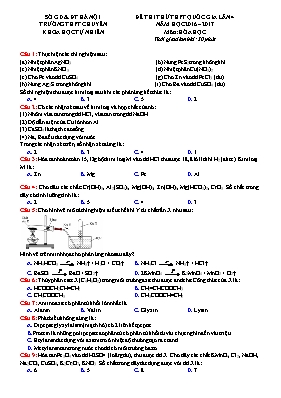
SỞ GD & ĐT HÀ NỘI TRƯỜNG THPT CHUYÊN KHOA HỌC TỰ NHIÊN ĐỀ THI THỬ THPT QUỐC GIA LẦN 4 NĂM HỌC 2016 – 2017 Môn: HÓA HỌC Thời gian làm bài: 50 phút Câu 1: Thực hiện các thí nghiệm sau: (a) Nhiệt phân AgNO3 (b) Nung FeS2 trong không khí (c) Nhiệt phân KNO3 (d) Nhiệt phân Cu(NO3)2 (e) Cho Fe vào dd CuSO4 (g) Cho Zn vào dd FeCl3 (dư) (h) Nung Ag2S trong không khí (i) Cho Ba vào dd CuSO4 (dư) Số thí nghiệm thu được kim loại sau khi các phản ứng kết thúc là: A. 4 B. 3 C. 5 D. 2 Câu 2: Có các nhận xét sau về kim loại và hợp chất của nó: (1) Nhôm vừa tan trong dd HCl, vừa tan trong dd NaOH (2) Độ dẫn điện của Cu lớn hơn Al (3) CaSO4 là thạch cao sống. (4) Na, Ba đều tác dụng với nước. Trong các nhận xét trên, số nhận xét đúng là: A. 2 B. 3 C. 4 D. 1 Câu 3: Hòa tan hoàn toàn 15,12g bột kim loại M vào dd HCl thu được 18,816 lít khí H2 (đktc). Kim loại M là: A. Zn B. Mg C. Fe D. Al Câu 4: Cho dãu các chất: Cr(OH)3, Al2(SO4)3, Mg(OH)2, Zn(OH)2, Mg(HCO3)2, CrO3. Số chất trong dãy có tính lưỡng tính là: A. 2 B. 5 C. 4 D. 3 Câu 5: Cho hình vẽ mô tả thí nghiệm điều chế khí Y từ chất rắn X như sau: Hình vẽ trên minh họa cho phản ứng nào sau đây? A. NH4HCO3 NH3↑ + H2O + CO2↑ B. NH4Cl NH3↑ + HCl↑ C. BaSO3 BaO + SO2↑ D. 2KMnO4 K2MnO4 + MnO2 + O2↑ Câu 6: Thủy phân este X (C4H6O2) trong môi trường axit thu được andehit. Công thức của X là: A. HCOOCH2CH=CH2 B. CH2=CHCOOCH3 C. CH3COOCH3 D. CH3COOCH=CH2 Câu 7: Amino axit có phân tử khối lớn nhất là A. Alanin B. Valin C. Glyxin D. Lysin Câu 8: Phát biểu không đúng là: A. Đipeptit glyxylalanin (mạch hở) có 2 liên kết peptit. B. Protein là những polipeptit cao phân tử có phân tử khối từ vài chục nghìn đến vài triệu. C. Etylamin tác dụng với axit nitro ở nhiệt độ thường tạo ra etanol. D. Metylamin tan trong nước cho dd có môi trường bazo. Câu 9: Hòa tan Fe3O4 vào dd H2SO4 (loãng dư), thu được dd X. Cho dãy các chất KMnO4, Cl2, NaOH, Na2CO3, CuSO4, K2Cr2O7, KNO3. Số chất trong dãy tác dụng được với dd X là: A. 6 B. 5 C. 8 D. 7 Câu 10: Phát biểu nào sau đây là sai? A. Chất béo còn được gọi là triglixerit hoặc triaxyl glixerol. B. Poli(metyl metacrylat) được dùng điều chế thủy tinh hữu cơ. C. Cao su buna – N thuộc loại cao su thiên nhiên. D. Lực bazo của anilin yếu hơn lực bazo của metyl amin. Câu 11: Cho hỗn hợp gồm Fe(NO3)2 và Al2O3 vào dung dịch H2SO4 (loãng, dư) thu được dung dịch X. Cho dung dịch KOH dư vào X(không có không khí) thu được kết tủa Y. Kết tủa Y có A. Fe(OH)2. B. Fe(OH)2 và Al(OH)3.C. Fe(OH)3 và Al(OH)3. D. Fe(OH)3. Câu 12: Tiến hành bốn thí nghiệm sau: - Thí nghiệm 1: Nhúng thanh Fe vào dd FeCl3 - Thí nghiệm 2: Nhúng thanh Fe vào dd CuSO4 - Thí nghiệm 3: Nhúng thanh Cu vào dd FeCl3 - Thí nghiệm 4: Quấn sợi dây Cu vào thanh Fe rồi nhúng vào dd HCl. Số trường hợp xuất hiện ăn mòn điện hóa là: A. 1 B. 4 C. 2 D. 3 Câu 13: Thực hiện các thí nghiệm sau ở điều kiện thường (a) Cho đồng kim loại vào dd sắt (III) clorua (b) Sục khí hidro sunfua vào dd đồng (II) sufat (c) Cho dd bạc nitrat vào dd sắt (III) clorua (d) Cho bột lưu huỳnh vào thủy ngân Số thí nghiệm xảy ra phản ứng là: A. 2 B. 3 C. 1 D. 4 Câu 14: Dãy các ion xếp theo chiều giảm dần tính oxi hóa A. Ag+, Fe3+, Cu2+, Fe2+ B. Ag+, Cu2+, Fe3+, Fe2+ C. Fe3+, Ag+, Cu2+, Fe2+ D. Fe3+, Cu2+, Ag+, Fe2+ Câu 15: Nguyên tắc luyện thép từ gang là: A. Dùng chất khử CO khử oxit sắt thành sắt ở nhiệt độ cao. B. Tăng thêm hàm lượng cacbon trong gang để thu được thép. C. Dùng O2 oxi hóa các tạp chất Si, P, S, Mn, trong gang để thu được thép. D. Dùng CaO hoặc CaCO3 để khử tạp chất Si, P, S, Mn, trong gang để thu được thép. Câu 16: Khí chủ yếu gây mưa axit là A. CO và CH4. B. H2S và NH3. C. SO2 và NO2. D. CH4 và CO2. Câu 17: Phát biểu nào sâu đây sai là A. Tinh bột là lương thực của con người B. Khi cho giấm ăn (hoặc chanh) vào sữa bò hoặc sữa đậu nành thì có kết tủa xuất hiện. C. Xenlulozơ và tinh bột có phân tử khối bằng nhau. D. Thành phần chính của sợi bông, gỗ, nứa là xenlulozơ Câu 18: Dung dịch X chứa hh gồm Na2CO3 1,5M và KHCO3 1M. Nhỏ từ từ từng giọt đến 200ml dd HCl 1M vào 100ml dd X sinh ra V lít khí ở đktc. Giá trị của V là: A. 1,12 B. 4,48 C. 3,36 D. 2,24 Câu 19: Nung nóng từng cặp chất sau trong bình kín: (1) Fe + S(r); (2) Fe2O3 + CO(k); (3) Au + O2(k), (4) Cu + Cu(NO3)2 (r), (5) Cu + KNO3 (r); (6) Al + NaCl (r). Các trường hợp xảy ra phản ứng oxi hóa kim loại A. (2), (5), (6) B. (1), (4), (5) C. (2), (3), (4) D. (1), (3), (6) Câu 20: Cặp chất không xảy ra phản ứng hóa học là: A. Fe + dd FeCl3 B. Cu + dd FeCl2 C. Cu + dd FeCl3 D. Fe + dd HCl Câu 21: Để thu được Al2O3 từ hỗn hợp Al2O3 và Fe2O3, người ta lần lượt: A. Dùng dd NaOH dư, dd HCl dư rồi nung nóng. B. Dùng khí H2 ở nhiệt độ cao, dd NaOH dư. C. Dùng dd NaOH dư, khí CO2 dư rồi nung nóng. D. Dùng khí CO ở nhiệt độ cao, dd HCl dư Câu 22: Hòa tan hoàn toàn 6,645g hh muối clorua của 2 kim loại kiềm thuộc 2 chu kì kết tiếp nhau vào nước thu được dd X. Cho toàn bộ dd X phản ứng vời với AgNO3 dư thu dược 18,655g kết tủa. Hai kim loại kiềm trên là: A. K và Rb B. Li và Na C. Na và K D. Rb và Cs Câu 23: Cho dãu các kim loại: Cu, Ni, Zn, Mg, Ba, Ag. Số kim loại trong dãy phản ứng được với dd FeCl3 là A. 4 B. 6 C. 5 D. 3 Câu 24: Một loại nước cứng chứa các ion: Ca2+, Mg2+ và HCO3-. Hóa chất được dùng để làm mềm nước cứng trên là A. H2SO4 B. NaCl C. HCl D. Ca(OH)2 Câu 25: Số amin bậc 1 có công thức phân tử C3H9N là: A. 1 B. 2 C. 4 D. 3 Câu 26: Bradukinin có tác dung làm giảm huyết áp. Đó là một nonapeptit có công thức là: Arg – Pro – pro- gly – phe – ser – pro – phe – arg Khi thủy phân không hoàn toàn có thể thu được bao nhiêu tripeptit có chứa gốc Pro A. 6 B. 3 C. 5 D. 4 Câu 27: Kim loại có độ cứng lớn nhất là A. Ti B. Cr C. W D. Fe Câu 28: Cho các phát biểu sau về cacbohidrat (a) Glucozo và saccarozo đều là chất rắn có vị ngọt, dễ tan trong nước (b) Tinh bột và xenlulozo đều là polisaccarit (c)Trong dd glucozo và saccaroxo đều hoàn tan Cu(OH)2, tạo phức màu xanh (d)Khi thủy phân hoàn toàn hh gồm tinh bột và saccarozo trong môi trường axit chủ thu được 1 loại monosaccarit duy nhất (e)Khi đun nóng glucozo (hoặc fructozo) với dd AgNO3 trong NH3 thu được Ag (g) Glucozo và saccarozo đều tác dụng với H2 (xúc tác Ni, đun nóng) tạo sobitol Số phát biểu đúng là: A. 6 B. 5 C. 4 D. 3 Câu 29: Phát biểu nào dưới đây đúng: A. Trong phản ứng este hóa giữa CH3COOH với CH3OH, H2O được tạo nên từ nhóm –OH trong nhóm –COOH của axit và H trong nhóm OH của ancol. B. Phản ứng tráng gương dùng để phân biệt glucozo và fructozo. C. Tất cả các este đều tan tốt trong nước, không độc, được dùng làm chất tạo hương trong công nghiệp thực phẩm, mỹ phẩm. D. Phản ứng giữa axit axetic với ancol benzylic (ở điều kiện thích hợp), tạo thành benzyl axetat có mùi thơm của chuối chín. Câu 30: Hòa tan hoàn toàn 20,88 g một oxit sắt bằng dd H2SO4 đặc nóng, thu được dd X và 3,248 lít khí SO2 (sp khử duy nhất, đktc). Cô cạn dd X thu được m gam muối sunfat khan. Giá trị của m là: A. 58,0 B. 52,2 C. 48,4 D. 54,0 Câu 31: Cho 42,4 g hh gồm Cu và Fe3O4 (có tỉ lệ số mol tương ứng là 3:1) tác dụng với dd HCl dư, sau khi các phản ứng xảy ra hoàn toàn còn lại m gam chất rắn. Giá trị của m là: A. 6,4 B. 9,6 C. 12,8 D. 19,2 Câu 32: Cho 4,05 gam bột Al tác dụng với V lít O2 (đktc), thu được hỗn hợp rắn X. Cho X tác dụng với lượng dư dung dịch NaOH, sinh ra 1,68 lít H2 (đktc). Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của V là A. 3,36 B. 1,26 C. 1,68 D. 6,72 Câu 33: Hỗn hợp M gồm một este no, đơn chức, mạch hở và 2 amin no, đơn chức, mạch hở X và Y là đồng đẳng kế tiếp (MX < MY). Đốt cháy hoàn toàn một lượng M thu được N2, 7,56g nước và 5,376 lít CO2. Khối lượng phân tử chất X là: A. 59 B. 31 C. 45 D. 73 Câu 34: Điện phân 150ml dd AgNO3 1M với điện cực trơ trong t phút, cường độ dòng điện không đổi 2,68A (hiệu suất quá trình điện phân là 100%), thu được chất rắn X, dd Y và khí X. Cho 12,6g Fe vào Y, sau khi các phản ứng kết thúc thu được 14,5g hh kim loại và khí NO (sp khử duy nhất của N+5), Giá trị của t là: A. 60 B. 48 C. 18 D. 30 Câu 35: Hòa tan hoàn toàn 0,02 mol Fe và 0,01 mol Cu vào 200ml dd gồm HNO3 0,1M và HCl 0,4M thu được dd X. Cho dd AgNO3 dư vào X thì xuất hiện a g kết tủa. Biết ác phản ứng đều xảy ra hoàn toàn, sản phẩm khử của NO3- là khí NO duy nhất. Giá trị của a là: A. 13,64 B. 11,48 C. 2,16 D. 12,02 Câu 36: Cho 0,15 mol axit glutamic vào 200ml dd NaOH 2M, thu được dd X . Cho dd HCl dư vào X. Sau khi các phản ứng xảy ra hoàn toàn, số mol HCl đã phản ứng là: A. 0,5 mol B. 0,45 mol C. 0,30mol D. 0,55 mol Câu 37: Đun nóng 0,32 mol hh T gồm 2 peptit X (CxHyOzN6) và Y (CnHmO6Nt) cần dùng 900ml dd NaOH 2M, chỉ thu được dd chứa a mol muối của glyxyl và b mol muối của alanin. Mặt khác đốt cháy 61,46 g E trong O2 vừa đủ thu được hh CO2, H2O. N2 trong đó khối lượng của CO2 và nước là 138,62g. Giá trị a : b gần nhất với A. 0,730 B. 0,810 C. 0,756 D. 0,825 Câu 38: Cho 33,1g hh X gồm Fe3O4, Fe(NO3)2, Al tan hoàn toàn trong dd chứa 210,8g KHSO4 loãng. Sau khi ccs phản ứng xảy ra hoàn toàn thu được dd Y chỉ chứa 233,3g muối sunfat trung hòa và 5,04 lít hh khí Z trong đó có 1 khí hóa nâu ngoài không khí. Biết tỉ khối của Z so với H2 là 23/9. Phần trăm khối lượng của Al trong hh X là a%. a gần nhất với giá trị nào sau đây A. 30 B. 20 C. 25 D. 15 Câu 39: Đun nóng m g hh X gồm các chất có cùng một loại nhóm chức với 600ml dd NaOH 1,15M thu được dd Y chứa muối của một axit cacboxylic đơn chức và 15,4g hơi Z gồm các ancol. Cho toàn bộ Z tác dụng với Na dư thu được 5,04 lít khí H2. Cô cạn dd Y, nung nóng chất rắn thu được với CaO cho đến khi phản ứng xảy ra hoàn toàn thu được 7,2g một chất khí. Giá trị của m là: A. 22,60 B. 40,60 C. 34,30 D. 34,51 Câu 40: Hòa tan hoàn toàn 38,8g hh X gồm Fe và Cu trong dd chứa 2,4mol HNO3, sau khi các kim loại tan hết thu được dd Y (không chứa NH4+) và V lít khí (đktc) hh khí Z gồm 2 chất khí là NO2 và NO (trong đó số mol của khí này gấp đôi số mol khí kia). Cho 1000ml dd KOH 1,7M vào Y thu được kết tủa D và dd E. Nung D trong không khí đến khối lượng không đổi thu được 52g chất rắn F. Cô cạn cẩn thận E thu được chất rắn G. Nung G đến khôi lượng không đổi thu được 138,7 g chất rắn khan. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của V là A. 20,16 B. 22,4 C. 17,92 D. 11,20 Đáp án 1-B 2-C 3-D 4-A 5-D 6-D 7-D 8-A 9-A 10-C 11-A 12-C 13-D 14-A 15-C 16-B 17-A 18-A 19-B 20-B 21-C 22-B 23-C 24-D 25-B 26-A 27-B 28-C 29-A 30-A 31-C 32-B 33-B 34-A 35-D 36-D 37-A 38-D 39-B 40-A LỜI GIẢI CHI TIẾT Câu 1: Đáp án B Các phản ứng thu được kim loại a, e, h Câu 2: Đáp án C Nhận xét đúng 1, 2, 3, 4 Câu 3: Đáp án D nH2 = 0,8 mol M có hóa trị n => bảo toàn e ta có M = 9n => n = 3 và M = 27 Câu 4: Đáp án A Chất lưỡng tính: Cr(OH)3 và Zn (OH)2 Câu 5: Đáp án D Câu 6: Đáp án D Este thủy phân thu được andehit có dạng RCOOCH=CR’(R”) Câu 7: Đáp án D Câu 8: Đáp án A Câu 9: Đáp án A Câu 10: Đáp án C Câu 11: Đáp án A Câu 12: Đáp án C Các thí nghiệm 2, 4 Câu 13: Đáp án D Các thí nghiệm a, b, c, d Câu 14: Đáp án A Câu 15: Đáp án C Câu 16: Đáp án B Câu 17: Đáp án A Câu 18: Đáp án A Thứ tự phản ứng CO32- + H+ → HCO3- HCO3- + H+ → CO2 + H2O nH+ = 0,2 mol nCO32- = 0,15 mol nHCO3- = 0,1 mol => VCO2 = 22,4 (0,2 – 0,15) = 1,12 lít Câu 19: Đáp án B Câu 20: Đáp án B Câu 21: Đáp án C Câu 22: Đáp án B Gọi công thức chung của 2 muối là MCl nAgCl = 0,13 mol Ta có AgNO3 + MCl → AgCl + MNO3 nMCl = 0,13 mol MMCl = 51,12g/mol => M trung bình= 15,62g/mol => 2 kim loại là Na và Li Câu 23: Đáp án C Các kim loại thỏa mãn Cu, Ni, Zn, Mg, Ba Câu 24: Đáp án D Câu 25: Đáp án B Câu 26: Đáp án A Câu 27: Đáp án B Câu 28: Đáp án C Các phát biểu đúng a, b, c, e Câu 29: Đáp án A Câu 30: Đáp án A nSO2 = 0,145mol qui đổi oxit sắt thành hh gồm Fe và O có số mol lần lượt là x và y Bảo toàn e ta có 3x = 2y + 2 . 0,145 => 3x – 2y = 0,29 m oxit = 56x + 16y = 20,88 => x = 0,29 và y = 0,29 m = m muối Fe2(SO4)3 = ½ . 0,29. 400 = 58g Câu 31: Đáp án C nCu = 0,3 mol và n Fe3O4 = 0,1 mol Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O 0,1 0,2 2FeCl3 + Cu → 2FeCl2 + CuCl2 0,2 0,1 m = m Cu dư = 0,2 . 64 = 12,8g Câu 32: Đáp án B Sac → glu + fruc 0,04 . 75% 0,03 0,03 Man → 2glu 0,02.75% 0,03 Sau phản ứng dd chứa 0,06 mol glu, 0,03 mol fruc và 0,005mol man dư nAg = 2.(nGlu + nFruc + nMan dư) = 0,19 mol => mAg = 20,52g Câu 33: Đáp án B => n amin mol + Có nCO2 (đốt amin) < n CO2 = 0,24 mol => Số nguyên tử C trung bình của amin < 0,24/0,12 =2 => X phải là CH3NH2 có MX = 31 Câu 34: Đáp án A nAgNO3bđ = 0,15mol Ag+ + 1e → Ag 3Fe + 8H+ + 2NO3- →sp x ----> x ----> x 3x/8 <-- x 2H2O → 4H+ +4e + O2 Fe + 2Ag+ → Fe2+ + 2Ag x ---> x 0,15 – x m sau – m trước = m Ag – mFe phản ứng Có phút. Câu 35: Đáp án D nH+ dư = 0,02mol + Khi cho AgNO3 vào m = a = 12,02g Câu 36: Đáp án D nGlu = 0,15 mol nNaOH = 0,4 mol nHCl = nGlu + nNaOH = 0,55mol Câu 37: Đáp án A - Vì X, Y tạo từ các a.a có 1NH2 và 1 COOH => CT chung: +) mol X => 6x mol NaOH y mol Y => 7y mol NaO => nx : ny = 5 : 3 +) Trong 61,46g E gọi số mol X, Y là 5t và 3t Số mol CO2 là y, số mol H2O là z Vậy 61,46 g E có nE = 0,16 mol => 0,32 mol E nặng mE = 122,92g +) Khi cho E vào NaOH: BTKL: Câu 38: Đáp án D có khí H2 +) BTKL: +) Đặt => 1,55 = 4x + 2.0,525 + 2.0,2 => x = 0,025 mol (Bảo toàn Hidro) +) Đặt nFe3O4 = a Bảo toàn oxi: 4a + 0,025.6 = 0,525 + 0,025 => a = 0,1 mol => mAl = 33,1 – 0,1.232 – 180.0,025 = 5,4g => %mAl = 16,31% Câu 39: Đáp án B nNaOH = 0,69 mol nRCOONa = nNaOH phản ứng = 2nH2 = 0,45mol => nNaOH dư = 0,24mol RCOONa + NaOH → RH + Na2CO3 0,24 0,24 => MRH = 30 (C2H6) => C2H5COONa Bảo toàn khối lượng m + m NaOH pứ = m muối + m ancol => m = 40,6g Câu 40: Đáp án A Giả sử KOH dư x mol => 138,7 = mKOH dư + mKNO2 = 56x + 85 (1,7 - x) => x = 0,2 mol => nKOH phản ứng = 1,5mol mE = mFe2O3 + mCuO = 80a + 80b = 52 và mX = 56a + 56b = 38,8 => a = 0,35 và b = 0,3 => nHNO3 dư = nKOH + (3nFe + 2nCu) = 0,05 mol Bảo toàn nito nNO2 + nNO = nHNO3 – nKNO2 = 0,9 mol => V = 20,16 lít
Tài liệu đính kèm:
 de_thi_thu_thpt_quoc_gia_lan_4_mon_hoa_hoc_nam_hoc_2016_2017.doc
de_thi_thu_thpt_quoc_gia_lan_4_mon_hoa_hoc_nam_hoc_2016_2017.doc





