Đề thi thử THPT Quốc gia lần 1 môn Hóa học năm 2017 - Mã đề 01 - Trường THPT Bắc Yên Thành (Có đáp án)
Bạn đang xem tài liệu "Đề thi thử THPT Quốc gia lần 1 môn Hóa học năm 2017 - Mã đề 01 - Trường THPT Bắc Yên Thành (Có đáp án)", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
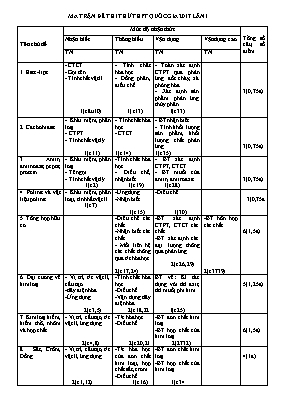
MA TRẬN ĐỀ THI THỬ THPT QUỐC GIA 2017 LẦN 1 Tên chủ đề Mức độ nhận thức Tổng số câu, số điểm Nhận biết Thông hiểu Vận dụng Vậndụng cao TN TN TN TN 1. Este-lipit - CTCT - Gọi tên - Tính chất vật lí 1(câu10) - Tính chất hóa học - Đồng phân, điều chế 1(c13) - Toán xác định CTPT qua phản ứng đốt cháy, xà phòng hóa - Xác định sản phẩm phản ứng thủy phân 1(c33) 3(0,75đ) 2. Cacbohiđrat - Khái niệm, phân loại - CTPT - Tính chất vật lý 1(c11) - Tính chất hóa học - CTCT 1(c14) - BT nhận biết - Tính khối lượng sản phẩm, khối lượng chất phản ứng 1(c35) 3(0,75đ) 3. Amin, aminoaxit, peptit, protein - Khái niệm, phân loại - Tên gọi - Tính chất vật lý 1(c2) -Tính chất hóa học - Điều chế, nhận biết 1(c19) - BT xác định CTPT, CTCT - BT muối của amin, amino axit 1(c28) 3(0,75đ) 4. Polime và vật liệu polime - Khái niệm, phân loại, tính hất vật lí 1(c7) -Ứng dụng -Nhận biết 1(c15) -Điều chế 1(30) 3(0,75đ 5. Tổng hợp hữu cơ -Điều chế các chất -Nhận biết các chất - Mối liên hệ các chất thông qua t/c hóa học 2(c17,24) -BT xác định CTPT, CTCT các chất -BT xác định các đại lượng thông qua phản ứng 2(c26,29) -BT hỗn hợp các chất 2(c3739) 6(1,5đ) 6. Đại cương về kim loại - Vị trí, t/c vật lí, cấu tạo -dãy điện hóa -Ứng dụng 2(c3,5) -Tính chất hóa học -Điều chế -Vận dụng dãy điện hóa 2(c18,22 BT về: Kl tác dụng với dd axit, dd muối, phi kim... 1(c25) 5(1,25đ) 7. Kim loại kiềm, kiềm thổ, nhôm và hợp chất - Vị trí, cấu tạo, t/c vật lí, ứng dụng 2(c4,8) -T/c hóa học -Điều chế 2(c20,21 -BT đơn chất kim loại -BT hợp chất của kim loại 2(2732) 6(1,5đ) 8. Sắt, Crôm, Đồng - Vị trí, cấu tạo, t/c vật lí, ứng dụng 2(c1,12) -T/c hóa học của đơn chất kim loại, hợp chất sắt, crom -Điều chế 1(c16) -BT đơn chất kim loại -BT hợp chất của kim loại 1(c34 4(1đ) 9. Hóa học môi trường Các hiện tượng, các chất hóa học ảnh hưởng đến môi trường -PP xử lí ô nhiểm MT 1(c6) 1(0,25đ) 10. Tổng hợp vô cơ - Vị trí, cấu tạo, t/c vật lí, ứng dụng 1(c9) -Nhận biết kim loại và hợp chất của kim loại -Mối quan hệ t/c hóa học các chất 1(c23) -Bài tập đơn chất KL, hỗn hợp kim loại 2(c31,36) -BT hợp chất kim loại, hỗn hợp các hợp chất của kim loại 2(c38,40) 6(1,5đ) Tổng số câu, số điểm 12(2,75đ) 12(3,25đ) 12(3,0đ) 4(1đ) 40(10đ) SỞ GD-ĐT NGHỆ AN TRƯỜNG THPT BẮC YÊN THÀNH ĐỀ THI THỬ THPT QG 2017 LẦN I Môn: Hoá học (KHTN). Thời gian làm bài 50 phút Mã đề: 01 Họ, tên thí sinh:. . . . . . . . . . . . . . . . .Số báo danh:. . . . . . . . . . . . . . Cho biết: H=1; Li=7; Be=9; C= 12; N= 14; O= 16; Na= 23; Mg= 24; Al= 27; P= 31; S= 32; Cl= 35,5; K= 39; Ca= 40; Cr= 52; Fe= 56; Cu= 64; Zn= 65; Br= 80, Ag= 108; Ba= 137. Câu 1: Tính chất vật lí nào sau đây của kim loại không do các electron tự do quyết định? A. tính dẫn điện. B. tính dẻo. C. khối lượng riêng. D. tính dẫn nhiệt. Câu 2: Công thức cấu tạo thu gọn của Glyxin (axit aminoaxetic) là A. CH3CH(NH2)COOH. B. H2NCH2COOH. C. HOOCCH2CH2CH(NH2)COOH. D. (CH3)2CHCH(NH2)COOH. Câu 3: Trong các kim loại: Al, Fe, Cu, Mg. Kim loại có tính khử mạnh nhất là A. Al. B. Fe. C. Mg. D. Cu. Câu 4: Phương pháp chung để điều chế các kim loại Na, Ca, Al trong công nghiệp là A. điện phân dung dịch. B. nhiệt luyện. C. thủy luyện. D. điện phân nóng chảy. Câu 5: Một mẫu nước cứng chứa các ion: Ca2+, Mg2+, HCO3-, Cl- và SO42-. Phương pháp làm mền mẫu nước cứng trên là A. đun sôi. B. dùng HCl. C. dùng Na2CO3. D. Dùng H2SO4. Câu 6: Nước thải công nghiệp thường chứa các ion kim loại nặng như Hg2+, Pb2+, Fe3+... Để xử lí sơ bộ nước thải trên, làm giảm nồng độ các ion kim loại nặng với chi phí thấp, người ta sử dụng chất nào sau đây? A. Ca(OH)2. B. NaCl. C. HCl. D. H2SO4. Câu 7: Tơ nào sau đây là tơ tổng hợp A. tơ tằm. B. tơ nilon-6,6. C. tơ axetat. D. tơ visco. Câu 8: Hòa tan hoàn toàn m gam kim loại Al bằng dung dịch NaOH dư, thu được dung dịch X và 3,36 lít khí H2 (đktc). Giá trị của m là A. 4,05. B. 5,4. C. 6,75. D. 2,7. Câu 9: Hòa tan hoàn toàn 1,4 gam Fe bằng dung dịch HNO3 (loãng) dư, thu được x mol khí NO (là sản phẩm khử duy nhất). Giá trị của x là A. 0,25. B. 0,10. C. 0,025. D. 0,15. Câu 10: Etyl propionat là một este có mùi dứa. Công thức cấu tạo của etyl propionat là A. CH3COOC2H5. B. C2H5COOC2H5. C. C2H5COOCH3. D. CH3COOCH 3. Câu 11: Cacbohiđrat nào sau đây thuộc loại đisaccarit? A. xenlulozơ. B. glucozơ. C. saccarozơ. D. amilozơ. Câu 12: Kim loại Fe không phản ứng với chất nào sau đây trong dung dịch? A. MgCl2. B. AgNO3. C. FeCl3. D. CuSO4. Câu 13: Thủy phân một triglixerit X bằng dung dịch NaOH, thu được hỗn hợp muối gồm natri oleat, natri stearat (có tỉ lệ mol tương ứng là 1 : 2) và glixerol. Có bao nhiêu triglixerit X thỏa mãn tính chất trên? A. 2. B. 1. C. 3. D. 4. Câu 14: Cho các phát biểu sau về cacbohiđrat: (a) Tất cả các cacbohiđrat đều có phản ứng thủy phân. (b) Thủy phân hoàn toàn tinh bột thu được glucozơ. (c) Glucozơ, fructozơ đều có phản ứng tráng bạc. (d) Glucozơ làm mất màu nước brom. Số phát biểu đúng là A. 1. B. 4. C. 3. D. 2. Câu 15: PVC là chất rắn vô định hình, cách điện tốt, bền với axit, được dùng làm vật liệu cách điện, ống dẫn nước, vải che mưa,... PVC được điều chế từ monome nào sau đây? A. CH2=CH2. B. CH2=CH-CH=CH2. C. C6H5CH=CH2. D. CH2=CHCl. Câu 16: Cho dãy các chất: Cu, CaCO3, Fe3O4, Fe(OH)3, Fe(NO3)2. Số chất trong dãy tác dụng được với dung dịch H2SO4 (loãng) là A. 2. B. 3. C. 4. D. 5. Câu 17: Cho các este : etyl fomat (1), vinyl axetat (2), triolein (3), metyl acrylat (4), phenyl axetat (5). Dãy gồm các este đều phản ứng được với dung dịch NaOH (đun nóng) sinh ra ancol là A. (1), (2), (3). B. (1), (3), (4). C. (2), (3), (5). D. (3), (4), (5). Câu 18: Cho 3,45 gam một kim loại kiềm M tác dụng hết với H2O thu được dung dịch chứa 6,0 gam chất tan và V lít khí H2 (đktc). Giá trị của V là A. 2,24. B. 3,36. C. 1,12. D. 1,68. Câu 19: Cho các nhận xét sau: (1) các peptit và protein đều có phản ứng màu biure với Cu(OH)2; (2) Các amin đều có tính bazơ mạnh hơn amoniac; (3) Các amin đều làm quỳ tím ẩm hóa xanh; (4) Amino axit là những hợp chất hữu cơ tạp chức; (5) Metyl amin là chất khí ở điều kiện thường. Các phát biểu đúng là A. (1); (2); (3) và (4). B. (4) và (5). C. (1); (3); (4) và (5). D. (3) và (5). Câu 20: Hòa tan hết 0,54 gam Al trong 350 ml dung dịch H2SO4 0,1M (loãng), thu được dung dịch X. Cho 75 ml dung dịch Ba(OH)2 0,5M vào X, phản ứng xảy ra hoàn toàn thu được m gam kết tủa. Giá trị của m là A. 9,325. B. 9,715. C. 8,155. D. 1,170. Câu 21: Dãy gồm các chất vừa tác dụng được với dung dịch HCl vừa tác dụng được với dung dịch NaOH là A. Al, CaCO3, Al(OH)3. B. Al2 O3, Al(OH)3, NaHCO3. C. Ca(HCO3)2, Na2CO3, KHCO 3. D. Al2O3, Al(OH)3, MgCO3. Câu 22: Cho 5,5 gam hỗn hợp bột Al và Fe (tỉ lệ mol tương ứng 2:1) vào 300 ml dung dịch AgNO3 1M. Khuấy kĩ cho phản ứng xảy ra hoàn toàn thu được m gam chất rắn. Giá trị của m là A. 32,4. B. 35,2. C. 35,1. D. 36,0 Câu 23: Thực hiện các thí nghiệm sau: (1) Cho kim loại Mg vào dung dịch FeCl2. (2) Cho kim loại Na vào dung dịch CuSO4. (3) Cho AgNO3 vào dung dịch Fe(NO3)2. (4) Cho khí H2 đi qua ống sứ đựng bột CuO nung nóng. (5) Cho khí CO đi qua ống sứ đựng bột Al2O3 nung nóng. (6) Cho kim loại Cu vào dung dịch FeCl3 Các thí nghiệm điều chế được kim loại khi kết thúc phản ứng là A. (1), (2), (3), (4). B. (1), (3), (4). C. (2), (5), (6). D. (1), (3), (4), (5). Câu 24: Polime X là chất rắn trong suốt, cho ánh sáng truyền qua tốt nên được dùng chế tạo thủy tinh hữu cơ plexiglas. Monome tạo thành X là : A. CH2=C(CH3)COOCH3. B. CH2=CH-CN. C. CH2=CH-Cl. D. H2N-[CH2]6-COOH. Câu 25: Cho các chất sau: CH3COOCH3, H2NCH2COOH, CH3COOC6H5, C2H5NH3Cl, H2NCH2COONa, HOOCCH2NH3Cl tác dụng lần lượt với dung dịch KOH dư, đun nóng. Số chất tham gia phản ứng là A. 4. B. 5. C. 6. D. 3. Câu 26: Hỗn hợp X gồm vinyl axetat, metyl axetat và etyl fomat. Đốt cháy hoàn toàn 6,16 gam X, thu được 4,32 gam H2O. Phần trăm số mol của vinyl axetat trong X là A. 25%. B. 72,08%. C. 27,92%. D. 75%. Câu 27: Sục từ từ khí CO2 đến dư vào dung dịch hỗn hợp gồm a mol NaOH và b mol Ca(OH)2, kết quả thí nghiệm được biểu diễn trên đồ thị sau 0,5 0 0,5 1,4 Tỉ lệ a : b là A. 4 : 3. B. 2 : 3. C. 5 : 4. D. 4 : 5. Câu 28: Cho dung dịch X chứa 0,01 mol H2NCH2COOH và 0,03 mol Gly-Ala tác dụng với 150 ml dung dịch NaOH 1M đun nóng thu được dung dịch Y. Cô cạn cẩn thận dung dịch Y thu được m gam chất rắn khan. Giá trị của m là A. 10,41. B. 11,25. C. 9,69. D. 10,55. Câu 29: Nhận xét nào sau đây không đúng ? A. Trong phản ứng este hóa từ ancol và axit, phân tử nước có nguồn gốc từ nhóm –OH của axit cacboxylic. B. Không thể điều chế được phenyl axetat bằng phản ứng trực tiếp từ phenol và axit axetic. C. Phản ứng este hóa giữa axit cacboxylic và ancol là phản ứng thuận nghịch. D. Thủy phân este đơn chức trong môi trường bazơ luôn cho sản phẩm là muối và ancol. Câu 30: Điện phân (với điện cực trơ) một dung dịch gồm NaCl và CuSO4 có cùng số mol, đến khi ở catot xuất hiện bọt khí thì dừng điện phân. Trong cả quá trình điện phân trên, sản phẩm thu được ở anot là A. khí Cl2 và H2. B. khí Cl2 và O2. C. chỉ có khí Cl2. D. khí H2 và O2 Câu 31: Hòa tan hoàn toàn hỗn hợp gồm 1,12 gam Fe và 1,44 gam FeO bằng 300 ml dung dịch HCl 0,4 M, thu được dung dịch X. Cho dung dịch AgNO3 dư vào X, thu được khí NO (sản phẩm khử duy nhất của N+5) và m gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là A. 20,46. B. 21,54. C. 18,3. D. 9,15. Câu 32: Cho một lượng hỗn hợp X gồm Ba và Na vào 200 ml dung dịch Y gồm HCl 0,04M và AlCl3 0,1M. Kết thúc các phản ứng, 0,896 lít khí (đktc) và m gam kết tủa. Giá trị của m là A. 1,248. B. 1,56. C. 0,936. D. 0,624. Câu 33: Hợp chất X có công thức C8H14O4. Từ X thực hiện các phản ứng theo đúng tỉ lệ mol sau đây (a) X + 2NaOH → X1 + X2 + H2O. (b) X1 + H2SO4 → X3 + Na2SO4. (c) nX3 + nX4 → nilon – 6,6 + 2nH2O. (d) 2X2 + X3 → X5 + 2H2O. Phân tử khối của X5 là A. 202. B. 216. C. 174. D. 198. Câu 34: Hỗn hợp X gồm Cu, Ag, Fe2O3 có tỉ lệ số mol tương ứng là 1:2:1. Cho 44 gam hỗn hợp X tác dụng với dung dịch HCl dư thu được chất rắn Y và dung dịch Z. Cho dung dịch Z tác dụng với dung dịch NaOH dư (không có không khí) đến khi phản ứng xảy ra hoàn toàn thu được m gam kết tủa. Giá trị của m là A. 27,8 gam B. 24,1 gam C. 21,4 gam D. 28,7 gam Câu 35: Đốt cháy hoàn toàn m gam hỗn hợp A gồm xenlulozơ, tinh bột, glucozơ và saccarozơ cần vừa đủ 5,04 lít khí O2 (đktc) thu được 3,6 gam H 2O. Giá trị của m là A. 12,4. B. 10,5. C. 7,2. D. 6,3. Câu 36: Hỗn hợp X gồm Al, FexOy. Tiến hành phản ứng nhiệt nhôm hoàn toàn m gam hỗn hợp X trong điều kiện không có không khí thu được hỗn hợp rắn Y. Chia Y thành 2 phần. - Phần 1 tác dụng với dung dịch NaOH dư thu được 1,008 lít H2 (đktc) và còn lại 5,04 gam chất rắn không tan. - Phần 2 có khối lượng 29,79 gam, cho tác dụng với dung dịch HNO3 loãng dư thu được 8,064 lít khí NO (đktc, sản phẩm khử duy nhất). Giá trị của m và công thức của oxit sắt là A. 39,72 gam và FeO. B. 39,72 gam và Fe3O4. C. 38,91 gam và FeO. D. 36,48 gam và Fe3O4. Câu 37: Cho m gam hỗn hợp X chứa Cu(NO3)2, Fe(NO3)2 và Fe3O4 tác dụng vừa đủ với dung dịch chứa 1,2 mol KHSO4. Kết thúc phản ứng thu được 2,24 lít khí NO (đktc, sản phẩm khử duy nhất) và dung dịch Y chứa 227,4 gam muối trung hòa. Cho dung dịch Ba(OH)2 dư vào dung dịch Y thấy xuất hiện m1 gam kết tủa. Giá trị của m1 là A. 342,4. B. 321,8. C. 268,8. D. 342,9. Câu 38: Hợp chất hữu cơ X (chứa C, H, O) và chứa vòng benzen trong phân tử. Cho 0,05 mol X tác dụng với dung dịch NaOH 10% (lấy dư 20% so với lượng cần phản ứng) đến phản ứng hoàn toàn, cô cạn dung dịch sau phản ứng thu được m gam chất rắn khan Y và phần hơi Z chỉ chứa một chất. Ngưng tụ Z rồi cho tác dụng với kim loại Na dư, sau phản ứng hoàn toàn thu được 41,44 lít H2 (đktc). Đốt cháy hoàn toàn Y thu được 0,09 mol Na2CO3; 0,26 mol CO2 và 0,14 mol H2O. Biết X có công thức phân tử trùng với công thức đơn giản nhất. Giá trị của m là A. 10,8. B. 12,3. C. 11,1. D. 11,9. Câu 39: Cho 38,55 gam hỗn hợp X gồm Mg, Al, ZnO và Fe(NO3)2 tan hoàn toàn trong dung dịch chứa 0,725 mol H2SO4 (loãng). Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y chỉ chứa 96,55 gam muối sufat trung hòa và 3,92 lít (đktc) hỗn hợp khí Z gồm hai khí trong đó có một khí hóa nâu ngoài không khí. Biết tỉ khối của Z so với H2 là 9. Phần trăm số mol của Mg trong hỗn hợp X gần nhất với giá trị nào sau đây? A. 25% B. 15%. C. 40%. D. 30%. Câu 40: Hỗn hợp X gồm peptit A mạch hở có công thức CxHyNtO6 và hợp chất hữu cơ B có công thức phân tử C4H9NO2. Cho 0,09 mol hỗn hợp X phản ứng vừa đủ với dung dịch chứa 0,21 mol NaOH. Phản ứng kết thúc chỉ thu được dung dịch gồm ancol etylic và a mol muối của glyxin, b mol muối của alanin. Nếu đốt cháy hoàn toàn 41,325 gam hỗn hợp X bằng lượng oxi vừa đủ thu được N2; 96,975 gam hỗn hợp CO2 và H 2O. Giá trị a:b gần nhất với A. 0,50. B. 0,76. C. 1,30. D. 2,60. ....................HẾT................... ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI MÔN HÓA HỌC Câu 1: Chọn C. Câu 2: Chọn B. Câu 3: Chọn C. Câu 4: Chọn D.(điện phân nóng chảy) Câu 5: Chọn C.(dùng dd Na2CO3 để làm mềm nước cứng toàn phần) Câu 6: Chọn A. (dd Ca(OH)2 Câu 7: Chọn B. (nilon-6,6) Câu 8: Chọn D. AlH2. Vậy nAl = 0,1 mol m = Câu 9: Chọn C. Fe NO. Vậy nNO = Câu 10: Chọn B. (C2H5COOC2H5) Câu 11: Chọn C. (saccarozơ) Câu 12: Chọn A. (MgCl2) Câu 13: Chọn A. Vì tạo hai muối có tỉ lệ mol 1: 2 nên có hai chất béo (triglyxerit) Câu 14: Chọn C. (gồm b, c, d đúng) Câu 15: Chọn D. (CH2=CHCl) Câu 16: Chọn C. (gồm các chất: CaCO3, Fe3O4, Fe(OH)3, Fe(NO3)2) Câu 17: Chọn B. (gồm 1,3,4) Câu 18: Chọn D. M + H2O M(OH) + H2 nM = Câu 19: Chọn B. (gồm 4 và 5 đúng) Câu 20: Chọn A. nAl = 0,02 mol, Al Al3+ + 3e 2H+ +2e H2 BTE H+(dư) = 0,07 – 3.0,02 = 0,01 mol Phương trình phản ứng: Ba2+ + SO42- BaSO4 H+ + OH- H2O Al3+ + 3OH- Al(OH)3 Al(OH)3 + OH- AlO2- + 2H2O Dựa vào số mol và pt phản ứng m= BaSO4 + Al(OH)3 = 0,035.233 + 0,015.78 = Câu 21: Chọn B. (gồm các chất: Al2 O3, Al(OH)3, NaHCO3) Câu 22: Chọn B. Gọi 2x là số mol Al và x là số mol của Fe 27.2x + 56x = 5,5 x = 0,05 mol nAl = 0,1 mol. Ag+ = 0,3 mol, ptpư: Al + 3Ag+ Al3+ + 3Ag Al phản ứng vừa đủ với Ag+ mRắn = mAg(sinh) + mFe (dư) = 0,3.108 + 0,05.56 = Câu 23: Chọn B. (gồm 1, 3 và 4) Câu 24: Chọn A. (CH2=C(CH3)COOCH3) Câu 25 : Chọn B. (gồm các chất: CH3COOCH3, H2NCH2COOH, CH3COOC6H5, C2H5NH3Cl HOOCCH2NH3Cl) Câu 26: Chọn A. Vinyl axetat: C4H6O2(k = 2), metyl axetat và etyl fomat đều có công thức phân tử: C3H6O2 (k = 1), các chất đều có 6 nguyên tử C và 2 nguyên tử O nên: mà % số mol C4H6O2 = Câu 27 : Chọn D. Nhìn vào đồ thị ta thấy khi số mol CO2 = 0,5 mol thì kết tủa lớn nhất dù CO2 vẫn tham gia phản ứng số mol Ca(OH)2 = 0,5 mol. Tổng số mol OH- = CO2 khi kết tủa tan hoàn toàn = 1,4 mol nNaOH = 1,4 – 2.0,5 = 0,4 mol Câu 28: Chọn A. H2NCH2COOH + NaOH Muối + H2O Gly-Ala +2NaOH Muối + H2O nNaOH (phản ứng) = 0,01 + 2.0,03 = 0,07molnNaOH (dư) = 0,08 molnGly-Na = 0,01 + 0,03 = 0,04 mol; nVal-Na = 0,03 mol mRắn = mGly-Na + mAla-Na + mNaOH(dư) = 0,04.97 + 0,03.111 + 0,08.40 = Câu 29: Chọn D. (thủy phân este đơn chức trong môi trường bazơ luôn cho sản phẩm là muối và ancol) là không chính xác vì có trường hợp tạo ra an đêhit, muối của phenol... Câu 30: Chọn B. ( anot thu được Cl2 và O2) Catot (-) Anot (+) Cu2+ +2e Cu 2Cl- + 2e Cl2 2H2O + 4e O2 + 4H+ + 4e Vì Cu2+ hết nên H2O phải điện phân ở anot (do gt số mol Cl- = số mol Cu2+ mà Cl- điện phân gấp đôi Cu2+) Câu 31: Chọn C. nFe = 0,02 mol, nFeO = 0,02 mol phản ứng với dd HCl (0,12mol) ddX X + dd AgNO3(dư): Ag+ + Cl- AgCl Fe2+ Fe3+ + 1e 4H+ + NO3- +3e NO + H2O Ag+ + 1e Ag Dựa vào BTE và số mol các chất m = mAgCl + mAg = 0,12.143,5 + 108(0,04-0,03) = Câu 32: Chọn D. nH+(ax) = 0,008 mol nH+(H2O) = 2.0,04 – 0,008 = 0,072 mol nOH- = 0,072 mol nAl3+ = 0,02 mol m= 0,008.78 = Câu 33: Chọn A. Các pt phản ứng HOOC[CH2]4COOC2H5 (X) + 2NaOH NaOOC[CH2]4COONa (X1) + C2H5OH (X2) + H2O NaOOC[CH2]4COONa (X1) + H2SO4 HOOC[CH2]4COOH (X3) + Na2SO4 n HOOC[CH2]4COOH + nH2N[CH2]NH2 nilon-6,6 + 2nH2O 2C2H5OH + HOOC[CH2]4COOH C2H5OOC[CH2]4COOC2H5 (X5 có M = 202) + 2H2O Câu 34: Chọn A. x = 0,1 mol Fe2O3 + 6H+ 2Fe3+ + Fe2+ +4H2O Cu + 2Fe3+ Cu2+ + 2Fe2+ Cu phản ứng vừa đủ với Fe2+ kết tủa gồm Câu 35: Chọn D. nO2 = 0,225 mol, nH2O = 0,2 mol. CT chung của cacbohiđrat là Cn(H2O)m nCO2 = nO2 = 0,225 mol BT khối lượng m = 0,225.44 + 3,6 – 0,225.32 = Câu 36: Chọn B. Phần 1 nAl(dư) = 2/3nH2 = 2/3.0,045 = 0,03 mol, nFe = 5,04/56 = 0,09 mol . Giả sử Fe Fe3+, Al Al3+ ne(1) = 3(0,03 +0,09) = 0,36 mol Phần 2 + HNO3: ne(2) = 3nNO = 3.0,36 = 1,08 mol. Vậy P2/P1 = 3. Tính trong phần 2 (29,79 gam) nFe = 0,09.3 = 0,27 mol, nAl(dư) = 0,03.3 = 0,09 mol mAl2O3 = 29,79 – 0,09.27 - 0,27.56 = 12,24 gam nO = 3.12,24/102 = 0,36 mol Fe/O = 0,27/0,36 = ¾ và m = 29,79.4/3 = Câu 37: Chọn D. Ta có: 4H+ + NO3- +3e NO + 2H2O nH+ = 4.0,1 = 0,4 mol. BTNT (H) nH+(kết hợp với Fe3O4) = 1,2 – 0,4 = 0,8 mol nO = 0,4 mol nFe3O4 = 0,1 mol. BTE nFe(NO3)2 = 0,2 mol nFe(trong X) = 0,5 mol. Dd Y( a mol Cu2+; 0,5 mol Fe3+; 1,2 mol SO42- và 2a + 0,3 mol NO3-). BTĐT a = 0,1 mol m = 0,5.107 + 0,1.98 + 1,2.233 = Câu 38: Chọn B. Chất Z là H2O nH2 = 1,85 mol nH = 3,7 mol. Số mol Na2CO3 = 0,09 mol nNaOH = 0,18 mol nNaOH (phản ứng) = 0,15 mol nH2O (trong dd NaOH) = nH2O (sinh ra) = 3,7 – 3,6 = 0,1 mol nC (trong X) = 0,09 + 0,26 = 0,35 mol; nH (trong X) = 0,14.2 + 0,1.2 – 0,18 = 0,3 mol C:H = 7:6 đồng thời tỉ lệ mol NaOH:X = 3:1 X: HCOO-C6H4-OH BTKL mRắn = 0,05.138 + 0,18.40 – 0,1.18 = Câu 39: Chọn D. Ta có . BTKL mH2O = 38,55 + 0,725.98 – 96,55 – 0,175.18 = 9,9 gam nH2O = 0,55 mol. Gọi a là số mol của NH4+ , BTNT (H) 4a + 0,075.2 + 0,55.2 = 0,725.2 a = 0,85 mol. BTNT (N) . BTNT (O) nZnO + 0,075.6 = 0,1 + 0,55 nZnO = 0,2 mol Câu 40: Chọn C. Vì có 6 nguyên tử O 5 ng.tử N A là pentapeptit và B là H2NCH2COOC2H5 Gọi . BTKL 44.7nt + (2n +1).7t.9 = 96,975 + 4.18t (2). Từ (1 và 2) t = 0,075 mol và n = 3. Vậy khối lượng hỗn hợp X ban đầu MA = 345A có dạng: Gly-Gly-Ala-Ala-Ala .
Tài liệu đính kèm:
 de_thi_thu_thpt_quoc_gia_lan_1_mon_hoa_hoc_nam_2017_ma_de_01.doc
de_thi_thu_thpt_quoc_gia_lan_1_mon_hoa_hoc_nam_2017_ma_de_01.doc





