Đề thi học sinh giỏi môn Hóa học năm 2017 - Tỉnh Bắc Giang
Bạn đang xem tài liệu "Đề thi học sinh giỏi môn Hóa học năm 2017 - Tỉnh Bắc Giang", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
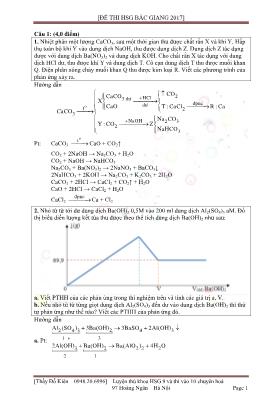
[ĐỀ THI HSG BẮC GIANG 2017] [Thầy Đỗ Kiên – 0948.20.6996] – Luyện thủ khoa HSG 9 và thi vào 10 chuyên hố 97 Hồng Ngân – Hà Nội Page 1 Câu 1: (4,0 điểm) 1. Nhiệt phân một lượng CaCO3, sau một thời gian thu được chất rắn X và khí Y. Hấp thụ tồn bộ khí Y vào dung dịch NaOH, thu được dung dịch Z. Dung dịch Z tác dụng được với dung dịch Ba(NO3)2 và dung dịch KOH. Cho chất rắn X tác dụng với dung dịch HCl dư, thu được khí Y và dung dịch T. Cơ cạn dung dịch T thu được muối khan Q. Điện phân nĩng chảy muối khan Q thu được kim loại R. Viết các phương trình của phản ứng xảy ra. Hướng dẫn o 2HCl3 dư đpnc dư t 2 3 NaOH 2 3 2 3 CO CaCO X CaO T : CaCl R : Ca CaCO Na CO Y : CO Z NaHCO Pt: CaCO3 o t CaO + CO2↑ CO2 + 2NaOH → Na2CO3 + H2O CO2 + NaOH → NaHCO3 Na2CO3 + Ba(NO3)2 → 2NaNO3 + BaCO3↓ 2NaHCO3 + 2KOH → Na2CO3 + K2CO3 + 2H2O CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O CaO + 2HCl → CaCl2 + H2O CaCl2 đpnc Ca + Cl2 2. Nhỏ từ từ tới dư dung dịch Ba(OH)2 0,5M vào 200 ml dung dịch Al2(SO4)3 aM. Đồ thị biểu diễn lượng kết tủa thu được theo thể tích dung dịch Ba(OH)2 như sau: a. Viết PTHH của các phản ứng trong thí nghiệm trên và tính các giá trị a, V. b. Nếu nhỏ từ từ từng giọt dung dịch Al2(SO4)3 đến dư vào dung dịch Ba(OH)2 thì thứ tự phản ứng như thế nào? Viết các PTHH của phản ứng đĩ. Hướng dẫn a. Pt: 2 4 3 2 4 3 31 3 2 2 2 2 12 Al (SO ) 3Ba(OH) 3BaSO 2Al(OH) 2Al(OH) Ba(OH) Ba(AlO ) 4H O [ĐỀ THI HSG BẮC GIANG 2017] [Thầy Đỗ Kiên – 0948.20.6996] – Luyện thủ khoa HSG 9 và thi vào 10 chuyên hố 97 Hồng Ngân – Hà Nội Page 2 Kết tủa cĩ thể gồm: Al(OH)3 và BaSO4 Tại điểm V đồ thị đi ngang, chứng tỏ: thêm tiếp Ba(OH)2 đến dư thì khối lượng kết tủa khơng đổi, vậy → nBaSO4 = 0,3 4 4 SO :0,6a BTNT.SO a 0,5(M) Tại V thì 2 4 3 Al (SO ) :0,1 2 2 2 4 3 nBa(OH) 4 nBa(OH) 0,4 V 0,8(l) nAl (SO ) 1 b. Khi nhỏ muối Al vào kiềm ta thấy cĩ kết tủa trắng xuất hiện (BaSO4). Thêm tiếp muối Al vào thì thấy cĩ xuất hiện kết tủa trắng, dạng keo xuất hiện, kết tủa tăng dần đến tối đa. Nếu tiếp tục thêm muối Al vào thì kết tủa khơng thay đổi khối lượng. pt: Al2(SO4)3 + 4Ba(OH)2 → Ba(AlO2)2 + 3BaSO4↓ + 4H2O Al2(SO4)3 + 3Ba(OH)2 → 2Al(OH)3↓ + 3BaSO4↓ Chú ý: khi làm ngược lại (cho kiềm vào muối Al) thì ngay từ đầu đã xuất hiện kết tủa, kết tủa tăng dần đến tối đa, nếu thêm đến dư kiềm thì kết tủa lại tan dần đến hết. Câu 2: (4,0 điểm) 1. Dẫn 2,8 lít hỗn hợp khí X gồm 2 hidrocacbon vào bình đựng dung dịch Brom dư, sau khi phản ứng hồn tồn, cĩ 16 gam brom tham gia phản ứng và cịn lại 1,68 lít khí. Nếu đốt cháy hồn tồn 2,8 lít khí X thì thu được 5,04 lít khí CO2. Xác định cơng thức phân tử của các hidrocacbon, biết các thể tích khí đo ở đktc. Hướng dẫn Giả sử X gồm A, B. Khí bay ra khỏi dung dịch Br2 ta coi là A. 2 2 Br 0,1(mol) O 2 2 0,125(mol) 0,225 A : 0,075 A : a X B : b CO H O Dễ cĩ 2 Br 2 n 2n 2 0,1 0,05 A : 0,075 ankin B nB : nBr 1: 2 B C H X : 0,125 ankadien 4 (B) 2BTNT.C2 4 (B) 3 4 nCH Số C .0,05 nCOnCO Số C 1,8 A : CH nX Số C 3 B : C H [ĐỀ THI HSG BẮC GIANG 2017] [Thầy Đỗ Kiên – 0948.20.6996] – Luyện thủ khoa HSG 9 và thi vào 10 chuyên hố 97 Hồng Ngân – Hà Nội Page 3 2. Chia 11,37 gam hỗn hợp Al và Zn thành 2 phần bằng nhau. Phần 1: cho tác dụng với dung dịch HCl dư, thu được 2,688 lít khí (đktc). Phần 2: hồ tan vào dung dịch chứa 0,591 mol HNO3, thu được dung dịch Y và V lít khí N2 duy nhất (đktc). Dung dịch Y tác dụng được tối đa với 0,582 lít dung dịch KOH 1,25M để thu được dung dịch trong suốt. Viết các PTHH và tính V? Hướng dẫn 3 HCl 2 dư 2HNO KOH 0,591(mol) 5,685(g) 0,7275(mol) H : 0,12 Al N : V(l)X Zn Dung dịch Y Pt: 2Al + 6HCl → 2AlCl3 + 3H2↑ Zn + 2HCl → ZnCl2 + H2↑ 10Al + 36HNO3 → 10Al(NO3)3 + 3N2↑ + 18H2O 5Zn + 12HNO3 → 5Zn(NO3)2 + N2↑ + 6H2O Al(NO3)3 + 3KOH → 3KNO3 + Al(OH)3↓ Al(OH)3 + KOH → KAlO2 + 2H2O Zn(NO3)2 + 2KOH → 2KNO3 + Zn(OH)2↓ Zn(OH)2 + 2KOH → K2ZnO2 + 2H2O Ta có Al : x 27x 65y 5,685 x 0,03 Zn : y 1,5x y 0,12 y 0,075 3 2 2 HNO 2 KOH 20,591(mol) 0,7275(mol) 3 N : V(l) AlO : 0,03 Al ZnO : 0,075 Dung dịch Y ddZZn K : 0,7275 NO : ? Vì Al, Zn là kim loại mạnh nên cĩ thể khử N trong HNO3 xuống rất sâu, cụ thể là xuống muối NH4NO3. Giả sử 2 4 N : a NH : b BTNT.N 2 4 3(Z) 3 BTĐT 3 (Z) BT mol e 2 4 0,5475 2.nN nNH nNO nHNO a 0,0182a b 0,5475 0,591 NO b 0,00753.nAl 2.nZn 10.nN 8.nNH 3.0,03 2.0,075 10a 8b Suy ra: V = 0,4032 (lít) Câu 3: (4,0 điểm) 1. Viết các PTHH của phản ứng xảy ra theo sơ đồ chuyển hố sau (ghi rõ điều kiện) (1) (2) (3) (4) (5) (6) 1 2 6 2 3 4 5 6 1 X (C H O) X X X X X X [ĐỀ THI HSG BẮC GIANG 2017] [Thầy Đỗ Kiên – 0948.20.6996] – Luyện thủ khoa HSG 9 và thi vào 10 chuyên hố 97 Hồng Ngân – Hà Nội Page 4 Hướng dẫn o o o 2 4 (1) 3 2 2 3 2 (2) 3 3 2 (3) 3 4 2 3 CaO,t (4) 4 2 2 2 1500 C,làm lạnh nhanh (5) 2 2 2 2 2 Pd,t (6) 2 2 2 H SO ,loã CH CH OH O CH COOH H O 1 CH COOH Na CH COONa H 2 CH COONa NaOH CH Na CO CH C H 3H C H H CH CH CH CH H O 3 2 ng CH CH OH 2. Hồ tan hồn tồn 42,4 gam hỗn hợp X gồm Fe3O4 và kim loại R (cĩ hố trị khơng đổi) trong dung dịch H2SO4 đặc nĩng, thu được 4,48 lít SO2 (đktc, sản phẩm khử duy nhất của H2SO4) và dung dịch Y chỉ chứa 93,6 gam chất tan gồm 2 muối sunfat trung hồ. Xác định kim loại R. Hướng dẫn 2 4 2 H SO 3 4 2 4 3 đặc,nóng 2 4 n 93,6(g) 42,4(gam) SO : 0,2 Fe O : x Fe (SO )X Dung dịch YR : y R (SO ) Pt: 2Fe3O4 + 10H2SO4 → 3Fe2(SO4)3 + SO2 + 10H2O 2R + 2nH2SO4 → R2(SO4)n + nSO2 + nH2O BTKL 2 4 2 2 2 4 a(mol) mX mH SO mSO mY mH O Giả sử H SO a 0,8 42,4 98a 64.0,2 93,6 18a Ta cĩ BTNT 2 4 3 2 4 n 232x Ry 42,4 x 0,1 5x ny 0,8 Ry 19,2 ny 0,3Fe (SO ) :1,5x 400.1,5x (2R 96n).0,5y 93,6 R (SO ) : 0,5y Suy ra R là Cu Câu 4: (4,0 điểm) 1. Chỉ dùng thêm một hố chất, phân biệt 5 chất rắn Al, CaC2, Fe, Al4C3, ZnO đựng trong các lọ riêng biệt, mất nhãn. Viết các PTHH xảy ra. Hướng dẫn Dùng H2O [ĐỀ THI HSG BẮC GIANG 2017] [Thầy Đỗ Kiên – 0948.20.6996] – Luyện thủ khoa HSG 9 và thi vào 10 chuyên hố 97 Hồng Ngân – Hà Nội Page 5 2 2 2 2 2 H O2 4 3 4 3 dư 4 3 2 Ca(OH) CaC : C H Al,CaC ,Fe Al C : CH Al(OH) Al C ,ZnO Al : tan H Al,ZnO ZnO : tan Fe Fe : không tan Chú ý: Ca(OH)2 chính là dung dịch thu được khi cho CaC2 vào H2O. Pt: CaC2 + 2H2O → Ca(OH)2 + CH≡CH↑ Al4C3 + 12H2O → 4Al(OH)3 + 3CH4↑ 2Al + Ca(OH)2 + 2H2O → Ca(AlO2)2 + 3H2↑ ZnO + Ca(OH)2 → CaZnO2 + H2O 2. Đốt cháy hồn tồn 5,7 gam hỗn hợp X gồm 1 rượu CnHmO và 1 axit cacboxylic CaH2aO2 (các giá trị của m, n và a là các số nguyên dương, m ≤ 2n + 2) thu được 5,04 lít CO2 và 5,4 gam H2O. Thực hiện phản ứng este hố 5,7 gam X với hiệu suất 60% thu được p gam este. Viết các PTHH và tính p. Hướng dẫn 2 2 (X)BTKL (X) mX mC mH mO 12.nCO 2.nH O 16.nO nO 0,15 2 2 a 2a 2 2 2 2 n 2n 2 2 2 2nCO nH O 1 n n 1 2 2 Nhận xét 0,225 0,3 2 2 Ancol no C H O O aCO aH O C H O O nCO (n 1)H O CO H O nAncol nH O nCO Đốt cháy 2 2 0,075 BTNT.O 2 2 nAncol : 0,3 0,225 Axit : nH O nCO Ancol no:nAncol=nH O nCO Axit : 0,0375 Vậy BTNT.C3 4 8 2 1 BTNT.C22 2 5 2 2 4 2 CH OH : 0,075 C H O RCOOH : 0,0375 TH nCOCO : 0,225 HCOOH : 0,0375 lẻ (loại)Số C 2 R 'OH : 0,075nXX : 0,1125 C H OH : 0,075 TH C H O : 0,0375 [ĐỀ THI HSG BẮC GIANG 2017] [Thầy Đỗ Kiên – 0948.20.6996] – Luyện thủ khoa HSG 9 và thi vào 10 chuyên hố 97 Hồng Ngân – Hà Nội Page 6 Este hố Este H 60%3 1 3 7 3 3 7 0,0225 Este H 60%2 5 2 3 2 5 3 0,0225 CH OH : 0,075 TH C H COOCH p 2,295(g) C H COOH : 0,0375 C H OH : 0,075 TH CH COOC H p 1,98(g) CH COOH : 0,0375 Câu 5: (4,0 điểm) 1. Đun nĩng 4,82 gam hỗn hợp X gồm KClO3 và KMnO4, sau một thời gian thu được 4,34 gam chất rắn Y. Cho Y tác dụng hồn tồn với HCl đặc, sau phản ứng thu được 1,512 lít khí Clo (đktc) và dung dịch gồm MnCl2, KCl và HCl dư. Tính số mol HCl đã phản ứng. Hướng dẫn o 2 t3 HCl 2 4 ? 4,34(g) 4,82(g) O KClO : x Cl : 0,0675X Rắn YKMnO : y ddZ BTKL 2 2 mX mY mO nO 0,015 BT mol e 3 5 2 2 122,5x 158y 4,82 x 0,02 6.nKClO 5.KMnO 4.nO 2.nCl y 0,015 6x 5y 0,195 2 KCl : x y Z MnCl : y BTNT.Cl 3 2 (Z) nKClO nHCl 2.nCl nCl nHCl 0,18 (mol) 0,02 nHCl 2.0,0675 0,065 2. Thuỷ phân hồn tồn 0,1 mol este X cần vừa đủ 100 gam dung dịch NaOH 12%, thu được 20,4 gam muối của một axit hữu cơ và 9,2 gam 1 rượu. Xác định cơng thức cấu tạo của X biết rắn một trong 2 chất axit hoặc rượu tạo thành este đơn chức. Hướng dẫn NaOH : 0,3 X X : 0,1 là este 3 chức Mặt khác Muối 3 5 Ancol 3 5 3 CTCT của X 20,4 HCOOM 68 HCOONa Muối : 20,4g 3.0,1 HCOO C H Ancol : 9,2g 9,2 M 92 C H (OH) HCOO 0,1 3. Hình vẽ sau mơ tả điều chế khí Z [ĐỀ THI HSG BẮC GIANG 2017] [Thầy Đỗ Kiên – 0948.20.6996] – Luyện thủ khoa HSG 9 và thi vào 10 chuyên hố 97 Hồng Ngân – Hà Nội Page 7 a. Nêu nguyên tắc chung điều chế khí Z? b. Lấy hai trường hợp cụ thể của khí Z, rồi xác định các chất X, Y và viết các PTHH minh hoạ. Hướng dẫn Hình vẽ mơ tả quá trình điều chế khí Cl2 Nguyên tắc chung: Dùng các hợp chất giàu khí O2 tác dụng với dung dịch HCl. Pt: 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O MnO2 + 4HCl → MnCl2 + Cl2↑ + H2O KClO3 + 6HCl → KCl + 3Cl2↑ + 3H2O Khí Cl2 sinh ra thường lẫn tạp chất là hơi HCl và H2O nên dùng 2 bình NaCl để giữ HCl và H2SO4 để hấp thụ H2O, khi đĩ ta thu được Cl2 tinh khiết.
Tài liệu đính kèm:
 ĐỀ HSG BẮC GIANG 2017.pdf
ĐỀ HSG BẮC GIANG 2017.pdf





