Đề thi học sinh giỏi huyện Khoái Châu năm học 2013 - 2014 môn: Hóa học 8
Bạn đang xem tài liệu "Đề thi học sinh giỏi huyện Khoái Châu năm học 2013 - 2014 môn: Hóa học 8", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
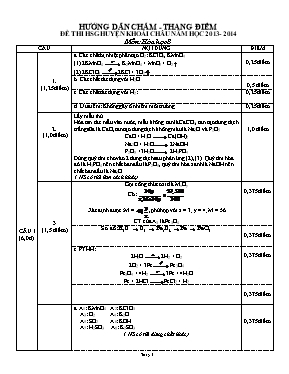
HƯỚNG DẪN CHẤM - THANG ĐIỂM ĐỀ THI HSG HUYỆN KHOÁI CHÂU NĂM HỌC 2013- 2014 Môn: Hóa học 8 CÂU NỘI DUNG ĐIỂM CÂU I (6,0 đ) 1. (1,25 điểm) a. Các chất bị nhiệt phân tạo O2: KClO3, KMnO4 (1) 2KMnO4 K2MnO4 + MnO2 + O2 (2) 2KClO3 2KCl + 3O2 0,25 điểm b. Các chất tác dụng với H2O 0,5 điểm c. Các chất tác dụng với H2: 0,25 điểm d. Ưu điểm: Không gây ô nhiễm môi trường. 0,25 điểm 2. (1,0 điểm) Lấy mẫu thử Hòa tan các mẫu vào nước, mẫu không tan là CaCO3, tan tạo dung dịch trắng sữa là CaO, tan tạo dung dịch không màu là Na2O và P2O5. CaO + H2O Ca(OH)2 Na2O + H2O 2NaOH P2O5 +3H2O 2H3PO4 Dùng quỳ tím cho vào 2 dung dịch sau phản ứng (2), (3). Quỳ tím hóa đỏ là H3PO4 nên chất ban đầu là P2O5, quỳ tím hóa xanh là NaOH nên chất ban đầu là Na2O ( HS có thể làm cách khác) 1,0 điểm 3 (1,5 điểm) Gọi công thức oxit là MxOy Có: Xác định được: M = ,phù hợp với x = 3; y = 4; M = 56 CT của A3 là Fe3O4 0,375 điểm Sơ đồ: H2O O2 Fe3O4 Fe FeCl2 0,375 điểm c. PTHH: 2H2O 2H2 + O2 2O2 + 3Fe Fe3O4 Fe3O4 + 4H2 3Fe + 4H2O Fe + 2HCl FeCl2 + H2 0,375 điểm 0,375 điểm 4 (2,25 điểm) a. A1: KMnO4 A2: KClO3 A3: O2 A4: K2O A5: SO2 A6: KOH A7: H2SO3 A8: K2SO3 ( HS có thể dùng chất khác) 0,375 điểm b. (1) 2KMnO4 K2MnO4 + MnO2 + O2 (2) 2KClO3 2KCl + 3O2 (3) O2 + 4K 2K2O (4) O2 + S SO2 (5) K2O + H2O 2KOH (6) SO2 + H2O H2SO3 (7) 2KOH + H2SO3 K2SO3 + 2H2O 0,875 điểm c. Viết tên A1: KMnO4: Kali pemanganat A2: KClO3: Kali clorat A3: O2: Khí oxi A4: K2O: Kali oxit A5: SO2: Lưu huỳnh đioxit A6: KOH: Kali hiđroxit A7: H2SO3: Axit sunfurơ A8: K2SO3: Kali sunfit 0,5 điểm d. (1)(2) Phản ứng phân hủy (3) (4)(5)(6) Phản ứng hóa hợp 0,5 điểm CÂUII (4,0 đ) 1 (1,75 điểm) a. Ta có: Nên: Gọi a, b lần lượt là số mol Na,K trong X 2Na + 2H2O 2NaOH + H2 2K + H2O 2KOH + H2 b 0,5b Ta có: Giải hệ pt: a= 0,4, b=0,1 %Na = %K = 29,8% 0,25 điểm 0,25 điểm 0,5 điểm b. Theo câu a: H2 + ZnO Zn + H2O 0,25 điểm Nhận thấy ZnO hết, H2 dư. nZn = 0,2.75% = 0,15 (mol) nên mZn= 9,75 (gam) nZnO dư = 0,05.81 = 4,05 (gam) Xác định được: m = 11,05 (gam) 0,5 điểm 2 (1,25 điểm) * Ở 10oC, SR = 170 gam, suy ra khối lượng dung dịch bão hòa là: mdd= 170 + 100 = 270 gam Trong 270 g dung dịch bão hòa chất R có 170 g R và 100 g H2O Trong 540 g dung dịch bão hòa chất R có x g R và y g H2O 0,5 điểm Gọi a là số gam R cần thêm để được dung dịch bão hòa ở 60oC Khối lượng các chất có trong dung dịch ở 60oC là: mR= 340 + a 0,25 điểm Ta có: => a= 710 gam Vậy cần thêm 710 gam R để được dung dịch bão hòa ở 60oC 0,5 điểm 3 (1,0 điểm) Ta có: Gọi công thức oxit là A2O. * Trường hợp 1: A2O không tác dụng với nước, chất rắn là ACl PTHH: A2O + 2HCl 2ACl + H2O Theo ĐLBTKL (loại) 0,25 điểm * Trường hợp 2: A2O tác dụng với nước, chất rắn là ACl và AOH Gọi a là số mol A2O tác dụng với nước. PTHH: A2O + 2HCl 2ACl + H2O TL: 0,2 0,4 0,2 mol A2O + H2O 2AOH TL: a a mol Theo ĐLBTKL a= 0,35 (mol) Lúc đó: Vậy A là Na, công thức Na2O 0,75 điểm PHÒNG GIÁO DỤC VÀ ĐÀO TẠO HUYỆN KHOÁI CHÂU
Tài liệu đính kèm:
 HD_cham_chuan.doc
HD_cham_chuan.doc





