Đề thi chọn học sinh giỏi môn Hóa học Lớp 10 - Năm học 2015-2016 - Sở GD & ĐT Vĩnh Phúc (Có đáp án)
Bạn đang xem tài liệu "Đề thi chọn học sinh giỏi môn Hóa học Lớp 10 - Năm học 2015-2016 - Sở GD & ĐT Vĩnh Phúc (Có đáp án)", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
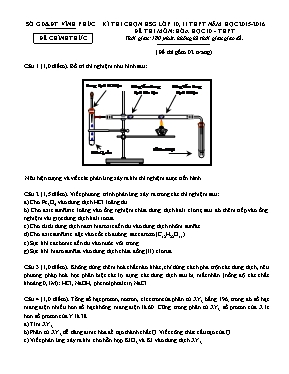
SỞ GD&ĐT VĨNH PHÚC ĐỀ CHÍNH THỨC Kè THI CHỌN HSG LỚP 10, 11 THPT NĂM HỌC 2015-2016 ĐỀ THI MễN: HểA HỌC 10 - THPT Thời gian: 180 phỳt, khụng kể thời gian giao đề. (Đề thi gồm 02 trang) Cõu 1 (1,0 điểm). Bố trớ thớ nghiệm như hỡnh sau: Nờu hiện tượng và viết cỏc phản ứng xảy ra khi thớ nghiệm được tiến hành. Cõu 2 (1,5 điểm). Viết phương trỡnh phản ứng xảy ra trong cỏc thớ nghiệm sau: a) Cho Fe3O4 vào dung dịch HCl loóng dư. b) Cho axit sunfuric loóng vào ống nghiệm chứa dung dịch kali clorit, sau đú thờm tiếp vào ống nghiệm vài giọt dung dịch kali iotua. c) Cho từ từ dung dịch natri hiđroxit đến dư vào dung dịch nhụm sunfat. d) Cho axit sunfuric đặc vào cốc cú đường saccarozơ (C12H22O11). e) Sục khớ cacbonic đến dư vào nước vụi trong. g) Sục khớ hiđro sunfua vào dung dịch chứa đồng (II) clorua. Cõu 3 (1,0 điểm). Khụng dựng thờm hoỏ chất nào khỏc, chỉ dựng cỏch pha trộn cỏc dung dịch, nờu phương phỏp hoỏ học phõn biệt cỏc lọ đựng cỏc dung dịch sau bị mất nhón (nồng độ cỏc chất khoảng 0,1M): HCl, NaOH, phenolphtalein, NaCl. Cõu 4 (1,0 điểm). Tổng số hạt proton, nơtron, electron của phõn tử XY3 bằng 196; trong đú số hạt mang điện nhiều hơn số hạt khụng mang điện là 60. Cũng trong phõn tử XY3 số proton của X ớt hơn số proton của Y là 38. a) Tỡm XY3. b) Phõn tử XY3 dễ dàng đime húa để tạo thành chất Q. Viết cụng thức cấu tạo của Q. c) Viết phản ứng xảy ra khi cho hỗn hợp KIO3 và KI vào dung dịch XY3. Cõu 5 (1,0 điểm). Cho dung dịch chứa 19,0 gam muối clorua của một kim loại húa trị (II) khụng đổi tỏc dụng vừa hết với dung dịch chứa 22,0 gam muối sunfua, thu được 11,6 gam kết tủa. Tỡm hai muối đó cho. Cõu 6 (1,5 điểm). Nguyờn tố X là một phi kim. Hợp chất khớ của X với hiđro là E; oxit cao nhất của X là F. Tỉ khối hơi của F so với E là 5,0137. a) Tỡm X. b) Hoàn thành sơ đồ sau (biết X3, X4, X6 là muối cú oxi của X; X5 là muối khụng chứa oxi của X; X7 là axit khụng bền của X). Cõu 7 (2,0 điểm). 1. Hoàn tan hết m gam hỗn hợp gồm Fe và một oxit sắt (FexOy) trong 800 ml dung dịch HCl 1M (vừa đủ), thu được dung dịch X và 1,792 lớt khớ H2 (ở đktc). Cho dung dịch X phản ứng với dung dịch AgNO3 dư, thu được 132,08 gam kết tủa. Tớnh m. 2. A là hợp chất của lưu huỳnh. Cho 43,6 gam chất A vào nước dư được dung dịch B. Cho dung dịch BaCl2 dư vào dung dịch B, thu được kết tủa trắng và dung dịch C. Cho Mg dư vào dung dịch C, thu được 11,2 lớt khớ ở (đktc). Xỏc định cụng thức phõn tử của chất A. Cõu 8 (1,0 điểm). Cho một lượng bột CaCO3 tỏc dụng hoàn toàn với dung dịch HCl 32,85%. Sau phản ứng, thu được dung dịch X trong đú nồng độ HCl cũn lại là 24,195%. Thờm vào X một lượng bột MgCO3 khuấy đều cho phản ứng xảy ra hoàn toàn, thu được dung dịch Y trong đú nồng độ HCl cũn lại là 21,11%. Tớnh nồng độ % của cỏc muối cú trong dung dịch Y. Ghi chỳ: Thớ sinh được dựng bảng tuần hoàn. Cho: H = 1; C = 12; N = 14; O = 16; F = 19; Na = 23; Mg = 24; Al = 27; Si = 28; P = 31; S = 32; Cl = 35,5; K = 39; Ca =40; Fe = 56; Cu = 64; Zn = 65; Ag = 108; Ba = 137. ---------------Hết--------------- Cỏn bộ coi thi khụng giải thớch gỡ thờm. Họ và tờn thớ sinh:............................................................................................................SBD:............................. SỞ GD&ĐT VĨNH PHÚC KỲ THI CHỌN HSG LỚP 10, 11 THPT Năm học: 2015 – 2016 HƯỚNG DẪN CHẤM MễN: HểA HỌC 10 - THPT (Hướng dẫn chấm gồm 04 trang) Cõu Nội dung Điểm Cõu 1 (1,0 đ) + Ống nghiệm chứa KMnO4 và đoạn thứ nhất ở của ống hỡnh trụ nằm ngang cú màu vàng lục vỡ cú khớ clo. 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O 0,25 đ + Đoạn giữa của ống hỡnh trụ nằm ngang cú màu đỏ nõu vỡ cú hơi brom sinh ra Cl2 + 2KBr → 2KCl + Br2 0,25 đ + Đoạn cuối của ống hỡnh trụ nằm ngang cú màu tớm vỡ cú hơi iot sinh ra Br2 + 2KI → 2KBr + I2 0,25 đ + Ống nghiệm chứa hồ tinh bột chuyển màu xanh vỡ iot sinh ra tỏc dụng với hồ tinh bột 0,25 đ Cõu 2 (1,5 đ) a) Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O 0,25 đ b) KClO2 + 4KI + 2H2SO4 → KCl + 2I2 + 2K2SO4 + 2H2O cú thể cú: KI + I2 → KI3 0,25 đ c) 6NaOH + Al2(SO4)3 → 2Al(OH)3↓ + 3Na2SO4 sau đú: NaOH + Al(OH)3 → NaAlO2 + 2H2O hoặc NaOH + Al(OH)3 → Na[Al(OH)4] 0,25 đ d) C12H22O11 12C + 11H2O và C + 2H2SO4 → CO2↑ + 2SO2↑ + 2H2O 0,25 đ e) Ca(OH)2 + CO2 → CaCO3↓ + H2O và CaCO3 + CO2 + H2O → Ca(HCO3)2 0,25 đ g) H2S + CuCl2 → CuS↓ + 2HCl 0,25 đ Cõu 3 (1,0 đ) + Cho cỏc cặp dung dịch phản ứng với nhau từng đụi một ị tỏch làm 2 nhúm. + Nhúm I: gồm NaOH và phenolphtalein vỡ trộn với nhau tạo dung dịch cú màu hồng. + Nhúm II: là NaCl và HCl khụng hiện tượng 0,25 đ + Gọi X là dung dịch cú màu hồng + Lần lượt cho hai chất trong nhúm II với lượng dư vào dung dịch X, dung dịch nào khi cho vào làm mất màu hồng là HCl, dung dịch khụng làm mất màu hồng là NaCl NaOH + HCl đ NaCl + H2O 0,25 đ + Gọi Y là dung dịch thu được khi cho HCl dư vào dung dịch X + Tiếp tục cho một trong hai dung dịch phenolphtalein và NaOH vào dung dịch Y, lọ nào khi cho vào xuất hiện màu hồng trở lại thỡ đú là NaOH, lọ cho vào khụng thay đổi màu là phenolphtalein. 0,5 đ Cõu 4 (1,0 đ) a) Gọi số proton và nơtron của X, Y lần lượt là PX; NX; PY; NY. Theo giả thiết ta cú hệ: ị ị PX = 13; PY = 17 + Vậy X là Al và Y là Cl ị XY3 là AlCl3. 0,5 đ b) AlCl3 đime húa thành Al2Cl6(Q) cú cụng thức cấu tạo như sau: 0,25 đ c) KIO3 + 5KI + 2AlCl3 + 3H2O → 2Al(OH)3 + 3I2 + 6KCl 0,25 đ Cõu 5 (1,0 đ) + Gọi MCl2 là muối clorua ; X2Sn là cụng thức của muối sunfua. @ TH1 : Tạo kết tủa muối sunfua nMCl2 + X2Sn nMS↓ + 2XCln mol : → ị = ị M = 29,135 (loại) 0,25 đ @ TH2 : Tạo kết tủa hiđroxit nMCl2 + X2Sn + 2nH2O nM(OH)2↓ + nH2S↑ + 2XCln mol : → ị = ị M = 24 (Magie) + Theo giả thiết và phản ứng ta cũng cú : = ị X = 39n ị n = 1 ; X = 39(kali) thỏa món. + Vậy hai muối đó cho là MgCl2 và K2S 0,75 đ Cõu 6 (1,5 đ) a) Gọi n là húa trị cao nhất của X với oxi(4 ≤ n ≤ 7) ị húa trị của X với hiđro bằng (8 – n) @ TH1: n là số lẻ ị F cú dạng X2On; E cú dạng XH(8-n). + Theo giả thiết ta cú: ị chỉ cú n = 7; X = 35,5(clo) thỏa món. @ TH2: n là số chẵn ị F cú dạng XO0,5n; E cú dạng XH(8-n). + Theo giả thiết ta cú: ị khụng cú giỏ trị của n và X thỏa món. 0,25 đ 0,25 đ X1 là HCl; X2 là FeCl3 ; X3 là KClO3 ; X4 là KClO4 ; X5 là KCl ; X6 là KClO ; X7 là HClO(cú thể thay muối kali thành natri). (1): Cl2 + H2 2HCl (2): Fe2O3 + 6HCl 2FeCl3 + 3H2O (3): 2Fe + 3Cl2 2FeCl3 (4): 3Cl2 + 6KOH 5KCl + KClO3 + 3H2O (5): KClO3 + 6HCl KCl + 3Cl2↑ + 3H2O (6): Cl2 + 2K 2KCl (7): KCl + 3H2O KClO3 + 3H2↑ (8): 2KClO3 2KCl + 3O2↑ (9): 4KClO3 KCl + 3KClO4 (10): KClO4 KCl + 2O2↑ (11): KCl + H2O KClO + H2↑ (12): KClO + H2O + CO2 KHCO3 + HClO 3 phản ứng được 0,25 điểm Cõu 7 (2,0 đ) 1. Qui đổi hỗn hợp sắt và oxit sắt thành Fe và O ta cú sơ đồ: + Bảo toàn clo ta cú: 2a + 3b = 0,8 (I) + Bảo toàn H ị 0,8 = 0,08.2 + 2nH2O ị H2O = 0,32 mol; tiếp đú bảo toàn oxi ị nO ban đầu = 0,32 mol (*). + Khi X phản ứng với dung dịch AgNO3 dư ta cú: + AgNO3 dư + Theo sơ đồ và giả thiết ta cú: 143,5.(2a + 3b) + 108a = 132,08 (II) + Từ (I, II) ta cú: a = b = 0,16 mol ị nFe ban đầu = a + b = 0,32 mol (**) + Từ (*, **) ị m = mFe + mO = 23,04 gam. 1,0 đ + Từ giả thiết ta cú sơ đồ: ị trong dung dịch C cú HCl, dung dịch B cú H2SO4 hoặc muối R(HSO4)n ị A cú thể là SO3; H2SO4; H2SO4.nSO3; R(HSO4)n. Phản ứng cú thể xảy ra: SO3 + H2O → H2SO4 (1) H2SO4.nSO3 + nH2O → (n+1)H2SO4 (1)’ H2SO4 + BaCl2→ BaSO4$ + 2HCl (2) R(HSO4)n + nBaCl2 → nBaSO4↓ + RCln + nHCl (2)’ Mg + 2HCl → MgCl2 + H2↑ (3) + Số mol của H2 =0,5 mol ị nHCl = 2nH2 = 1 mol. @ Khả năng 1: A là SO3 Từ (1, 2, 3) ị = 0,5 mol ị = 0,5.80 = 40 gam < 43,6 gam(loại) @ Khả năng 2: A là H2SO4 Từ (2, 3) ị = 0,5 mol ị = 0,5.98 = 49 gam > 43,6 gam(loại) @ Khả năng 3: A là Oleum Từ (1’, 2, 3) ị noleum = ị n = 1,5 ị Cụng thức của (A) là: H2SO4.1,5SO3 hay 2H2SO4.3SO3 @ Khả năng 4: A là muối R(HSO4)n Từ (2’, 3) ị nmuối = ị R = - 53,4n(loại) Mỗi trường hợp đỳng được 0,25 điểm Cõu 8 (1,0 đ) + Giả sử cú 100 gam dung dịch HCl 32,85% ị nHCl== 0,90 mol - Gọi số mol của CaCO3 là x (mol). Phản ứng: CaCO3 + 2HCl đ CaCl2 + H2O + CO2 (1) x 2x x x Từ (1) và đề ra: nHCldư = (0,90 - 2x) mol Khối lượng dung dịch X sau phản ứng (1): 100 + 100x – 44x = (100 + 56x) gam Theo đề ra: C%HCl = = 24,195% ị x = 0,1 mol. ị Sau phản ứng (1) nHCl cũn lại = 0,7 mol. 0,5 đ - Cho MgCO3 vào dung dịch X, cú phản ứng: MgCO3 + 2HCl đ MgCl2 + H2O + CO2 (2) y 2y y y ị Sau phản ứng (2) nHCl dư = 0,7-2y Khối lượng dung dịch Y là: (105,6 + 84y - 44y) gam hay (105,6 + 40y) gam Từ (2) và đề ra: C%HCl trong Y= . 100% = 21,11% ị y = 0,04 mol Dung dịch Y chứa 2 muối CaCl2, MgCl2 và HCl dư: C%(CaCl2) = C%(MgCl2) = 0,5 đ ---------------Hết---------------
Tài liệu đính kèm:
 de_thi_chon_hoc_sinh_gioi_mon_hoa_hoc_lop_10_nam_hoc_2015_20.doc
de_thi_chon_hoc_sinh_gioi_mon_hoa_hoc_lop_10_nam_hoc_2015_20.doc






