Đề kiểm tra lần 1 - Học kì I – Năm học 2015 – 2016 môn hóa . Lớp 10
Bạn đang xem tài liệu "Đề kiểm tra lần 1 - Học kì I – Năm học 2015 – 2016 môn hóa . Lớp 10", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
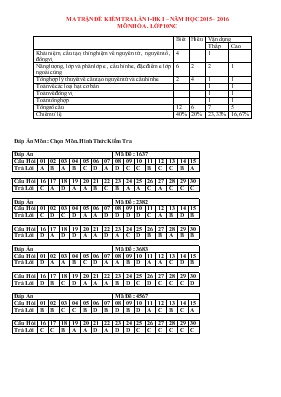
MA TRẬN ĐỀ KIỂM TRA LẦN 1-HK I – NĂM HỌC 2015 – 2016 MÔN HÓA . LỚP 10NC Biết Hiểu Vận dụng Thấp Cao Khái niệm, cấu tạo, thí nghiệm về nguyên tử , nguyên tố , đồng vị 4 1 Năng lượng, lớp và phân lớp e , cấu hình e, đặc điểm e lớp ngoài cùng 6 2 2 1 Tổng hợp lý thuyết về cấu tạo nguyên tử và cấu hình e 2 4 1 1 Toán về các loại hạt cơ bản 1 1 Toán về đồng vị 1 1 Toán tổng hợp 1 1 Tổng số câu 12 6 7 5 Chiếm tỉ lệ 40% 20% 23,33% 16,67% Đáp Án Môn : Chọn Môn. Hình Thức Kiểm Tra Đáp Án Mã Đề : 1637 Câu Hỏi 01 02 03 04 05 06 07 08 09 10 11 12 13 14 15 Trả Lời A B A B C D A D C C B C C B A Câu Hỏi 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 Trả Lời C A D A A B C B A A C A C C C Đáp Án Mã Đề : 2382 Câu Hỏi 01 02 03 04 05 06 07 08 09 10 11 12 13 14 15 Trả Lời C D C D A A D D D D C A B D B Câu Hỏi 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 Trả Lời D A D D A A D A C D B B A B B Đáp Án Mã Đề : 3683 Câu Hỏi 01 02 03 04 05 06 07 08 09 10 11 12 13 14 15 Trả Lời D A A B C D A A B D A A C D B Câu Hỏi 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 Trả Lời D B C D A A A B D C D C C C D Đáp Án Mã Đề : 4567 Câu Hỏi 01 02 03 04 05 06 07 08 09 10 11 12 13 14 15 Trả Lời B B C C B D B D B D A C B C A Câu Hỏi 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 Trả Lời C C B A A D A D D C C C C C C Trường THPT Tân Hiệp KIỂM TRA 1 TIẾT(2015-2016). Họ Tên : . . . . . . . . . . . . . . . . . . . . . . .. . . .. Môn: Hóa Học 10 Cơ bản A (Lớp) : . . . .. Câu 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 Chọn Câu 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 Chọn Cho Câu 01:Một nguyên tử X của một nguyên tố có điện tích của hạt nhân là 2,403.10 – 18 Culông. Cho các nhận định sau về X: (1). Ion tương ứng của X sẽ có cấu trúc là: 1s22s22p63s23p6. (2). X có 9 electron thuộc phân lớp p. (2). X có tổng số hạt mang điện: 30. (4). X là một kim loại. Có bao nhiêu nhận định không đúng trong các nhận định cho ở trên: A). 1 B). 3 C). 4 D). 2 Câu 02:Khối lượng nguyên tử của Bo là 10,812. Mỗi khi có 94 nguyên tử thì có số nguyên tử là A). 410 B). 406 C). 425 D). 442 Câu 03:Trong hạt nhân của nguyên tử của nguyên tố X có tổng số hạt là 65, trong đó số không mang điện nhiều hơn số hạt mang điện là 7. Nguyên tố X là: A). B). C). D). Câu 04:Cặp đồng vị nào là cùng một nguyên tố? A). và B). và C). và D). và Câu 05:Đại lượng không đặc trưng cho một nguyên tố hóa học là A). Số hiệu nguyên tử B). Số proton C). Số nơtron D). Điện tích hạt nhân Câu 06:Đường kính của nguyên tử có cỡ khoảng bao nhiêu? A). 10-8 m B). 10-10 nm C). 10-10 D). 10-8 cm Câu 07:Định nghĩa về đồng vị nào sau đây đúng: A). Đồng vị là tập hợp các nguyên tử có cùng số prôton, khác nhau số nơtron B). Đồng vị là tập hợp các nguyên tử có cùng số nơtron, khác nhau số prôton. C). Đồng vị là tập hợp các nguyên tố có cùng số proton, khác nhau số nơtron D). Đồng vị là tập hợp các nguyên tố có cùng số nơtron, khác nhau số prôton Câu 08:Trong thành phần của mọi nguyên tử nhất thiết phải có các loại hạt nào sau đây? A). Nơtron và electron B). Proton, nơtron, electron C). proton và nơtron D). proton và electron Câu 09:Các đồng vị của 1 nguyên tố hóa học được phân biệt bởi yếu tố nào dưới đây? A). Số proton. B). Số lớp electron C). Số nơtron. D). Số electron hoá trị. Câu 10). Hidro có 3 đồng vị 1H, 2H và 3H . Oxi có 3 đồng vị 16O, 17O, 18O. Các loại phân từ H2O nhận n giá trị phân tử khối. Giá trị của n là A). 18 B). 6 C). 7 D). 9 Câu 11). Từ các ngtử đồng vị của nguyên tố X tạo ra tối đa 6 loại phân tử X2. Từ các nguyên tử đồng vị của nguyên tố Y tạo ra tối đa 3 loại phân tử Y2. Từ các nguyên tử đồng vị của X và Y tạo ra tối đa bao nhiêu loại phân tử X2Y ? A). 6 B). 12 C). 18 D). 9 Câu 12). Nguyên tử R tạo được anion R– . Cấu hình electron ở phân lớp ngoài cùng của R– (ở trạng thái cơ bản) là 3p6. Tổng số hạt mang điện trong anion R– là A). 33. B). 17. C). 35. D). 34. Câu 13). Nguyên tử của các nguyên tố khác nhau, có thể giống nhau về : A). số proton B). số electron C). số nơtron D). số hiệu nguyên tử. Câu 14). Tổng số hạt (n, p, e) trong ion là A). 51. B). 53. C). 35. D). 52. Câu 15). Cho các nguyên tử của các nguyên tố: X (Z1 = 11), Y (Z2 = 15), Z (Z3 = 17), T (Z4 = 20), R (Z5= 24). Có bao nhiêu nguyên tố kim loại ? A). 3 B). 4 C). 2 D). 1 Câu 16). Số electron tối đa ở lớp thứ n là: A). 2n3 B). n C). 2n2 D). n2 Câu 17). Trong tự nhiên, nguyên tố đồng có hai đồng vị là và . Nguyên tử khối trung bình của đồng là 63,54. Thành phần phần trăm tổng số nguyên tử của đồng vị là A). 27% B). 73%. C). 50 D). 54% Câu 18). Cation R2+ có cấu hình electron ở lớp ngoài cùng là 2s22p6. Vậy cấu hình electron của nguyên tử R là A). 1s22s22p5 B). 1s22s22p63s1 C). 1s22s22p63s23p1 D). 1s22s22p63s2 Câu 19). Một nguyên tố X có 3 đồng vị và có mguyên tử lượng trung bình là 68,45 đvC. Đồng vị thứ 1 có 37 nơtron chiếm 75%, đồng vị thứ 2 hơn đồng vị thứ 1 là 1 nơtron chiếm 15%, đồng vị thứ 3 hơn đồng vị thứ 2 là 2 nơtron . Cấu hình electron của X là: A). 1s22s22p63s23p63d104s24p1 B). 1s22s22p63s23p63d104s1 C). 1s22s22p63s23p63d104s2 D). 1s22s22p63s23p63d104s24p2 Câu 20). Cho nguyên tử và nguyên tử . Nhận xét đúng về X, Y là: A). X nhiều hơn Y 1 proton B). X ít hơn Y 2 nơtron. C). X nhiều hơn Y 1 nơtron. D). X ít hơn Y 1 proton Câu 21). Nguyên tử của nguyên tố X có tổng số hạt (p, n, e) bằng 58. Nguyên tố X có thể là A). hoặc B). hoặc C). D). Câu 22). Một anion X n – có cấu hình electron lớp ngoài cùng là 2s22p6. Cấu hình electron lớp ngoài cùng X là A). 3s1 hoặc 3s2 hoặc 3s23p1. B). 3s1 hoặc 2s22p5. C). 2s22p5 hoặc 2s22p4 hoặc 2s22p3 D). 2s22p4 hoặc 3s2. Câu 23). Chọn câu trả lời đúng khi nói về electron trong các lớp hay phân lớp : A). Các electron có mức năng lượng bằng nhau được xếp vào một lớp . B). Khi biết cấu hình electron của nguyên tử có thể dự đoán được loại nguyên tố. C). Các electron có mức năng lượng gần bằng nhau được xếp vào một phân lớp . D). Lớp thứ n có 2n phân lớp . Câu 24). Lớp vỏ nguyên tử của nguyên tố X có điện tích là – 2,8836.10 – 18 Culông. Trong hạt nhân của nguyên tử X có số hạt không mang điện chiếm 67,86%. Số khối của X là A). 38 B). 36 C). 40 D). 41 Câu 25). Nếu cứ chia đôi liên tiếp một mẩu nước đá thì phần tử nhỏ nhất còn mang tính chất đặc trưng của nước là: A). Phân tử nước B). Nguyên tử hiđro C). Nguyên tử hiđro và oxi D). Nguyên tử oxi Câu 26). Thí nghiệm phát hiện ra electron là : A). Dùng hạt a bắn phá hạt nhân nguyên tử beri. B). Cho các hạt a bắn phá lá vàng mỏng và dùng màn huỳnh quang theo dõi đường đi của hạt a. C). Phóng điện giữa hai điện cực có hiệu điện thế 15 kV đặt trong chân không (áp suất khoảng 0,001mmHg). D). Bắn phá nguyên tử nitơ bằng chùm hạt a. Câu 27). Nguyên tử của nguyên tố X có 4 lớp electron. Lớp thứ 4 có 2 electron. Số đơn vị điện tích hạt nhân của nguyên tử X là: A). 20 hoặc 26 B). 26 C). 17 D). 20 Câu 28). Cấu hình electron nào dưới đây không đúng? A). Fe (Z = 26): [Ar] 3d64s2 B). Cr (Z = 24): [Ar] 3d5 4s1 C). O2− (Z = 8): [He] 2s22p4 D). C (Z = 6): [He] 2s22p2 Câu 29). Cation kim loại Mn+ có cấu hình electron lớp ngoài cùng là 2s2 2p6 . Số cấu hình electron lớp vỏ ngoài cùng của nguyên tố M thỏa mãn điều kiện trên là A). 4 B). 1 C). 3 D). 2 Câu 30). Phát biểu nào dưới đây không đúng? A). Số Z đặc trưng cho nguyên tố B). Khối lượng nguyên tử tập trung chủ yếu ở hạt nhân nguyên tử. C). Mỗi nguyên tố được biểu diễn bằng một nguyên tử D). Khối lượng hạt proton xấp xỉ bằng khối lượng hạt nơtron. Trường THPT Tân Hiệp KIỂM TRA 1 TIẾT(2015-2016). Họ Tên : . . . . . . . . . . . . . . . . . . . . . . .. . . .. Môn: Hóa Học 10 Cơ bản A (Lớp) : . . . .. Câu 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 Chọn Câu 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 Chọn Cho Câu 01:Nguyên tử của nguyên tố X có tổng số hạt (p, n, e) bằng 58. Nguyên tố X có thể là A). hoặc B). C). hoặc D). Câu 02:Trong tự nhiên, nguyên tố đồng có hai đồng vị là và . Nguyên tử khối trung bình của đồng là 63,54. Thành phần phần trăm tổng số nguyên tử của đồng vị là A). 54% B). 50 C). 73%. D). 27% Câu 03:Hidro có 3 đồng vị 1H, 2H và 3H . Oxi có 3 đồng vị 16O, 17O, 18O. Các loại phân từ H2O nhận n giá trị phân tử khối. Giá trị của n là A). 9 B). 18 C). 7 D). 6 Câu 04:Phát biểu nào dưới đây không đúng? A). số Z đặc trưng cho nguyên tố B). Khối lượng ngtử tập trung chủ yếu ở hạt nhân nguyên tử. C). Khối lượng hạt proton xấp xỉ bằng khối lượng hạt nơtron. D). Mỗi nguyên tố được biểu diễn bằng một nguyên tử Câu 05:Cặp đồng vị nào là cùng một nguyên tố? A). và B). và C). và D). và Câu 06:Tổng số hạt (n, p, e) trong ion là A). 53. B). 52. C). 35. D). 51. Câu 07:Thí nghiệm phát hiện ra electron là : A). Dùng hạt a bắn phá hạt nhân nguyên tử beri. B). Bắn phá nguyên tử nitơ bằng chùm hạt a. C). Cho các hạt a bắn phá lá vàng mỏng và dùng màn huỳnh quang theo dõi đường đi của hạt a. D). Phóng điện giữa hai điện cực có hiệu điện thế 15 kV đặt trong chân không (áp suất khoảng 0,001mmHg). Câu 08:Một nguyên tố X có 3 đồng vị và có mguyên tử lượng trung bình là 68,45 đvc. Đồng vị thứ 1 có 37 nơtron chiếm 75%, đồng vị thứ 2 hơn đồng vị thứ 1 là 1 nơtron chiếm 15%, đồng vị thứ 3 hơn đồng vị thứ 2 là 2 nơtron . Cấu hình electron của X là: A). 1s22s22p63s23p63d104s1 B). 1s22s22p63s23p63d104s2 C). 1s22s22p63s23p63d104s24p2 D). 1s22s22p63s23p63d104s24p1 Câu 09:Cation R2+ có cấu hình electron ở lớp ngoài cùng là 2s22p6. Vậy cấu hình electron của nguyên tử R là A). 1s22s22p63s23p1 B). 1s22s22p63s1 C). 1s22s22p5 D). 1s22s22p63s2 Câu 10:Chọn câu trả lời đúng khi nói về electron trong các lớp hay phân lớp : A). Lớp thứ n có 2n phân lớp . B). Các electron có mức năng lượng gần bằng nhau được xếp vào một phân lớp . C). Các electron có mức năng lượng bằng nhau được xếp vào một lớp . D). Khi biết cấu hình electron của nguyên tử có thể dự đoán được loại nguyên tố. Câu 11:Trong hạt nhân của nguyên tử của nguyên tố X có tổng số hạt là 65, trong đó số không mang điện nhiều hơn số hạt mang điện là 7. Nguyên tố X là: A). B). C). D). Câu 12:Cấu hình electron nào dưới đây không đúng? A). O2− (Z = 8): [He] 2s22p4 B). C (Z = 6): [He] 2s22p2 C). Cr (Z = 24): [Ar] 3d5 4s1 D). Fe (Z = 26): [Ar] 3d64s2 Câu 13:Từ các ngtử đồng vị của nguyên tố X tạo ra tối đa 6 loại phân tử X2. Từ các nguyên tử đồng vị của nguyên tố Y tạo ra tối đa 3 loại phân tử Y2. Từ các nguyên tử đồng vị của X và Y tạo ra tối đa bao nhiêu loại phân tử X2Y ? A). 18 B). 12 C). 6 D). 9 Câu 14:Nguyên tử của nguyên tố X có 4 lớp electron. Lớp thứ 4 có 2 electron. Số đơn vị điện tích hạt nhân của ngtử X là: A). 26 B). 17 C). 20 D). 20 hoặc 26 Câu 15:Nguyên tử của các nguyên tố khác nhau, có thể giống nhau về : A). số electron B). số nơtron C). số hiệu nguyên tử. D). số proton Câu 16:Đường kính của nguyên tử có cỡ khoảng bao nhiêu? A). 10-10 B). 10-8 m C). 10-10 nm D). 10-8 cm Câu 17:Đại lượng không đặc trưng cho một nguyên tố hóa học là A). Số nơtron B). Điện tích hạt nhân C). Số hiệu nguyên tử D). Số proton Câu 18:Cation kim loại Mn+ có cấu hình electron lớp ngoài cùng là 2s2 2p6 . Số cấu hình electron lớp vỏ ngoài cùng của nguyên tố M thỏa mãn điều kiện trên là A). 2 B). 4 C). 1 D). 3 Câu 19:Các đồng vị của 1 nguyên tố hóa học được phân biệt bởi yếu tố nào dưới đây? A). Số proton. B). Số lớp electron C). Số electron hoá trị. D). Số nơtron. Câu 20:Cho nguyên tử và nguyên tử . Nhận xét đúng về X, Y là: A). X nhiều hơn Y 1 proton B). X ít hơn Y 1 proton C). X nhiều hơn Y 1 nơtron. D). X ít hơn Y 2 nơtron. Câu 21:Lớp vỏ nguyên tử của nguyên tố X có điện tích là – 2,8836.10 – 18 Culông. Trong hạt nhân của nguyên tử X có số hạt không mang điện chiếm 67,86%. Số khối của X là A). 38 B). 40 C). 41 D). 36 Câu 22:Số electron tối đa ở lớp thứ n là: A). n B). n2 C). 2n3 D). 2n2 Câu 23:Cho các nguyên tử của các nguyên tố: X (Z1 = 11), Y (Z2 = 15), Z (Z3 = 17), T (Z4 = 20), R (Z5= 24). Có bao nhiêu nguyên tố kim loại ? A). 3 B). 1 C). 2 D). 4 Câu 24:Nếu cứ chia đôi liên tiếp một mẩu nước đá thì phần tử nhỏ nhất còn mang tính chất đặc trưng của nước là: A). Nguyên tử oxi B). Nguyên tử hiđro và oxi C). Phân tử nước D). Nguyên tử hiđro Câu 25:Một nguyên tử X của một nguyên tố có điện tích của hạt nhân là 2,403.10 – 18 Culông. Cho các nhận định sau về X: (1). Ion tương ứng của X sẽ có cấu trúc là: 1s22s22p63s23p6. (2). X có 9 electron thuộc phân lớp p. (2). X có tổng số hạt mang điện: 30. (4). X là một kim loại. Có bao nhiêu nhận định không đúng trong các nhận định cho ở trên: A). 2 B). 3 C). 4 D). 1 Câu 26:Định nghĩa về đồng vị nào sau đây đúng: A). Đồng vị là tập hợp các nguyên tử có cùng số nơtron, khác nhau số prôton. B). Đồng vị là tập hợp các nguyên tử có cùng số prôton, khác nhau số nơtron C). Đồng vị là tập hợp các nguyên tố có cùng số nơtron, khác nhau số prôton D). Đồng vị là tập hợp các nguyên tố có cùng số proton, khác nhau số nơtron Câu 27:Nguyên tử R tạo được anion R– . Cấu hình electron ở phân lớp ngoài cùng của R– (ở trạng thái cơ bản) là 3p6. Tổng số hạt mang điện trong anion R– là A). 17. B). 35. C). 34. D). 33. Câu 28:Trong thành phần của mọi nguyên tử nhất thiết phải có các loại hạt nào sau đây? A). proton và electron B). Nơtron và electron C). proton và nơtron D). Proton, nơtron, electron Câu 29:Một anion X n – có cấu hình electron lớp ngoài cùng là 2s22p6. Cấu hình electron lớp ngoài cùng X là A). 3s1 hoặc 2s22p5. B). 2s22p5 hoặc 2s22p4 hoặc 2s22p3 C). 2s22p4 hoặc 3s2. D). 3s1 hoặc 3s2 hoặc 3s23p1. Câu 30:Khối lượng nguyên tử của Bo là 10,812. Mỗi khi có 94 nguyên tử thì có số nguyên tử là A). 425 B). 406 C). 442 D). 410 Trường THPT Tân Hiệp KIỂM TRA 1 TIẾT(2015-2016). Họ Tên : . . . . . . . . . . . . . . . . . . . . . . .. . . .. Môn: Hóa Học 10 Cơ bản A Lớp: . . . .. Câu 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 Chọn Câu 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 Chọn Cho Câu 01:Khối lượng nguyên tử của Bo là 10,812. Mỗi khi có 94 nguyên tử thì có số nguyên tử là A). 425 B). 442 C). 410 D). 406 Câu 02:Trong hạt nhân của nguyên tử của nguyên tố X có tổng số hạt là 65, trong đó số không mang điện nhiều hơn số hạt mang điện là 7. Nguyên tố X là: A). B). C). D). Câu 03:Nguyên tử của nguyên tố X có 4 lớp electron. Lớp thứ 4 có 2 electron. Số đơn vị điện tích hạt nhân của nguyên tử X là: A). 20 hoặc 26 B). 20 C). 26 D). 17 Câu 04:Một anion X n – có cấu hình e lớp ngoài cùng là 2s22p6. Cấu hình electron lớp ngoài cùng X là A). 3s1 hoặc 3s2 hoặc 3s23p1. B). 2s22p5 hoặc 2s22p4 hoặc 2s22p3 C). 3s1 hoặc 2s22p5. D). 2s22p4 hoặc 3s2. Câu 05:Một nguyên tử X của một nguyên tố có điện tích của hạt nhân là 2,403.10 – 18 Culông. Cho các nhận định sau về X: (1). Ion tương ứng của X sẽ có cấu trúc là: 1s22s22p63s23p6. (2). X có 9 electron thuộc phân lớp p. (2). X có tổng số hạt mang điện: 30. (4). X là một kim loại. Có bao nhiêu nhận định không đúng trong các nhận định cho ở trên: A). 4 B). 3 C). 1 D). 2 Câu 06:Các đồng vị của 1 nguyên tố hóa học được phân biệt bởi yếu tố nào dưới đây? A). Số lớp electron B). Số proton. C). Số electron hoá trị.D). Số nơtron. Câu 07:Cho các nguyên tử của các nguyên tố: X (Z1 = 11), Y (Z2 = 15), Z (Z3 = 17), T (Z4 = 20), R (Z5= 24). Có bao nhiêu nguyên tố kim loại ? A). 3 B). 2 C). 4 D). 1 Câu 08:Nguyên tử R tạo được anion R– . Cấu hình electron ở phân lớp ngoài cùng của R– (ở trạng thái cơ bản) là 3p6. Tổng số hạt mang điện trong anion R– là A). 35. B). 33. C). 34. D). 17. Câu 09:Định nghĩa về đồng vị nào sau đây đúng: A). Đồng vị là tập hợp các nguyên tố có cùng số nơtron, khác nhau số prôton B). Đồng vị là tập hợp các nguyên tử có cùng số prôton, khác nhau số nơtron C). Đồng vị là tập hợp các nguyên tố có cùng số proton, khác nhau số nơtron D). Đồng vị là tập hợp các nguyên tử có cùng số nơtron, khác nhau số prôton. Câu 10:Nguyên tử của nguyên tố X có tổng số hạt (p, n, e) bằng 58. Nguyên tố X có thể là A). B). C). hoặc D). hoặc Câu 11:Cho nguyên tử và nguyên tử . Nhận xét đúng về X, Y là: A). X nhiều hơn Y 1 proton B). X ít hơn Y 2 nơtron. C). X ít hơn Y 1 proton D). X nhiều hơn Y 1 nơtron. Câu 12:Đại lượng không đặc trưng cho một nguyên tố hóa học là A). Số nơtron B). Điện tích hạt nhân C). Số hiệu nguyên tử D). Số proton Câu 13:Cation R2+ có cấu hình electron ở lớp ngoài cùng là 2s22p6. Vậy cấu hình electron của nguyên tử R là A). 1s22s22p63s1 B). 1s22s22p5 C). 1s22s22p63s2 D). 1s22s22p63s23p1 Câu 14:Thí nghiệm phát hiện ra electron là : A). Dùng hạt a bắn phá hạt nhân nguyên tử beri. B). Bắn phá nguyên tử nitơ bằng chùm hạt a. C). Cho các hạt a bắn phá lá vàng mỏng và dùng màn huỳnh quang theo dõi đường đi của hạt a. D). Phóng điện giữa hai điện cực có hiệu điện thế 15 kV đặt trong chân không (áp suất khoảng 0,001mmHg). Câu 15:Một nguyên tố X có 3 đồng vị và có mguyên tử lượng trung bình là 68,45 đvc. Đồng vị thứ 1 có 37 nơtron chiếm 75%, đồng vị thứ 2 hơn đồng vị thứ 1 là 1 nơtron chiếm 15%, đồng vị thứ 3 hơn đồng vị thứ 2 là 2 nơtron . Cấu hình electron của X là: A). 1s22s22p63s23p63d104s2 B). 1s22s22p63s23p63d104s24p1 C). 1s22s22p63s23p63d104s1 D). 1s22s22p63s23p63d104s24p2 Câu 16:Trong thành phần của mọi nguyên tử nhất thiết phải có các loại hạt nào sau đây? A). Nơtron và electron B). Proton, nơtron, electron C). proton và nơtron D). proton và electron Câu 17:Lớp vỏ nguyên tử của nguyên tố X có điện tích là – 2,8836.10 – 18 Culông. Trong hạt nhân của nguyên tử X có số hạt không mang điện chiếm 67,86%. Số khối của X là A). 40 B). 38 C). 41 D). 36 Câu 18:Nếu cứ chia đôi liên tiếp một mẩu nước đá thì phần tử nhỏ nhất còn mang tính chất đặc trưng của nước là: A). Nguyên tử oxi B). Nguyên tử hiđro C). Phân tử nước D). Nguyên tử hiđro và oxi Câu 19:Hidro có 3 đồng vị 1H, 2H và 3H . Oxi có 3 đồng vị 16O, 17O, 18O. Các loại phân từ H2O nhận n giá trị phân tử khối. Giá trị của n là A). 9 B). 18 C). 6 D). 7 Câu 20:Cation kim loại Mn+ có cấu hình electron lớp ngoài cùng là 2s2 2p6 . Số cấu hình electron lớp vỏ ngoài cùng của nguyên tố M thỏa mãn điều kiện trên là A). 3 B). 4 C). 1 D). 2 Câu 21:Cấu hình electron nào dưới đây không đúng? A). O2− (Z = 8): [He] 2s22p4 B). C (Z = 6): [He] 2s22p2 C). Fe (Z = 26): [Ar] 3d64s2 D). Cr (Z = 24): [Ar] 3d5 4s1 Câu 22:Phát biểu nào dưới đây không đúng? A). Mỗi nguyên tố được biểu diễn bằng một nguyên tử B). Khối lượng hạt proton xấp xỉ bằng khối lượng hạt nơtron. C). số Z đặc trưng cho nguyên tố D). Khối lượng ngtử tập trung chủ yếu ở hạt nhân nguyên tử. Câu 23:Chọn câu trả lời đúng khi nói về electron trong các lớp hay phân lớp : A). Các electron có mức năng lượng gần bằng nhau được xếp vào một phân lớp . B). Khi biết cấu hình electron của nguyên tử có thể dự đoán được loại nguyên tố. C). Các electron có mức năng lượng bằng nhau được xếp vào một lớp . D). Lớp thứ n có 2n phân lớp . Câu 24:Số electron tối đa ở lớp thứ n là: A). 2n3 B). n C). n2 D). 2n2 Câu 25:Trong tự nhiên, nguyên tố đồng có hai đồng vị là và . Nguyên tử khối trung bình của đồng là 63,54. Thành phần phần trăm tổng số nguyên tử của đồng vị là A). 50 B). 54% C). 27% D). 73%. Câu 26:Đường kính của nguyên tử có cỡ khoảng bao nhiêu? A). 10-8 m B). 10-10 C). 10-10 nm D). 10-8 cm Câu 27:Tổng số hạt (n, p, e) trong ion là A). 51. B). 35. C). 53. D). 52. Câu 28:Từ các ngtử đồng vị của nguyên tố X tạo ra tối đa 6 loại phân tử X2. Từ các n
Tài liệu đính kèm:
 de_kiem_tra_1_tiet_lop_10_chuong_1.doc
de_kiem_tra_1_tiet_lop_10_chuong_1.doc





