Đề kiểm tra học kỳ II môn Hóa học Lớp 8 - Năm học 2015-2016 - Trường PTDTBT TH - THCS Long Túc (Có đáp án)
Bạn đang xem tài liệu "Đề kiểm tra học kỳ II môn Hóa học Lớp 8 - Năm học 2015-2016 - Trường PTDTBT TH - THCS Long Túc (Có đáp án)", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
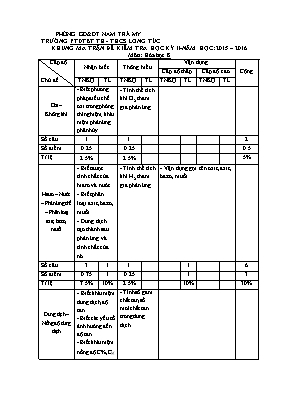
PHÒNG GD&ĐT NAM TRÀ MY TRƯỜNG PTDTBT TH - THCS LONG TÚC KHUNG MA TRẬN ĐỀ KIỂM TRA HỌC KỲ II-NĂM HỌC: 2015 – 2016 Môn: Hóa học 8 Cấp độ Chủ đề Nhận biết Thông hiểu Vận dụng Cộng Cấp độ thấp Cấp độ cao TNKQ TL TNKQ TL TNKQ TL TNKQ TL Oxi – Không khí - Biết phương pháp điều chế oxi trong phòng thí nghiệm; khái niệm phản ứng phân hủy. - Tính thể tích khí O2 tham gia phản ứng. Số câu 1 1 2 Số điểm 0.25 0.25 0.5 Tỉ lệ 2.5% 2.5% 5% Hiđro – Nước – Phản ứng thế – Phân loại axit, bazơ, muối - Biết được tính chất của hiđro và nước. - Biết phân loại axit, bazơ, muối - Dung dịch tạo thành sau phản ứng và tính chất của nó. - Tính thể tích khí H2 tham gia phản ứng. - Vận dụng gọi tên oxit, axit, bazơ, muối. Số câu 3 1 1 1 6 Số điểm 0.75 1 0.25 1 3 Tỉ lệ 7.5% 10% 2.5% 10% 30% Dung dịch – Nồng độ dung dịch - Biết khái niệm dung dịch, độ tan. - Biết các yếu tố ảnh hưởng đến độ tan. - Biết khái niệm nồng độ C%,CM - Tính số gam chất tan, số mol chất tan trong dung dịch. Số câu 4 2 6 Số điểm 1 0.5 1.5 Tỉ lệ 10% 5% 15% Tổng hợp các nội dung trên - Tính số mol và viết PTHH xảy ra. - Viết PTHH biểu diễn sơ đồ chuyển hóa mối quan hệ giữa các chất. - Tính toán dựa theo phương trình; so sánh tỉ lệ giữa số mol để suy ra được chất phản ứng hết, chất còn dư Số câu 1/3 1 1/3 1/3 2 Số điểm 1 2 1 1 5 10% 20% 10% 10% 50% Tổng số câu 9+1/3 5 1+2/3 16 Tổng số điểm 4 3 3 10 Tỉ lệ 40% 30% 30% 100% PHÒNG GD&ĐT NAM TRÀ MY TRƯỜNG PTDTBT TH - THCS LONG TÚC ĐỀ KIỂM TRA HỌC KỲ II NĂM HỌC 2015 - 2016 Môn: Hóa học 8 Thời gian: 45 phút (Không kể thời gian giao đề) Đề chính thức Điểm Nhận xét của giáo viên Họ và tên:.................................. Lớp: ........................................ I. Trắc nghiệm: (3 điểm) Khoanh tròn chữ cái (A, B, C, D) đứng trước câu trả lời đúng Câu 1. Phản ứng nào sau đây là phản ứng phân hủy? A. CO2 + Ca(OH)2 CaCO3 + H2O B. CaO + H2O Ca(OH)2 C. 2KMnO4 K2MnO4 + MnO2 + O2 D. CuO + H2Cu + H2O Câu 2. Dung dịch tạo thành khi cho nước hóa hợp với Na2O sẽ làm cho quỳ tím chuyển sang màu gì? A. Màu đỏ B. Màu xanh C. Màu vàng D. Không đổi màu Câu 3. Khử 12g sắt (III) oxit bằng khí hiđro ở nhiệt độ cao. Thể tích khí hiđro(ở đktc) cần dùng là: A. 5,04 lít B. 7,56 lít C. 10,08 lít D. 8,2 lít Câu 4. Dãy nào sau đây gồm các chất đều thuộc loại axit? A. H3PO4, S, NaOH B. H3PO4, CuO, Na2CO3 C. HNO3, K, KCl D. HCl, H2S, H2SO4 Câu 5. Khối lượng NaOH có trong 20 gam dung dịch NaOH 10% là: A. 20 (g) B. 2 (g) C. 0,2 (g) D. 0,02 (g) Câu 6. Để tổng hợp nước người ta đã đốt cháy hoàn toàn 4,48 lít khí hiđro (đktc) trong oxi. Thể tích khí oxi (đktc) cần dùng là: A. 44,8 lít B. 4,48 lít C. 2,24 lít D. 22,4 lít Câu 7. Trộn 5 ml rượu etylic (cồn) với 10 ml nước cất. Câu nào sau đây diễn đạt đúng: A. Chất tan là rượu, dung môi là nước. B. Chất tan là nước, dung môi là rượu. C. Nước hoặc rượu etylic có thể là chất tan hoặc là dung môi. D. Cả 2 chất nước và rượu etylic vừa là chất tan vừa là dung môi. Câu 8. Khi giảm nhiệt độ và tăng áp suất thì độ tan của chất khí trong nước thay đổi như thế nào? A. Giảm B. Không thay đổi C. Có thể tăng hoặc giảm D. Tăng Câu 9. Dung dịch NaCl 1M có nghĩa là: A. Trong 100 gam dung dịch có 1 gam NaCl. B. Trong 100 gam dung dịch có 1 mol NaCl. C. Trong 1 lít dung dịch có 1 mol NaCl. D. Trong 1000 ml dung dịch có 10 mol NaCl. Câu 10. Dung dịch là hỗn hợp: A. Của chất rắn trong chất lỏng. B. Của chất khí trong chất lỏng. C. Đồng nhất của chất rắn và dung môi. D. Đồng nhất của dung môi và chất tan. Câu 11. Có thể thu khí hidro bằng phương pháp đẩy nước và đẩy không khí vì hidro: A. Là chất khí B. Nhẹ hơn không khí và ít tan trong nước C. Nặng hơn không khí D. Có nhiệt độ hóa lỏng thấp Câu 12. Số mol Na2CO3 có trong 100 ml dung dịch 2M là: A. 0,1 mol B. 0,15 mol C. 0,25 mol D. 0,2 mol II. Tự luận: (7 điểm) Câu 1. (1 điểm) Trình bày tính chất hóa học của nước và viết các phương trình hóa học minh họa. Câu 2. (2 điểm) Hoàn thành dãy chuyển hóa sau (ghi rõ điều kiện phản ứng): KClO3O2Fe3O4 Fe FeSO4 Câu 3. (1 điểm) Đọc tên các hợp chất sau: a. PbO b. NaHCO3 c. Fe(OH)2 d. HNO3 Câu 4. (3 điểm) Khi cho 0,2 mol kẽm tác dụng với dung dịch có chứa 49 gam axit sunfuric. a. Viết phương trình phản ứng? b. Sau phản ứng chất nào còn dư? c. Tính thể tích khí hiđro thu được (ở đktc)? (Biết: S = 32; O = 16; H = 1; Zn = 65; Fe=56) ................hết............... PHÒNG GD&ĐT NAM TRÀ MY TRƯỜNG PTDTBT TH - THCS LONG TÚC ĐỀ KIỂM TRA HỌC KỲ II-NĂM HỌC: 2015 - 2016 Hướng dẫn chấm môn Hóa học 8 I. Trắc nghiệm: (3 điểm) Đáp án đúng 0.25 đ/câu Câu 1 2 3 4 5 6 7 8 9 10 11 12 Đáp án C B A D B C A D C C B D II. Tự luận: (7 điểm) Câu Đáp án Biểu điểm Câu 1 (1 điểm) - Nêu được 3 tính chất hóa học của nước - Tác dụng với kim loại: 2Na + H2O 2NaOH + H2 - Tác dụng với oxit bazơ: BaO + H2O Ba(OH)2 - Tác dụng với oxit axit: SO3 + H2O H2SO4 0.25 0.25 0.25 0.25 Câu 2 (2 điểm) 2KClO3 2KCl + 3O2 3Fe + 2O2 Fe3O4 Fe3O4 + 4H2 3Fe + 4H2O Fe + H2SO4 FeSO4 + H2 Lưu ý: - Viết sai công thức không ghi điểm - Chưa cân bằng hoặc thiếu điều kiện: - 0,25đ/pthh 0.5 0.5 0.5 0.5 Câu 3 (1 điểm) a. PbO: Chì oxit b. NaHCO3: Natri hiđrocacbonat c. Fe(OH)2: Sắt (II) hiđroxit d. HNO3: Axit nitric 0.25 0.25 0.25 0.25 Câu 4 (3 điểm) n= = 0,5 (mol) a. Phương trình phản ứng: Zn + H2SO4 ZnSO4 + H2 1 mol 1 mol 1 mol 1 mol Đề bài: 0,2 mol 0,5 mol 0,2 mol b. Dựa theo PTHH trên ta có tỉ lệ: < nên axit H2SO4 còn dư, kim loại Zn tham gia phản ứng hóa học hết sau phản ứng. c. Tính thể tích khí hiđro thu được theo số mol kim loại kẽm: n= n= 0,2 (mol) V= 0,2 22,4 =4,48 (lít) Lưu ý: - HS làm cách khác đúng vẫn tính điểm. 0.5 0.5 0.5 0.5 0.5 0.5
Tài liệu đính kèm:
 de_kiem_tra_hoc_ky_ii_mon_hoa_hoc_lop_8_nam_hoc_2015_2016_tr.doc
de_kiem_tra_hoc_ky_ii_mon_hoa_hoc_lop_8_nam_hoc_2015_2016_tr.doc






