Đề kiểm tra học kì II Hóa 8 (Tiết 70)
Bạn đang xem tài liệu "Đề kiểm tra học kì II Hóa 8 (Tiết 70)", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
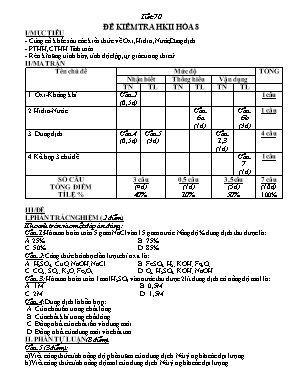
Tiết 70 ĐỀ KIỂM TRA HKII HÓA 8 I/MỤC TIÊU - Củng cố khắc sâu các kiến thức về Oxi,Hiđro,Nước,Dung dịch - PTHH,CTHH.Tính toán - Rèn kĩ năng trình bày, tính độc lập, tự giác trong thi cử II/MA TRẬN Tên chủ đề Mức độ TỔNG Nhận biết Thông hiểu Vận dụng TN TL TN TL TN TL 1. Oxi- Không khí Câu 2 (0,5đ) 1câu 2.Hiđro- Nước Câu 6a (1đ) Câu 6b (3đ) 1 câu 3. Dung dịch Câu 4 (0,5đ) Câu 5 (3đ) Câu 1,3 (1đ) 4 câu 4.Kết hợp 3 chủ đề Câu 7 (1đ) 1câu SỐ CÂU TỔNG ĐIỂM TỈ LỆ % 3 câu (4đ) 40% 0,5 câu (1đ) 10% 3,5câu (5đ) 50% 7 câu (10đ) 100% III/ĐỀ I.PHẦN TRẮC NGHIỆM (2 điểm) Khoanh tròn vào một đáp án đúng : Câu 1:Hòa tan hoàn toàn 5 gam NaCl vào 15 gam nước.Nồng độ % dung dịch thu được là: A.25% B. 75% C. 50% D. 85% Câu 2: Công thức hóa học lần lượt chỉ oxit là: A. H2SO4; CuO; NaOH; NaCl B. FeSO4; H2; KOH; Fe2O3 C. CO2; SO2; K2O; Fe2O3 D. O2; H2SO4; KOH; NaOH Câu 3: Hòa tan hoàn toàn 1mol H2SO4 vào nước thu được 2lít dung dịch có nồng độ mol là: A. 1M B. 0,5M C. 2M. D. 1,5M Câu 4: Dung dịch là hỗn hợp: A. Của chất rắn trong chất lỏng. B. Của chất khí trong chất lỏng. C. Đồng nhất của chất rắn và dung môi D. Đồng nhất của dung môi và chất tan. II. PHẦN TỰ LUẬN (8 điểm) Câu 5 (3điểm): a)Viết công thức tính nồng độ phần trăm của dung dịch.Nêu ý nghĩa các đại lượng. b)Viết công thức tính nồng độ mol của dung dịch.Nêu ý nghĩa các đại lượng. Câu6( 4điểm ): Cho sơ đồ phản ứng sau: a) Lập phương trình hóa học b) Tính khối lượng sắt tham gia,biết có 2,24 lit khí hiđro tạo thành ở đktc. Câu7(1điểm): Tính số gam nước tạo thành được khi cho 16,8 lít khí hiđro tác dụng với 5,6 lít khí oxi(các thể tích đo ở đktc). (Cho biết Fe = 56;H = 1; O = 16;Cl = 35,5) III/ĐÁP ÁN + BIỂU ĐIỂM I.Phần trắc nghiệm: Câu 1 2 3 4 Đáp án A C B D Biểu điểm 0,5đ 0,5đ 0,5đ 0,5đ II.Phần tự luận (8đ) Câu 5 3đ a)Viết công thức đúng và nêu ý nghĩa đúng b)Viết công thức đúng và nêu ý nghĩa đúng 1,5đ 1,5đ Câu 6 4đ a) PTHH : Theo pthh 1đ 1đ 1đ 1đ Câu 7 2H2 + O2 2H2O Ta có Như vậy khí hiđro dư.khối lượng nước tính theo khí oxi. = =5,6/22,4 = 0,25 mol Theo pthh: = 2.0,25 = 0,5 mol 0,5.18 = 9 (g) 1đ Nếu HS giải theo cách khác mà đúng thì vẫn cho điểm tuyệt đối DUYỆT CỦA TỔ CHUYÊN MÔN DUYỆT CHUYÊN MÔN Người ra đề Võ Thành Viên Trường THCS Tô Hiệu Họ và Tên:...................................................... Lớp: 8A..... KIỂM TRA HK II (2015-2016) MÔN: HÓA HỌC 8 TG: 45’ Điểm Lời phê của thầy, cô giáo. I.PHẦN TRẮC NGHIỆM (2 điểm) Khoanh tròn vào một đáp án đúng : Câu 1:Hòa tan hoàn toàn 5 gam NaCl vào 15 gam nước.Nồng độ % dung dịch thu được là: A.25% B. 75% C. 50% D. 85% Câu 2: Công thức hóa học lần lượt chỉ oxit là: A. H2SO4; CuO; NaOH; NaCl B. FeSO4; H2; KOH; Fe2O3 C. CO2; SO2; K2O; Fe2O3 D. O2; H2SO4; KOH; NaOH Câu 3: Hòa tan hoàn toàn 1mol H2SO4 vào nước thu được 2lít dung dịch có nồng độ mol là: A. 1M B. 0,5M C. 2M. D. 1,5M Câu 4: Dung dịch là hỗn hợp: A. Của chất rắn trong chất lỏng. B. Của chất khí trong chất lỏng. C. Đồng nhất của chất rắn và dung môi D. Đồng nhất của dung môi và chất tan. II. PHẦN TỰ LUẬN (8 điểm) Câu 5 (3điểm): a)Viết công thức tính nồng độ phần trăm của dung dịch.Nêu ý nghĩa các đại lượng. b)Viết công thức tính nồng độ mol của dung dịch.Nêu ý nghĩa các đại lượng. Câu6( 4điểm ): Cho sơ đồ phản ứng sau: a) Lập phương trình hóa học b) Tính khối lượng sắt tham gia,biết có 2,24 lit khí hiđro tạo thành ở đktc. Câu7(1điểm): Tính số gam nước tạo thành được khi cho 16,8 lít khí hiđro tác dụng với 5,6 lít khí oxi(các thể tích đo ở đktc). (Cho biết Fe = 56;H = 1; O = 16;Cl = 35,5) BÀI LÀM
Tài liệu đính kèm:
 HK2_2015_2016.doc
HK2_2015_2016.doc





