Đề kiểm tra học kì I năm học 2015 - 2016 môn: Hóa học khối 8
Bạn đang xem tài liệu "Đề kiểm tra học kì I năm học 2015 - 2016 môn: Hóa học khối 8", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
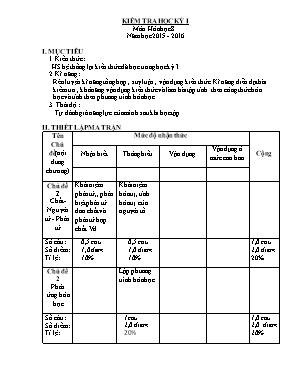
KIỂM TRA HỌC KỲ I Mụn Húa học 8 Năm học 2015 - 2016 I. MỤC TIấU 1. Kiến thức : HS hệ thống lại kiến thức đó học trong học kỳ I 2. Kĩ năng : Rốn luyện kĩ năng tổng hợp , suy luận , vận dụng kiến thức .Kĩ năng diễn đạt bài kiểm tra , khả năng vận dụng kiến thức và làm bài tập tớnh theo cụng thức húa học và tớnh theo phương trỡnh húa học. 3. Thỏi độ : Tự đỏnh giỏ năng lực của mỡnh sau khi học tập. II. THIẾT LẬP MA TRẬN Tờn Chủ đề(nội dung chương) Mức độ nhận thức Cộng Nhận biết Thụng hiểu Vận dụng Vận dụng ở mức cao hơn Chủ đề 1 Chất- Nguyờn tử - Phõn tử Khỏi niệm phõn tử,, phõn biệt phõn tử đơn chất và phõn tử hợp chất.Vd. Khỏi niệm húa trị, tớnh húa trị của nguyờn tố. Số cõu: Số điểm: Tỉ lệ: 0,5 cõu 1,0điểm 10% 0,5 cõu 1,0 điểm 10% 1,0 cõu 2,0 điểm 20% Chủ đề 2 Phản ứng húa học Lập phương trỡnh húa học. Số cõu: Số điểm: Tỉ lệ: 1cõu 2,0 điểm 20% 1,0 cõu 2,0 điểm 20% Chủ đề 3 Mol và tớnh toỏn húa học Tớnh theo phương trỡnh húa học Tớnh theo cụng thức húa học, tỉ khối của chất khớ Số cõu: Số điểm: Tỉ lệ: 1,0 cõu 3,0 điểm 30% 2,0 cõu 3,0 điểm 30% 3cõu 6,0 điểm 60% Tổng số cõu: T/số điểm: Tỉ lệ%: 0,5 cõu 1,0 điểm 10% 1,5 cõu 2,5 điểm 25% 1,0 cõu 3,0 điểm 30% 2,0 cõu 3,0 điểm 30% 5 cõu 10 điểm 100% III. ĐỀ KIỂM TRA Trường THCS Hũa Đụng ĐỀ KIỂM TRA HỌC Kè I Họ và tờn: Mụn: Húa Học 8 Lớp: Thời gian: 45’ -----------------o0o-------------------- Cõu 1: (2,0 điểm) a) Phõn tử là gỡ? Phõn tử của hợp chất cú gỡ khỏc so với phõn tử của đơn chất? Lấy vớ dụ minh họa. b) Húa trị của một nguyờn tố (hay nhúm nguyờn tử) là gỡ? Tớnh húa trị của nguyờn tố nitơ trong hợp chất : N2O5 . Cõu 2(2,0 điểm). Hoàn thành cỏc phương trỡnh phản ứng sau : a) Fe + O 2 -----> Fe 2 O 3 b) Al + Cu(NO 3 ) 2 ------> Al(NO 3 ) 3 + Cu c) Na2SO4 + BaCl2 ------> BaSO4 + NaCl d) Na2CO3 + HCl -------> NaCl + H2O + CO2 Cõu 3 (2,0 điểm). Một chất khớ X chứa 27,27% C và 72,73% O về khối lượng. Tỉ khối của X đối với khụng khớ là 1,517. Tỡm cụng thức húa học của X. Cõu 4 (3,0 điểm). Đốt 5,4 (g) nhụm (Al) trong bỡnh chứa khớ oxi (O2) thỡ thu được nhụm oxit (Al2O3). a) Tớnh số mol nhụm đó tham gia phản ứng. b) Lập phương trỡnh húa học. c) Tớnh thể tớch khớ oxi cần dựng (đktc). d) Tớnh khối lượng nhụm oxit thu được. Cõu 5 (1,0 điểm). Hàm lượng nguyờn tố N trong hợp chất nào sau đầy là cao hơn: N2O và N2O5. ( Cho H=1; C = 12 ; N = 14;O = 16; Al = 27) IV. ĐÁP ÁN -_BIỂU ĐIỂM Cõu 1: a) Phỏt biểu đỳng : - Khỏi niệm phõn tử..........................................................................(0,25 điểm) - Phõn biệt phõn tử đơn chất với phõn tử hợp chất...........................(0,5 điểm) - Vớ dụ...............................................................................................(0,25 điểm) b) - Khỏi niệm húa trị ............................................................................(0,5 điểm) - Húa trị của N : Gọi húa trị của N trong h/c N2O5 là a. Theo QTHT, ta cú : a. 2 = II.5 à a = V. Vậy N cú húa trị V....................................(0,5 điểm) Cõu 2: a) 4Fe + 3O 2 đ 2Fe 2 O 3 ...........................................................(0,5 điểm) b) 2Al + 3Cu(NO 3 ) 2 đ 2Al(NO 3 ) 3 + 3Cu .....................(0,5 điểm) c) Na2SO4 + BaCl2 đ BaSO4 + 2NaCl..............................(0,5 điểm) d) Na2CO3 + 2 HCl đ 2NaCl + H2O + CO2 ............(0,5 điểm) Cõu 3: M X = 1,517 . 29 = 44g .........................................................(0,5 điểm) m C = 12g .............................................................................. (0,25 điểm) m O = 32g ...............................................................................(0,25 điểm) n C = 1(mol) ...........................................................................(0,25 điểm) n O = 2(mol) ...........................................................................(0,25 điểm) Suy ra được CTHH: CO 2 ........................................................(0,5 điểm) Cõu 4: n Al = ( mol) ..........................................................(0,5điểm) 4Al + 3O2 đ 2Al2O3 (0,5điểm) 4mol 3mol 2mol 0,2mol 0,15mol 0,1mol c) ...............................................(0,5điểm) ...........................................................(0,5điểm) d) ..............................................(0,5điểm) ...................................................(0,5điểm) Cõu 5 : - Hàm lượng nguyờn tố N trong hợp chất N2O: ........................(0,5điểm) - Hàm lượng nguyờn tố N trong hợp chất N2O5: ........................(0,5điểm) Vậy Hàm lượng nguyờn tố N trong hợp chất N2O là cao hơn.
Tài liệu đính kèm:
 ĐỀ Ktki I hoa8- 2015-2016.doc
ĐỀ Ktki I hoa8- 2015-2016.doc





