Đề kiểm tra học kì I - Lớp 10 năm học 2014 - 2015 môn: Hóa học. Chương trình chuẩn
Bạn đang xem tài liệu "Đề kiểm tra học kì I - Lớp 10 năm học 2014 - 2015 môn: Hóa học. Chương trình chuẩn", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
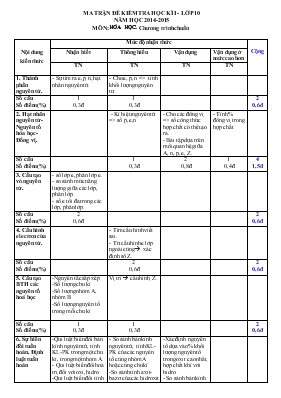
MA TRẬN ĐỀ KIỂM TRA HỌC KÌ I - LỚP 10 NĂM HỌC 2014-2015 MÔN: HOÙA HOÏC. Chương trình chuẩn Nội dung kiến thức Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng Vận dụng ở mức cao hơn TN TN TN TN 1. Thành phần nguyên tử. - Sự tìm ra e,p, n, hạt nhân nguyên tử. - Cho e, p, n => tính khối lượng nguyên tư Số câu Số điểm(%) 1 0,3đ 1 0,3đ 2 0,6đ 2. Hạt nhân nguyên tử- Nguyên tố hóa học- Đồng vị. - Kí hiệu nguyên tử => số p,e,n. - Cho các đồng vị => số công thức hợp chất có thể tạo ra. - Bài tập dựa trên mối quan hệ giữa A, n, p, e, Z. - Tính % đồng vị trong hợp chất. Số câu Số điểm(%) 1 0,3đ 2 0,8đ 1 0,4đ 4 1,5đ 3. Cấu tạo vỏ nguyên tử. - số lớp e, phân lớp e. - so sánh mức năng lượng giữa các lớp, phân lớp. - số e tối đa trong các lớp, phân lớp. Số câu Số điểm(%) 2 0,6đ 2 0,6đ 4. Cấu hình electron của nguyên tử. - Tìm cấu hình viết sai. - Từ cấu hình e lớp ngoài cùng à xác định số Z. Số câu Số điểm(%) 2 0,6đ 2 0,6đ 5. Cấu tạo BTH các nguyên tố hoá học -Nguyên tắc sắp xếp -Số lượng chu kì -Số lượng nhóm A, nhóm B -Số lượng nguyên tố trong mỗi chu kì Vị trí à cấu hình, Z. Số câu Số điểm(%) 1 0,3đ 1 0,3đ 2 0,6đ 6. Sự biến đổi tuần hoàn. Định luật tuần hoàn -Qui luật biến đổi bán kính nguyên tử, tính KL-PK trong một chu kì, trong một nhóm A. - Qui luật biến đổi hoá trị đối với oxi, hidro -Qui luật biến đổi tính axit-bazơ của các oxit và hiodroxit. - Các yếu tố biến đổi tuần hoàn. - So sánh bán kính nguyên tử, tính KL-PK của các nguyên tố cùng nhóm A hoặc cùng chu kì -So sánh tính axit- bazơ của các hidroxit -Xác định nguyên tố dựa vào % khối lượng nguyên tố trong oxit cao nhất, hợp chất khí với hidro. - So sánh bán kính ion. Số câu Số điểm(%) 2 0,6đ 1 0,3đ 2 0,8đ 5 1,7đ 7. Một số nhóm A tiêu biểu - Khả năng nhường, nhận electron của các nguyên tố nhóm IA, VIIA - Xác định nguyên tố Kim loại dựa vào phản ứng với nước. - Hỗn hợp kim loại tác dụng với nước. - Cho muối halogen td với AgNO3 => xđ halogen. Số câu Số điểm(%) 1 0,3đ 1 0,4đ 1 0,4đ 3 1,1đ 8.Ý nghĩa của BTH các nguyên tố hoá học -Vị trí nguyên tố trong BTH suy ra cấu tạo nguyên tử -Từ vị trí nhóm A suy ra tính chất của nguyên tố - Từ vị trí nhóm A suy ra CT oxit cao nhất, CT hợp chất với hidro. -Vị trí nguyên tố trong BTH suy ra cấu tạo nguyên tử. -Từ cấu hình suy ra vị trí nguyên tố Số câu Số điểm(%) 3 0,9đ 1 0,4đ 4 1,3đ 9. Liên kết ion - Khái niệm, đặc điểm. - dự đoán kiểu lk, công thức hợp chất ion tạo thành giữa 2 nguyên tố đơn giản. - xác định công thức hợp chất tạo thành giữa các nguyên tố. Số câu Số điểm(%) 1 0,3đ 1 0,3đ 1 0,4đ 3 1,0đ 10. Liên kết cộng hóa trị - Khái niệm, đặc điểm lk CHT phân cực, không phân cực. - công thức cấu tạo một số hợp chất đơn giản. - số liên kết, cặp e liên kết và không liên kết. Số câu Số điểm(%) 1 0,3đ 1 0,3đ 1 0,4đ 3 1,0đ Tổng số câu Tổng số điểm 8 2,4đ 12 3,6đ 8 3,2đ 2 0,8đ 30 10,0đ Mã đề 129 12129 Họ, tên học sinh: . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Lớp: . . . . . . . . . . . SỞ GD-ĐT NINH THUẬN Trường THPT Trường Chinh ********* (đề kiểm tra có 2 trang) ĐỀ KIỂM TRA HỌC KÌ I - LỚP 10 NĂM HỌC 2014-2015 MÔN: HOÙA HOÏC. Chương trình chuẩn Thời gian làm bài: 45 phút (không kể thời gian phát đề) Đề ra: (Cho nguyên tử khối: N = 14; Li=7; Na = 23; K=39; Rb=85,5; P=31; S=32; As =75; Ag =108; Cl=35,5; Br=80; I=127; At=210). C©u 1 : Yếu tố nào sau đây không biến đổi tuần hoàn theo chiều tăng dần của điện tích hạt nhân? A. Bán kính nguyên tử. B. Cấu hình electron lớp ngoài cùng. C. Số hiệu nguyên tử. D. Độ âm điện. C©u 2 : Nguyên tử X có 6 proton, 7 nơtron, 6 electron. Khối lượng nguyên tử gần đúng của X là: A. 13 u B. 19 u C. 12 u D. 6 u C©u 3 : Cho H(Z=1) ; C(Z=6). Trong phân tử CH4 có : A. 1 liên kết ba và 1 liên kết đơn. B. 2 liên kết đôi. C. 4 liên kết đơn. D. 2 liên kết đơn và 2 liên kết đôi. C©u 4 : Cấu hình electron của nguyên tố nào sau đây không đúng? A. 1s22s22p63s1 B. 1s22s22p63s23p63d94s2 C. 1s22s22p63s23p63d64s2 D. 1s22s22p63s23p63d14s2 C©u 5 : Nguyên tử M có electron cuối cùng điền vào phân lớp 3d7. Tổng số electron của nguyên tử M là: A. 26 B. 27 C. 25 D. 24 C©u 6 : Số electron tối đa trong lớp thứ n là : A. 2n2 B. 2n3 C. n2 D. 3n C©u 7 : Khẳng định nào sau đây không đúng ? A. Các nguyên tố thuộc nhóm IVA trong bảng tuần hoàn là kim loại hoặc phi kim. B. Các nguyên tố thuộc nhóm VIIIA trong bảng tuần hoàn là khí hiếm. C. Các nguyên tố thuộc nhóm VIIA trong bảng tuần hoàn là phi kim. D. Các nguyên tố thuộc nhóm IA trong bảng tuần hoàn đều là kim loại. C©u 8 : Cho Ca(Z=20) và F(Z= 9). Câu nào sau đây không đúng ? A. Nguyên tử Ca có thể tạo ion Ca2+. B. Liên kết giữa Ca và F là liên kết ion. C. Phân tử hợp chất tạo thành giữa chúng là CaF. D. Nguyên tử F có thể tạo ion F-. C©u 9 : Nguyên tố X ở chu kì 3 nhóm VA. Số hiệu nguyên tử của X là: A. 13 B. 15 C. 14 D. 5 C©u 10 : Thí nghiệm cho các hạt a bắn phá lá vàng của nhà bác học Rơ-dơ- pho đã tìm ra : A. Hạt nhân nguyên tử B. Proton C. Electron D. Nơ tron C©u 11 : Liên kết giữa 2 nguyên tử trong đó có sự cho và nhận electron là kiểu: A. Liên kết cộng hóa trị phân cực. B. Liên kết cộng hóa trị không phân cực. C. Liên kết ion. D. Một loại liên kết khác. C©u 12 : Nguyên tử của nguyên tố Y có tổng số electron ở các phân lớp p là 8. Vị trí của Y trong bảng tuần hoàn là: A. ô thứ 8, chu kì 3 nhóm VIA. B. ô thứ 14, chu kì 3 nhóm VIA. C. ô thứ 10, chu kì 3 nhóm VIIIA. D. ô thứ 14, chu kì 3 nhóm IVA. C©u 13 : Mức năng lượng của các electron trên các phân lớp s, p, d thuộc cùng một lớp được xếp theo thứ tự tăng dần: A. s < p < d. B. p < s < d. C. d < s < p. D. s < d < p. C©u 14 : Câu nào sau đây không đúng? A. Trong bảng tuần hoàn, các nguyên tố có cùng số electron hoá trị trong nguyên tử được xếp thành một cột. B. Các nguyên tố trong bảng tuần hoàn được sắp xếp theo chiều tăng dần nguyên tử khối. C. Bảng tuần hoàn gồm 8 nhóm A và 8 nhóm B. D. Bảng tuần hoàn gồm 3 chu kì nhỏ và 4 chu kì lớn. C©u 15 : Liên kết cộng hóa trị phân cực có đặc điểm nào sau đây ? A. Nguyên tử này cho electron và nguyên tử kia nhận electron. B. Cặp electron chung không bị lệch về phía nguyên tử nào cả. C. Cặp electron chung bị lệch về phía nguyên tử có độ âm điện lớn hơn. D. Hiệu độ âm điện ³ 1,7. C©u 16 : Cho nguyên tử nguyên tố X(Z=17). Câu nào sau đây đúng : A. Hợp chất khí với hidro của X có dạng H2X. B. Oxit cao nhất của X có dạng X2O5. C. Oxit cao nhất của X có dạng XO7. D. Hợp chất khí với hidro của X có dạng HX. C©u 17 : Các nguyên tử của nguyên tố thuộc nhóm nào sau đây có khả năng nhận thêm 1 electron khi tham gia phản ứng : A. Nhóm VIIIA. B. Nhóm IIA. C. Nhóm VIIA. D. Nhóm IA. C©u 18 : Chọn câu sai: Trong một chu kì, theo chiều điện tích hạt nhân tăng dần: A. Tính kim loại yếu dần, tính phi kim mạnh dần. B. Tính axit của các oxit và hidroxit yếu dần. C. Độ âm điện nói chung tăng dần. D. Hóa trị của các nguyên tố trong oxit cao nhất tăng từ 1 đến 7. C©u 19 : Cho các nguyên tố: Na(Z = 11), N (Z = 7), P (Z = 15), Mg (Z = 12). Dãy gồm các nguyên tố được sắp xếp theo chiều giảm dần bán kính nguyên tử từ trái sang phải là: A. N, Mg, P, Na. B. Na, Mg, N, P. C. Mg, Na, P, N. D. Na, Mg, P, N. C©u 20 : Nguyên tử có : A. 13p, 13e, 14n. B. 13p, 14e, 14n. C. 13p, 14e, 13n. D. 14p, 14e, 13n. C©u 21 : Số cặp electron không liên kết trong phân tử NH3 là : A. 2 B. 3 C. 4 D. 1 C©u 22 : Cho một dd chứa 22g hỗn hợp muối natri của 2 halogen ở hai chu kì liên tiếp tác dụng với dung dịch AgNO3 dư thì thu được 47,5 gam kết tủa 2 muối. Tên các halogen là: A. Flo và clo. B. Clo và brom C. Brom và iot. D. Iot và atatin C©u 23 : Anion X- và cation Y2+ đều có cấu hình electron lớp ngoài cùng là 3s23p6. Vị trí của các nguyên tố trong bảng tuần hoàn các nguyên tố hóa học là: A. X ở ô số 17, chu kỳ 3, nhóm VA; Y ở ô số 20, chu kỳ 4, nhóm IIA. B. X ở ô số 18, chu kỳ 3, nhóm VIIA; Y ở ô số 20, chu kỳ 3, nhóm IIA. C. X ở ô số 17, chu kỳ 3, nhóm VIIA; Y ở ô số 20, chu kỳ 4, nhóm IIA. D. X ở ô số 18, chu kỳ 3, nhóm VIA; Y ở ô số 20, chu kỳ 4, nhóm IIA. C©u 24 : Cho 8,5 g hỗn hợp kim loại kiềm ở hai chu kì kế tiếp nhau vào nước dư thì thu được 3,36 lit khí H2 ở đktc. Tên các kim loại kiềm là: A. Liti và natri B. Natri và kali C. Liti và kali D. Kali và rubiđi C©u 25 : Clo trong tự nhiên có 2 đồng vị : 35Cl và 37Cl. Nguyên tử khối trung bình của clo là 35,5. Hỏi 37Cl chiếm bao nhiêu phần trăm về khối lượng trong phân tử HClO4 ? (với H là đồng vị 1H, O là đồng vị 16O). A. 9,20% B. 8,83% C. 8,92% D. 9,80% C©u 26 : Công thức phân tử chất có thể tạo thành giữa nguyên tố X(Z=19) ; Y(Z = 8) là : A. X2Y3 B. XY C. XY2 D. X2Y C©u 27 : Cho O(Z=8); F(Z=9); Na(Z=11). Các ion O2-, F- và Na+ có bán kính giảm dần theo thứ tự: A. F- ; O2- ; Na+. B. O2- ; Na+ ; F-. C. O2- ; F-; Na+. D. Na+ ; F- ; O2-. C©u 28 : Hiđro có các đồng vị : 1H , 2H và oxi có các đồng vị : 16O, 17O, 18O. Có bao nhiêu loại phân tử nước khác nhau được tạo ra từ các đồng vị trên ? A. 9 B. 3 C. 6 D. 12 C©u 29 : Trong một nguyên tử X, tổng số hạt mang điện là 38, số khối là 39. Số nơtron trong hạt nhân nguyên tử X là : A. 20 B. 19 C. 18 D. 21 C©u 30 : Oxit cao nhất của nguyên tố R có dạng R2O5. Trong hợp chất khí với hiđro, R chiếm 82,35% về khối lượng. Tên của R là: A. Photpho B. Nitơ C. Lưu huỳnh D. Asen Học sinh không được sử dụng bảng tuần hoàn các nguyên tố hóa học và tài liệu khi làm bài. ------------------------------Hết------------------------ SỞ GD-ĐT NINH THUẬN Trường THPT Trường Chinh ********* ĐỀ KIỂM TRA HỌC KÌ I - LỚP 10 NĂM HỌC 2014-2015 MÔN: HOÙA HOÏC (Chương trình chuẩn) ĐÁP ÁN, HƯỚNG DẪN CHẤM VÀ BIỂU ĐIỂM Câu 129 248 357 485 Điểm 1 C A C C 0,3đ 2 A C D D 0,3đ 3 C D D C 0,3đ 4 B D B D 0,3đ 5 B B A A 0,3đ 6 A B B A 0,3đ 7 D C A C 0,3đ 8 C D B B 0,3đ 9 B C B A 0,3đ 10 A A C C 0,3đ 11 C D D B 0,3đ 12 D C D B 0,3đ 13 A B B B 0,3đ 14 B B D D 0,3đ 15 C B A D 0,3đ 16 D A A C 0,3đ 17 C A A A 0,3đ 18 B B D A 0,3đ 19 D A C B 0,3đ 20 A C C B 0,3đ 21 D B B C 0,4đ 22 B C B C 0,4đ 23 C A D D 0,4đ 24 B A C D 0,4đ 25 A B A A 0,4đ 26 D A B B 0,4đ 27 C C C A 0,4đ 28 A C D B 0,4đ 29 A B A B 0,4đ 30 B D A A 0,4đ
Tài liệu đính kèm:
 Hoa_Ch_(TRUONGCHINH)HKI-10.doc
Hoa_Ch_(TRUONGCHINH)HKI-10.doc





