Đề kiểm tra hóa 8 (số 1) ma trận kiểm tra
Bạn đang xem tài liệu "Đề kiểm tra hóa 8 (số 1) ma trận kiểm tra", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
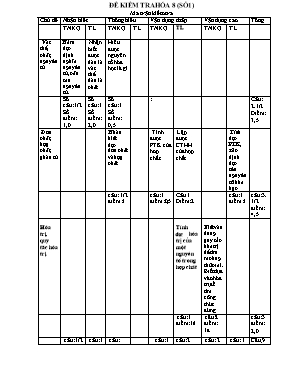
ĐỀ KIỂM TRA HÓA 8 (SỐ1) Ma trận kiểm tra Chủ đề Nhận biết Thông hiểu Vận dụng thấp Vận dụng cao Tổng TNKQ TL TNKQ TL TNKQ TL TNKQ TL VËt thÓ, chÊt, nguyªn tö N¾m ®îc ®Þnh nghÜa nguyªn tö, cÊu t¹o nguyªn tö. Nhận biết được ®©u lµ vËt thÓ ®©u lµ chÊt Hiểu được nguyên tố hóa học là gì Số câu:1/2 Số điểm: 1,0 Số câu:1 Số điểm: 2,0 Số câu:1 Số điểm: 0,5 : Câu: 2.1/2 Điểm: 3,5 §¬n chÊt, hîp chÊt, ph©n tö NhËn biÕt ®îc ®¬n chÊt vµ hîp chÊt Tính được PTK của hơp chất. Lập được CTHH của hợp chất TÝnh ®îc PTK, x¸c ®Þnh ®îc tªn nguyªn tè hãa häc câu: 1/2 điểm:1 câu:1 điểm:0,5 Câu 1 Điểm: 2 câu:1 điểm:1 câu:3.1/2 điểm: 4,5 Hãa trÞ, quy t¾c hãa trÞ TÝnh ®îc hãa trị cña mét nguyªn tè trong hîp chÊt BiÕt vËn dông quy t¾c hãa trÞ ®Ó t×m ra c«ng thøc sai. Biết dựa vào hóa trị để tìm công thức đúng câu:1 điểm: 1® câu:2 điểm: 1đ câu:3 điểm: 2,0 Tổng câu:1/2 điểm:1,0 = 10% câu:1 điểm: 2,0 câu: 1.1/2 điểm:1,5 = 15%, câu:1 điểm:0,5 câu:2 điểm: 3,0 = 30% câu: 2 Số điểm:1 = 10% câu: 1 Số điểm: 1đ Câu;9 Điểm: 10 Đề bài và đáp án §Ò bµi §¸p ¸n §iÓm A- PhÇn tr¾c nghiÖm. C©u 1: H·y chän côm tõ thÝch hîp ®iÒn vµo chç trèng trong c¸c c©u sau: a- ........ lµ h¹t v« cïng nhá trung hoµ vÒ ®iÖn. Tõ .......... t¹o ra mäi chÊt. Nguyªn tö gåm ....... mang ®iÖn tÝch d ¬ng vµ vá t¹o bëi ....... mang ®iÖn tÝch ©m. b- ChÊt ® îc chia lµm 2 lo¹i lín lµ ........ vµ ....... §¬n chÊt ® îc t¹o nªn tõ 1 ......... cßn ....... ® îc t¹o nªn tõ 2 nguyªn tè ho¸ häc trë lªn. C©u 2: Dùa vµo ho¸ trÞ cña c¸c nguyªn tè vµ ho¸ trÞ cña nhãm nguyªn tö. Cho biÕt CTHH nµo sai? a- NaO b- K2O c- HCl d- H2SO4 ( BiÕt hãa trÞ cña Na, K,Cl lµ (I); hãa trÞ cña SO4 lµ II. ) Câu 3: Phân tử khối của Fe2 O3 là: A. 62 B. 160 C. 250 D. 136 Câu 4: Nguyên tố hóa học là: A. Nguyên tử cùng loại. B. Phần tử cơ bản cấu tạo nên vật chất. C. Tập hợp những nguyên tử cùng loại có cùng số proton trong hạt nhân. D. Yếu tố cơ bản cấu tạo nên nguyên tử. Câu 5: Hợp chất Alx(NO3)3 có phân tử khối 213. Giá trị của x là: A.3 B.2 C.1 D. 4 B- PhÇn tù luËn: C©u 1( 2 ®iÓm): LËp CTHH cña hîp chÊt gåm: a- Ba (II) vµ NO3 (I) b- Na (I) vµ PO4 (III) c- Mn (IV) vµ O (II) d- Al (III) vµ Cl (I) C©u 2:( 1 ®iÓm) 1 hîp chÊt mµ ph©n tö gåm 2 nguyªn tö X liªn kÕt víi 3 nguyªn tö S. BiÕt ph©n tö khèi cña hîp chÊt gÊp 75 lÇn so víi khÝ Hi®ro. - TÝnh ph©n tö khèi cña hîp chÊt. - H·y x¸c ®Þnh tªn nguyªn tè; kÝ hiÖu ho¸ häc; ho¸ trÞ cña nguyªn tè X? C©u 3 ( 2 ®iÓm): Trong c¸c c©u sau, tõ nµo chØ vËt thÓ, tõ nµo chØ chÊt? a) D©y ®iÖn b»ng ®ång hoÆc nh«m. b) Kh«ng khÝ gåm oxi, nit¬, khÝ cacboic. c) Lìi dao b»ng s¾t, c¸n dao b»ng nhùa. d) Níc biÓn gåm níc, muèi vµ mét sè chÊt kh¸c. C©u 4:(1 ®iÓm) - TÝnh hãa trÞ cña c¸c nguyªn tè trong c¸c hîp chÊt sau: a) NH3 b) MgO A- PhÇn tr¾c nghiÖm. C©u 1: a- Nguyªn tö; nguyªn tö; h¹t nh©n; electron. b- §¬n chÊt; hîp chÊt; nguyªn tè ho¸ häc; hîp chÊt. C©u 2: - ChØ ra CTHH ®óng vµ sai. + CTHH sai: a Câu 3: B Câu 4: C Câu 5: C B- PhÇn tù luËn: C©u 1: a- Ba(NO3)2 b- Na3PO4 c- MnO2 d- AlCl3 C©u 2: a- TÝnh PTK = 75 : 2 = 150 b - Theo bµi ra ta cã: 2X + 3.32 = 150. - VËy nguyªn tè ho¸ häc lµ nh«m (Al).Nh«m cã ho¸ trÞ III. C©u 3: a) C¸c tõ chØ vËt thÓ: d©y ®iÖn, kh«ng khÝ, lìi dao, c¸n dao, níc biÓn. b) C¸c tõ chØ chÊt: ®ång, nh«m, s¾t, nhùa, níc, muèi. C©u 4: a) N(III) b) Mg(II) 2.0 1,0 1.0 0,5 0,5 0,5 0,5 2,0 1,0 1,0 1,0 1,0 ---------------------------------------------------------------------------------- ĐỀ KIỂM TRA HÓA 8 (SỐ2) Ma trËn kiểm tra Chñ ®Ò NhËn biÕt Th«ng hiÓu VËn dông Tổng TNKQ TL TNKQ TL TNKQ TL 1.Sù biÕn ®æi chÊt - Ph¶n øng ho¸ Phân biệt được hiện tượng vật lý và hiện tượng hóa học Vận dụng để ph©n biÖt ®îc hiÖn tîng vËt lý vµ hiÖn tîng hãa häc câu: 2. điểm:3,0 = 30 % câu:1 Số điểm:1,0 : câu:1 Số điểm:2,0 2. .§Þnh luËt b¶o toµn khèi lîng N¾m ®îc kh¸i niÖm vÒ ph¶n øng hãa häc vµ b¶n chÊt cña PTHH ViÕt ®îc s¬ ®å P¦HH vµ ¸p dông ®Þnh luËt BTKL vµo bµi to¸n : Số câu:2 Số điểm:3 = 30% Số câu: 1 Số điểm:1 Số câu:1 Số điểm:2 3.Ph¬ng tr×nh ho¸ häc : BiÕt nhËn d¹ng c¸c PTHH sai C©n b»ng ®îc PTHH vµ hiÓu ®îc ý nghÜa cña PTHH . câu:3 Số điểm: 40 = 40% câu:1 Số điểm:1 câu:2 Số điểm: 3d Tổng câu:1 Số điểm:1,0 = 10% câu: 1 Số điểm:1,0 = 10% câu:2 Số điểm: 4,0 = 40% câu: 1 Số điểm:1 = 10% câu:2 Số điểm: 3,0 = 30% câu:7 Số điểm:10 = 100% Đề và đáp án §Ò bµi §¸p ¸n chÊm §iÓm A-PhÇn tr¾c nghiÖm C©u 1: Chän tõ hoÆc côm tõ thÝch hîp ®Ó ®iÒn vµo chç trèng trong c¸c c©u sau ®©y: Víi c¸c chÊt cã thÓ x¶y ra nh÷ng biÕn ®æi thuéc 2 lo¹i hiÖn t îng. Khi chất biÕn ®æi mµ vÉn gi÷ nguyªn lµ .......... ban ®Çu th× sù biÕn ®æi thuéc lo¹i hiÖn t îng .......... Cßn khi ........ biÕn ®æi thµnh .......... kh¸c, sù biÕn ®æi thuéc lo¹i hÞªn t îng .......... C©u 2: H·y khoanh trßn vµo ch÷ c¸i ë ®Çu c¸c tr êng hîp ®óng sau ®©y: Trong 1 ph¶n øng ho¸ häc: a. Tæng khèi lîng cña c¸c s¶n phÈm b»ng tæng khèi lîng cña c¸c chÊt tham gia ph¶n øng. b.Sè ph©n tö c¸c chÊt tham gia b»ng sè ph©n tö c¸c chÊt t¹o thµnh. c.C¸c chÊt s¶n phÈm vµ chÊt ph¶n øng cã chøa cïng sè nguyªn tö cña mçi nguyªn tè. d.Liªn kÕt gi÷a c¸c nguyªn tè thay ®æi lµm cho nguyªn tö nµy biÕn ®æi thµnh nguyªn tö kh¸c. C©u 3: H·y khoanh trßn vµo ch÷ c¸i ë c¸c PTHH ®óng trong c¸c PTHH sau: a. 2H2 + O2 2H2O b. Na + O2 Na2O c. HgO Hg + O2 d. 4Al + 3O2 2Al2O3 B- PhÇn tù luËn: C©u1: Cho s¬ ®å ph¶n øng sau: a. K + O2----> K2O b. NaOH + H2SO4 ----> Na2SO4 + H2O c. Al(OH)3 Al2O3 + H2O d. BaCO3 ----> BaO + CO2. LËp PTHH cña mçi ph¶n øng vµ cho biÕt tû lÖ sè nguyªn tö; sè ph©n tö cña c¸c chÊt trong mçi ph¶n øng ho¸ häc trªn? C©u 2: Cho kim lo¹i Zn t¸c dông víi axit H2SO4 lo·ng t¹o ra khÝ H2 vµ muèi ZnSO4. a. LËp PTHH? b. TÝnh m khÝ H2? BiÕt mZn = 6,5 (g), mH2SO4 = 9,8 (g), mZnSO4 = 16,1 (g). C©u 3: Cho s¬ ®å ph¶n øng sau: Mg + HCl ----> MgxCly + H2 a. X¸c ®Þnh c¸c chØ sè x vµ y? b. LËp thµnh PTHH? Câu 4: Những hiện tượng dưới đây hiện tượng nào là hiện tượng vật lý, hiện tượng nào là hiện tượng hóa học và giải thích? A.Cồn để trong lọ không kín bị bay hơi. B. Thủy tinh nóng chảy được thổi thành bình cầu C.Hòa tan muối ăn dạng hạt vào trong nước được dung dịch trong suốt. D.Lưu huỳnh cháy trong không khí tạo chất khí có mùi hắc( khí lưu huỳnh dioxit) A- PhÇn tr¾c nghiÖm. C©u 1: Víi c¸c chÊt cã thÓ x¶y ra nh÷ng biÕn ®æi thuéc 2 lo¹i hiÖn t îng. Khi chÊt biÕn ®æi mµ vÉn gi÷ nguyªn lµ chÊt ban ®Çu th× sù biÕn ®æi thuéc lo¹i hiÖn t îng vËt lÝ .Cßn khi chÊt biÕn ®æi thµnh chÊt kh¸c, sù biÕn ®æi thuéc lo¹i hÞªn t îng ho¸ häc C©u 2: a; c. C©u 3: a; d. B- PhÇn tù luËn: C©u 1: a. 4K + O2 2K2O Tû lÖ sè nguyªn tö K : Sè ph©n tö O2 : Sè ph©n tö K2O = 4 : 1 : 2 b. 2NaOH + H2SO4 Na2SO4 + 2H2O Tû lÖ sè ph©n tö NaOH : Sè ph©n tö H2SO4 : Sè ph©n tö Na2SO4 : Sè ph©n tö H2O = 2 : 1 : 1: 2 c. 2Al(OH)3 Al2O3 + 3H2O Tû lÖ sè ph©n tö Al(OH)3 : Sè ph©n tö Al2O3 : Sè ph©n tö H2O = 2:1:3 d. BaCO3 BaO + CO2. Tû lÖ sè ph©n töBaCO3 : Sè ph©n tö BaO: Sè ph©n tö CO2= 1:1:1 C©u 2: a. Zn + H2SO4 ZnSO4 + H2 b. mH2 = mZn + mH2SO4 – mZnSO4 = (6,5 + 9,8) – 16,1 = 0,2 (g) C©u 3: a. x = 1; y= 2 b. Mg + 2HCl MgCl2 + H2 Câu 4: - A,B,C là hiện tượng vật lý (không có chất mới sinh ra) - D là hiện tượng hóa học vì có chất mới sinh ra 3,0 1,0 1,0 1,0 7,0 2,0 2,0 1,0 2,0 ĐỀ KIỂM TRA HỌC KỲ I - HÓA 8 *)Ma trËn kiÓm tra: Chñ ®Ò NhËn biÕt Th«ng hiÓu VDT VDC Tổng Tự luận Tự luận Tự luận Tự luận Số câu: 2 Số điểm: 3đ = 30 % ChÊt- nguyªn tö, ph©n tö - STCKT: 15 - Tỉ lệ: Ph©n biÖt ®îc ®¬n chÊt vµ hîp chÊt, vÝ dô LËp ®îc c«ng thøc hãa häc cña hîp chÊt Số câu:1 Số điểm:1 = 10% Số câu:1 Số điểm:2 = 20% - Ph¶n øng ho¸ häc - STCKT: 8 - Tỉ lệ: Phát biểu nội dung định luật bảo toàn khối lượng, giải thích định luật. Viết biểu thức ĐLBTK C©n b»ngđược c¸c PTHH Số câu:2 Số điểm: 3,0đ = 30% Số câu: 1 Số điểm: 1,0® = 10% Số câu:1 Số điểm:2,0 = 20% - Mol vµ tÝnh to¸n ho¸ häc - STCKT: 10 - Tỉ lệ: BiÕt tÝnh % c¸c nguyªn tè trong hîp chÊt. ViÕt ®îc pthh, tÝnh ®îc khèi lîng chÊt tham gia, sản phẩm tÝnh ®îc thÓ tÝch chÊt khÝ sinh ra. Lập được CTHH dựa vào tỉ lệ các khối lượng các nguyên tố . Số câu:3 Số :điểm: 4 = 40% Số câu: 1 Số điểm: 1,5® = 15% Số câu: 1 Số điểm: 1,5® = 15% Số câu: 1 Số điểm: 1,0® = 10% Tổng Số câu:2 Số điểm:2,0 = 20% Số câu:3 Số điểm: 5,5d = 55% Số câu: 1 Số điểm: 1,5® = 15% Số câu: 1 Số điểm: 1,0® = 10% Số câu: 7 Số điểm:10 = 100% Đề bài C©u 1(1®):Ph©n biÖt ®¬n chÊt víi hîp chÊt, lÊy vÝ dô? C©u 2(2®): LËp nhanh CTHH cña hîp chÊt t¹o bëi: a.Fe (III) vµ O c.Cu(II) vµ O b.Ca (II) vµ OH(I) d.Na (I) vµ SO4 Câu 3( 1,0đ): Phát biểu nội dung định luật bảo toàn khối lượng và giải thích định luật? Viết biểu thức dạng tổng quát của định luật? C©u 4(2,0®): Hoµn thµnh c¸c ph¬ng tr×nh ph¶n øng sau: a.CaCO3 + H2SO4_----->_CaSO4__+ CO2 __+ H2O b.Zn + HCl -----> ZnCl2 + H2 c.Al + O2-----> Al2O3 d. FexOy + CO -----> Fe + CO2 C©u 5( 1,5 đ): Tính Thµnh phÇn % các nguyªn tè trong hîp chÊt sau Fe2O3? (Biết Fe = 56, O = 16) C©u 6(1,5®): Cho 2,8 g Fe t¸c dông víi axit clohidric (HCl) t¹o thµnh s¾t (II)clorua (FeCl 2 )vµ gi¶i phãng khÝ Hi®ro a.TÝnh thÓ tÝch khÝ hi®ro ë ®iÒu kiÖn tiªu chuÈn? b. tÝnh khèi lîng axit clohi®ric tham ra ph¶n øng? Câu 7(1đ): Một hợp chất khí có thành phần gồm 2 nguyên tố C và O.Biết tỉ lệ về khối lượng của C với O là mC: mO = 3: 8. Xác định công thức phân tử của hợp chất khí đó? Câu Đáp án Biểu điểm 1 (1đ) + Ph©n biÖt ® ưîc ®¬n chÊt víi hîp chÊt +LÊy VD chÝnh x¸c vÒ ®¬n chÊt vµ hîp chÊt 0,5đ 0,5đ 2 (2đ) a.Fe2O3 c.CuO b.Ca(OH) 2 d.Na2SO4 Mỗi phần 0,5đ 3 (1đ) - Phát biểu đúng nội dung định luật - Giai thích được đúng 0,5đ 0,5đ 4 (2đ) a.CaCO3 + H2SO4_ _CaSO4__+ CO2 __+ H2O b.Zn + 2HCl ZnCl2 + H2 c.4Al + 3O2 2 Al2O3 d. FexOy + y CO x Fe + yCO2 Mçi PTHH c©n b»ng ®óng, nèi liÒn mòi tªn. ViÕt CTHH ®óng quy íc mçi phÇn ®óng 0,5 ® 5 (1,5đ) - Tính được M của hợp chất - Tính được khối lượng của các nguyên tố trong hợp chất - Tính được % mỗi nguyên tố 0,5đ) (0,5đ) (0.5đ) 6 (1,5đ) - C©n b»ng phư¬ng tr×nh ®óng -ThÓ tÝch H2 ë (®ktc) : 11,2(l) - Khèi l ưîng HCl tham ra ph¶n øng: 3,65 g 0,5® 0,5® 0,5® 7 (1đ): Lập tỉ lệ tìm được CT CO2. 1đ ĐỀ KIỂM TRA HÓA HỌC 9 (SỐ 2) Ma trận Nội dung Loại câu hỏi/bài tập Nhận biết Thông hiểu Vận dụng thấp Vận dụng cao Câu hỏi/bài tập định tính - Phận loại được các hơp chất oxit axit- oxit bazơ – oxit lưỡng – axit. - Tinh chất của oxit, axit. - Viết được các PTPƯ minh hoạ, các điều kiện của PƯ. - Nhận biết các oxit. - Nguyên tắc và cách làm khô các chất khí. - Ứng dụng của oxit. Bài tập định lượng -Tính theo PTHH (tính thể tích khí SP ở ĐKTC) - Xác định thành phần % các chất trong hỗn hợp. - Xác định chất dư - Tính nồng độ % Bài tập thực hành/thí nghiệm... Nhận biết axit bằng quỳ tím Tính chất hóa học của SO2 Tính chất hóa học của H2SO4 loãng, đặc nóng Đề bài: + Mức độ nhận biết: Câu 1: chất nào là oxit bazơ A. CuO B. P2O5 C. SiO3 D. SO3 Câu 2: chất nào là axit A.Fe3O4 B. H3PO4 C. NaOH D. NaHCO3 Câu 3: Oxit tác dụng với nước tạo thành dung dịch kiềm A. FeO B. CaO C. SiO3 D. MgO Câu 4: oxit tác dụng với nước tạo thành axit A.CuO B. K2O C. SO3 D. MgO + Mức độ hiểu: Câu 5: oxit nào sau đây vừa tác dụng với dung dịch kiềm vừa tác dụng với dung dịch axit A. CuO B. SO2 C Al2O3 D. N2O5 Câu 6: khí lưu huỳnh đi oxit được tạo thành từ cặp chất nào sau đây A.K2 SO3 và H2SO4 B. CuCl2 và Na2SO4 C. K2 SO4 và HCl D. NaOH và Na2SO3 Câu 7: chất nào tác dụng với kim loại tạo khí sunfurơ A. H2SO4 B. HCl C. KOH D. H2SO4 đặc nóng Câu 8: Cho 13 g Zn t¸c dông víi dd H2SO4 lo·ng . ThÓ tÝch khÝ H2 sinh ra ë ®ktc lµ: A. 4,48 (l) B. 2,24(l) C. 3,36(l) D. 1,12(l) Câu 9: Viết phương trình cho những chuyển đổi hóa học sau: CaCO3 -> CaO -> Ca(OH)2 -> CaCO3 + Vận dụng mức độ thấp: Câu 10: Bằng phương pháp hóa học nào hãy nhận biết 2 chất rắn màu trắng là CaO và P2O5 + Vận dụng mức độ cao: Câu 11: Cho 1,6 gam CuO tác dụng với 100 gam H2SO4 nồng độ 20% . Nồng độ % các chất trong dd sau PƯ lần lượt là? A. 3,15% và 17,70% B. 3% và 17,76%. C. 3,15% và 20,5% D. 3,15% và 17,76%. *) Đáp án- thang điểm: Phần trắc nghiệm (4đ) 1A, 2B, 3B, 4C, 5C, 6A, 7D, 8D (mỗi câu 0,5đ) Phần tự luận:(6đ) Câu 9:(1,5đ) Mỗi PT đúng 0,5đ Câu 10: (2,0đ) Lấy mỗi chất một ít mẫu thử và đánh số thứ tự (0,5đ) Hòa các mẫu thử này vào nước(viết các PTHH) (1đ) Thử bằng quỳ tím ( 0.5đ) Câu 11(2,5đ) Tính toán các đại lượng( 0,5đ) Viết PTHH (0,5đ) Xác dịnhđược chất dư và tính đúng % của CuSO4, H2SO4 dư(1,5đ) 5. Nhận xét và đánh giá giờ kiểm tra: -------------------------------------------- ĐỀ KIỂM TRA HÓA 9 (SỐ 2) Ma trận kiểm tra Chñ ®Ò NhËn biÕt Th«ng hiÓu Vận dụng Tổng VDT VDC TNKQ TL TN KQ TL TNKQ TL TNKQ TL Số câu: 5.1/3 Số điểm:4,5 = 45% C¸c lo¹i hîp chÊt v« c¬ Nhận biết được công thức hóa học của các hợp chất.Nhận biết được tính chất hóa học của axit. Viết được PTHH của NaOH với CO2 So sánh được tính chất hóa học của bazơ không tan và kiềm,viết được pt hóa học minh họa. Nhận ra dấu hiệu của phản ứng,vận dụng để nhận biết các chất. Tách chất, loại bỏ tạp chất ra khỏi hỗn hợp các muối. câu:2 điểm:1 câu: 1/3 điểm: 0,5 :câu:1 điểm: 2 câu:1 điểm:1 câu:1 điểm1 Mèi quan hÖ gi÷a c¸c lo¹i hîp chÊt v« c¬ Viết được PTHH và nắm được điều kiện của phản ứng trao đổi :Viết được Các PTHH để thực hiện dãy biến hóa Số câu:3 Số điểm:3 = 30% câu:2 điểm:1 câu:1 điểm:2 TÝnh khèi lîng chÊt t¹o thµnh vµ thÓ tÝch dd ph¶n øng : Tính được thể tích dd đã dùng , khối lượng sản phẩm . câu:2/3 điểm:2,5= 25% câu:2/3 điểm: 2.5 Tổng câu:2 điểm:1 =10% câu:1/3 điểm: 0,5 =5% câu:2 điểm:1 = 10% câu:1 điểm:1 =10% câu:1 điểm:1 = 10% câu:1.2/3 điểm:4,5= 45% câu:1điểm:1 =10% câu:9 điểm:10 = 100% §Ò bµi I. Tr¾c nghiÖm kh¸ch quan: C©u 1: H·y khoanh trßn vµo mét trong c¸c ch÷ c¸i A hoÆc B, C, D chän lµ ph ¬ng ¸n ®óng trong c¸c c©u sau: a)D·y c¸c chÊt nµo sau ®©y ®Òu lµ c¸c muèi? A. KCl; CuSO4; HCl; Ba(OH)2; Mg(NO3)2 C.Na2SO4;BaCl2;Ca(OH)2; KHCO3; MgSO4 B. ZnCl2; CuSO4; Fe(NO3)3; NaCl; AgNO3 D. AlCl3; CuO; Ca(H2PO4)2; ZnSO4; H2O b)§¬n chÊt nµo sau ®©y t¸c dông ®îc víi dd HCl t¹o ra chÊt khÝ? A. Fe B. P C. Cu D. S c)Hîp chÊt nµo sau ®©y t¸c dông ®îc víi dd CuSO4? A. Fe(OH)3 B. MgO C. HCl D. NaOH d)Trén 2 dd nµo sau ®©y sÏ cã chÊt r¾n kh«ng tan (kÕt tña) xuÊt hiÖn? A. DD BaCl2 vµ DD AgNO3 C. DD NaCl vµ DD KNO3 B. DD Na2SO4 vµ DD AlCl3 D .DD ZnSO4 vµ DD CuCl2 C©u 2:Cho c¸c chÊt sau lÇn lît ph¶n øng víi nhau tõng ®«i mét.H·y ghi dÊu (x) nÕu cã ph¶n øng x¶y ra,dÊu (o) nÕu kh«ng cã ph¶n øng? H2SO4 NaOH FeCl3 CuO NaCl II.Tù luËn :(7®) C©u 1:So s¸nh tÝnh chÊt ho¸ häc cña baz¬ tan vµ baz¬ kh«ng tan?ViÕt c¸c PTHH minh ho¹? C©u 2:ViÕt c¸c PTHH thùc hiÖn d·y chuyÓn ®æi ho¸ häc sau: Na Na2O NaOH Na2SO4 NaCl C©u 3:DÉn tõ tõ 3,36 lÝt khÝ CO2(®ktc) vµo dung dÞch NaOH 0,5M, s¶n phÈm lµ Na2CO3 vµ níc. a)ViÕt PTHH x¶y ra. b)TÝnh khèi lîng muèi t¹o thµnh sau ph¶n øng. c)TÝnh thÓ tÝch dung dÞch NaOH 0,5M ®· dïng Câu 4: Có các dung dịch : NaOH, NaCl, H2SO4, Na2SO4, Ba(OH)2. chỉ dùng thêm một thuốc thử để nhận biết các dung dịch trên.Viết các PTHH nếu có. (Cho:Na = 23; C = 12; O = 16; H = 1) §¸p ¸n chÊm I.Tr¾c nghiÖm kh¸ch quan: (3®) C©u1 (2®): Mçi ®¸p ¸n khoanh trßn ®óng ®îc 0,5® C©u a b c d §¸p ¸n ®óng B A D A C©u2 (1®):Mçi phÇn ®¸nh dÊu (x) hoÆc (o) ®óng ®îc 0,25® H2SO4 NaOH FeCl3 o x CuO x 0 NaCl 0 0 II.Tù luËn: (7®) C©u §¸p ¸n §iÓm 1 *Gièng:§Òu t¸c dông víi dd axit Muèi vµ níc PTHH: NaOH + HCl NaCl + H2O Cu(OH)2 +2HCl CuCl2 + 2H2O *Kh¸c:Baz¬ tan -Lµm ®æi mµu quú tÝm thµnh xanh, dd phenolphtalein kh«ng mµu thµnh mµu ®á -T¸c dông víi oxitaxit muèi vµ níc PTHH: 2KOH + CO2 K2CO3 + H2O -T¸c dông víi dd muèimuèi míi vµ baz¬ míi PTHH: 2NaOH + CuSO4 Cu(OH)2 + Na2SO4 Baz¬ kh«ng tan - BÞ nhiÖt ph©n huû ë nhiÖt ®é caooxit t¬ng øng vµ níc PTHH: Fe(OH)2 FeO + H2O 2® 0,5 1 0,5 2 -PTHH: (1) 4Na + O2 2Na2O (2) Na2O + H2O 2NaOH (3) 2NaOH + H2SO4 Na2SO4 + 2H2O (4) Na2SO4 + BaCl2 2NaCl + BaSO4 1® 0,25 0,25 0,25 0,25 3 a)PTHH: CO2 + 2NaOH Na2CO3 + H2O 1mol 2mol 1mol b)n = = 0,15 (mol) Theo PTHH: n = n =0,15 mol nNaOH = 2 n = 2 x 0,15 = 0,3 mol Khèi lîng muèi Na2CO3 t¹o thµnh lµ: 0,15 x 106 =15,9 (g) c) thÓ tÝch dd NaOH 0,5 M ®· dïng : = 0,6 (lit) 3® 0,5 0,5 0,25 0,25 0,75 0,75 4 - Dùng quỳ tím nhân biết được H2SO4 đổi màu quỳ tím thành đỏ. -Nhóm gồm NaOH, Ba(OH)2 chuyển màu quỳ tím thành xanh. - Nhận biết được NaCl không đổi màu quỳ tím. - Dùng H2SO4 nhận biết được Ba(OH)2 có kết tủa màu trắng xuất hiện, H2SO4 + Ba(OH)2 BaSO4+ 2 H2O 1,0 KIỂM TRA HỌC KỲ I( hóa 9) *Ma trận đề kiểm tra Nội dung kiến thức Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng Vận dụng ở mức cao hơn Chương 1: Các hợp chất vô cơ ( 19 tiết ) Viết PTHH hoàn thành sơ đồ phản ứng. Tính theo PTHH. axit tác dụng với bazơ, có chất dư sau phản ứng, tính khối lượng) Tổng số câu Tổng số điểm Câu 2 3 điểm Câu 4 3 điểm 2 câu 6 điểm (60 % ) Chương 2: Kim loại ( 9 tiết ) - Viết dãy HĐHH của 1 số kim loại. - Ý nghĩa của dãy HĐHH Nhận biết kim loại Tổng số câu Tổng số điểm Câu 1 2.5 điểm Câu 3 1.5 điểm 2 câu 4 điểm ( 40 % ) Tổng số câu Tổng số điểm Tỉ lệ % 1 câu 2.5 điểm (25 %) 1 câu 3 điểm (30 %) 1 câu 3 điểm (30 %) 1 câu 1.5 điểm (15 %) 4 câu 10.0 đ (100%) * Đề kiểm tra Câu 1 ( 2.5 điểm ) : Em hãy viết dãy hoạt động hóa học của kim loại và cho biết ý nghĩa của nó ? Câu 2 ( 3 điểm ): Viết phương trình hóa học biểu diễn sự chuyển đổi sau : (1) (2) (3) (4) Al Al2O3 AlCl3 Al(OH)3 Al2(SO4)3 (6) (5) NaAlO2 Al2O3 Câu 3 (1 điểm ) : Khi thả mẩu kim loại Na vào dung dịch CuSO4 thấy có khí không màu thoát ra và xuất hiện kết tủa màu trắng xanh. Em hãy giải thích hiện tượng này và viết phương trình hóa học. Câu 4 ( 3,5 điểm): Cho 14,8 gam hỗn hợp 2 kim loại Cu, Fe vào dung dịch HCl dư, thu được 3,36 lít khí (đktc). Viết phương trình hóa học. Tính khối lượng mỗi kim loại có trong hỗn hợp. Lấy hoàn toàn khối lượng kim loại Cu có trong hỗn hợp cho tác dụng vừa đủ với dung dịch H2SO4 98 % rồi nung nóng. Tính khối lượng dung dịch H2SO4 đã dùng. ( Cho : Cu = 64, Fe = 56, O = 16, H = 1, S = 32, Cl = 35,5) ĐÁP ÁN VÀ BIỂU ĐIỂM Câu Đáp án Biểu điểm 1 * Dãy HĐHH của một số kim loại: K, Na, Mg, Al, Zn, Fe, Pb, (H), Cu, Ag, Au. * Ý nghĩa: 1.Mức độ hoạt động của các kim loại giảm dần từ trái sang phải. 2. Kim loại đứng trước Mg phản ứng với nước ở điều kiện thường tạo thành kiềm và giải phóng H2. 3. Kim loại đứng trước H, phản ứng với một số dung dịch axit ( HCl, H2SO4 loãng) → Muối và giải phóng H2. 4. Kim loại đứng trước( trừ K, Na) đẩy kim loại đứng sau ra khỏi dung dịch muối . 0.5 điểm 2 điểm ( Mỗi ý nghĩa 0.5 điểm) 2 1/ 4Al + 3O2 2Al2O3 2/ Al2O3 + 6HCl 2AlCl3 + 3H2O 3/ AlCl3 + 3NaOH Al(OH)3 + 3NaCl 4/ 2Al(OH)3 + 3H2SO4 Al2(SO4)3 + 6H2O 5/ 2Al(OH)3 Al2O3 + 3H2O 6/ 2Al + 2NaOH + 2H2O 2NaAlO2 + 3H2 3 điểm Đúng mỗi PTHH 0.5 điểm 3 - Vì Na là kim loại hoạt động mạnh nên tác dụng với nước tạo thành dd NaOH và giải phóng khí H2 ( khí không màu) -Sau đó NaOH tham gia phản ứng với CuSO4 tạo thành Cu(OH)2 có màu trắng xanh. PTHH: 2Na + 2H2O 2NaOH + H2 NaOH + CuSO4 Cu(OH)2 + Na2SO4 0.25 điểm 0.25 điểm 0.25 điểm 0.25 điểm 4 a.- PTHH: Fe + 2HCl FeCl2 + H2 1 mol 1 mol 0,15 mol 0,15 mol b. - Số mol H2 : 3,36 /22,4 = 0,15 (mol) - Theo PTHH: Số mol Fe = số mol H2 = 0,15 (mol) - Khối lượng kim loại Fe : 0,15 x 56 = 8,4 (g) - Khối
Tài liệu đính kèm:
 Các đề kiểm tra hóa học kỳ I- 2015 - 2016.doc
Các đề kiểm tra hóa học kỳ I- 2015 - 2016.doc





