Đề kiểm tra chất lượng giữa học kỳ II môn Hoá học lớp 11 năm học 2015 – 2016 - Trường THPT Nguyễn Trãi
Bạn đang xem tài liệu "Đề kiểm tra chất lượng giữa học kỳ II môn Hoá học lớp 11 năm học 2015 – 2016 - Trường THPT Nguyễn Trãi", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
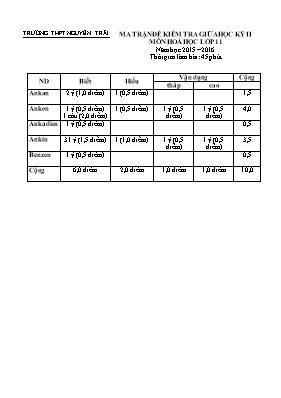
TRƯỜNG THPT NGUYỄN TRÃI MA TRẬN ĐỀ KIỂM TRA GIỮA HỌC KỲ II MÔN HOÁ HỌC LỚP 11 Năm học 2015 – 2016 Thời gian làm bài: 45 phút ND Biết Hiểu Vận dụng Cộng thấp cao Ankan 2 ý (1,0 điểm) 1 (0,5 điểm) 1,5 Anken 1 ý (0,5 điểm) 1 câu (2,0 điểm) 1 (0,5 điểm) 1 ý (0,5 điểm) 1 ý (0,5 điểm) 4,0 Ankadien 1 ý (0,5 điểm) 0,5 Ankin 31 ý (1,5 điểm) 1 (1,0 điểm) 1 ý (0,5 điểm) 1 ý (0,5 điểm) 3,5 Benzen 1 ý (0,5 điểm) 0,5 Cộng 6,0 điểm 2,0 điểm 1,0 điểm 1,0 điểm 10,0 TRƯỜNG THPT NGUYỄN TRÃI ĐỀ KIỂM TRA CHẤT LƯỢNG GIỮA HỌC KỲ II MÔN HOÁ HỌC LỚP 11 Năm học 2015 – 2016 Thời gian làm bài: 45 phút Câu 1. 4,0 điểm Hoàn thành sơ đồ biến đổi sau (mỗi mũi tên là một phản ứng, ghi rõ điều kiện) CH4 ¨ C2H2 ¨ C2H4 ¨ C2H6 ¨ C2H5Cl C4H4 C4H6 C6H6 ¨ C6H5Br Câu 2. 2,0 điểm Nhận biết các khí sau bằng phương pháp hóa học: C2H2, C2H4 và C2H6. Câu 3. 2,0 điểm Nêu tính chất hóa học của etilen và viết phương trình hóa học minh họa. Câu 4. 2,0 điểm Cho 6,72 lít (đktc) hỗn hợp khí gồm etilen và axetilen tác dụng hết với dung dịch Br2 thì cần tối đa 64 gam brom. a. Viết các PTHH xảy ra. b. Tính % số mol mỗi khí. Cho nguyên tử khối: H = 1, C = 12, O = 16, N = 14, Mg = 24, Cl = 35,5, Br = 80 Lưu ý: Học sinh không được sử dụng bảng tuần hoàn các nguyên tố hoá học! ..... Hết TRƯỜNG THPT NGUYỄN TRÃI HDC KIỂM TRA GIỮA HỌC KỲ II MÔN HOÁ HỌC LỚP 11 Năm học 2015 – 2016 Thời gian làm bài: 45 phút Câu ND Điểm 1 4 điểm 1. CH4 ¨ C2H2 +3H2 2. C2H2 + H2 ¨ C2H4 3. C2H4 + H2 ¨ C2H6 4. C2H6 + Cl2 ¨ C2H5Cl + HCl 5. 2C2H2 ¨ C4H4 6. C4H4 + H2 ¨ C4H6 7. 3C2H2 ¨ C6H6 8. C6H6 + Br2 ¨ C6H5Br Nếu HS viết đúng mà thiếu đk thì được ½ số điểm! 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 2 2 điểm Lấy mỗi khí một ít để làm mẫu thử Dùng dung dịch AgNO3/NH3 nhận biết được C2H2 có kết tủa vàng C2H2 + 2AgNO3 + 2NH3 ¨ Ag2C2 + NH4NO3 Dùng dung dịch Br2 nhận biết được C2H4. C2H4 + Br2 ¨ C2H4Br2 Còn lại là C2H6. Nếu HS làm cách khác và viết đầy đủ phản ứng thì cũng cho điểm tối đa 0,5 0,5 0,5 0,5 3 2 điểm Tính chất hóa học của etilen: Phản ứng cộng, phản ứng trùng hợp, phản ứng oxi hóa C2H4 + H2 ¨ C2H6 CH2=CH2 ¨ (-CH2-CH2-)n 3CH2=CH2 + 2KMnO4 + 4H2O ¨ 3CH2OH-CH2OH + 2MnO2 + 2KOH Nêu tính chất hóa học đúng được 0,5 điểm Mỗi tính chất viết PTHH minh họa đúng được 0,5 điểm 0,5 0,5 0,5 0,5 4 2 điểm a. PTHH C2H4 + Br2 ¨ C2H4Br2 C2H2 + 2Br2 ¨ C2H2Br4 Đặt số mol mỗi khí lần lượt là x và y Ta có: x + y = 6,72/22,4 = 0,3 Và: x + 2y = 64/160 = 0,4 Giải ra : x = 0,2, y = 0,1 %số mol C2H4 = 66,67%, % số mol C2H2 = 33,33% 0,5 0,5 0,5 0,5 Hết
Tài liệu đính kèm:
 Ma_tranDeHDC_thi_giua_HK_2_lop_11.docx
Ma_tranDeHDC_thi_giua_HK_2_lop_11.docx





