Đề kiểm tra 45 phút - Lớp 10 môn hóa học
Bạn đang xem tài liệu "Đề kiểm tra 45 phút - Lớp 10 môn hóa học", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
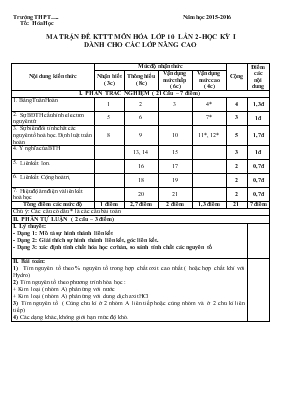
Trường THPT.. Năm học 2015-2016 Tổ: Hóa Học MA TRẬN ĐỀ KTTT MÔN HÓA LỚP 10 LẦN 2- HỌC KỲ I DÀNH CHO CÁC LỚP NÂNG CAO Nội dung kiến thức Mức độ nhận thức Cộng Điểm các nội dung Nhận biết ( 3c) Thông hiểu ( 8c) Vận dụng mức thấp ( 6c) Vận dụng mức cao ( 4c) I. PHẦN TRẮC NGHIỆM ( 21 Câu – 7 điểm) 1. Bảng Tuần Hoàn 1 2 3 4* 4 1,3đ 2. Sự BĐTH cấu hình electron nguyên tử 5 6 7* 3 1đ 3. Sự biến đổi tính chất các nguyên tố hoá học. Định luật tuần hoàn 8 9 10 11*, 12* 5 1,7đ 4. Ý nghĩa của BTH 13, 14 15 3 1đ 5. Liên kết Ion. 16 17 2 0,7đ 6. Liên kết Cộng hoá trị. 18 19 2 0,7đ 7. Hiệu độ âm điện và liên kết hoá học 20 21 2 0,7đ Tổng điểm các mức độ 1 điểm 2,7 điểm 2 điểm 1,3 điểm 21 7 điểm Chú ý: Các câu có dấu * là các câu bài toán II. PHẦN TỰ LUẬN ( 2 câu – 3 điểm) I. Lý thuyết: - Dạng 1: Mô tả sự hình thành liên kết - Dạng 2: Giải thích sự hình thành liên kết, góc liên kết. - Dạng 3: xác định tính chất hóa học cơ bản, so sánh tính chất các nguyên tố II. Bài toán: 1) Tìm nguyên tố theo % nguyên tố trong hợp chất oxit cao nhất ( hoặc hợp chất khí với Hydro) 2) Tìm nguyên tố theo phương trình hóa học : + Kim loại ( nhóm A) phản ứng với nước + Kim loại ( nhóm A) phản ứng với dung dịch axit HCl 3) Tìm nguyên tố ( Cùng chu kì ở 2 nhóm A liên tiếp hoặc cùng nhóm và ở 2 chu kì liên tiếp) 4) Các dạng khác, không giới hạn mức độ khó. Trường THPT ..... Tổ Hóa ĐỀ KIỂM TRA 45 phút - LỚP 10 Môn Hóa Học Ngày kiểm tra : 12/11/2015 Họ, tên thí sinh:.........................................................Số báo danh:.............................................. Mã đề thi 101 I. PHẦN TRẮC NGHIỆM (7đ): Câu 1: Sắp xếp các bazơ: Al(OH)3, Mg(OH)2, Ba(OH)2 theo độ mạnh tăng dần A. Ba(OH)2 < Mg(OH)2 < Al(OH)3 B. Mg(OH)2 < Ba(OH)2 < Al(OH)3 C. Al(OH)3 < Mg(OH)2 < Ba(OH)2 D. Al(OH)3 < Ba(OH)2 < Mg(OH)2 Câu 2: Trong trường hợp chất AB2 các nguyên tử A và B đều có số hạt mang điện gấp 2 lần số hạt không mang điện. Tổng số hạt proton, notron và electron trong AB2 là 96. Cấu hình electron của nguyên tử B có phân mức năng lượng cao nhất là 2p4. AB2 là A. CaC2. B. SO2. C. NO2. D. CO2. Câu 3: Nguyên tố M thuộc nhóm VIA. Trong oxit cao nhất O chiếm 60% khối lượng. Công thức oxit đó là: A. CO2 B. SO3 C. SO2 D. CO Câu 4: Tính axit của các hiđroxyt tương ứng của 17Cl, 15P, 16S, 14Si tăng dần theo thứ tự: A. HClO4, H2SO4, H3PO4, H2SiO3 B. H2SO4, HClO4, H2SiO3, H3PO4 C. H2SO4, H3PO4, HClO4, H2SiO3 D. H2SiO3, H3PO4, H2SO4, HClO4 Câu 5: Z là một nguyên tố mà nguyên tử có chứa 20 proton, còn Y là một nguyên tố mà nguyên tử có chứa 9 proton. Công thức của hợp chất hình thành giữa các nguyên tố này là: A. Z2Y với liên kết cộng hóa trị B. ZY2 với liên kết Ion. C. ZY với liên kết ion D. Z2Y3 với liên kết CHT. Câu 6: Ion nào sau đây không có cấu hình của khí hiếm? A. Na+ B. Mg2+ C. Al3+ D. Fe2+ Câu 7: Sự kết hợp của các nguyên tử nào dưới đây không thể tạo hợp chất dạng hoặc : A. Na và O B. K và S C. Ca và O D. Ca và Cl. Câu 8: Trong các phân tử sau: C2H2, C2H4, O3, N2, CO2, NH3, CH4, có bao nhiêu phân tử có liên kết đôi và bao nhiêu phân tử có liên kết ba? A. 2 và 2 B. 3 và 2 C. 3 và 1 D. 2 và 1 Câu 9: Trong các hợp chất sau: H2O, K2S, NH3, MgCl2, Na2O, CH4. Chất có liên kết ion là: A. H2O, K2S, NH3, MgCl2. B. K2S, MgCl2, Na2O, CH4. C. H2O, NH3, Na2O, CH4. D. K2S, MgCl2, Na2O. Câu 10: Nhận định nào sau đây không hoàn toàn đúng: A.Liên kết ion là liên kết giữa kim loại điển hình và phi kim điển hình B.Liên kết cộng hóa trị không cực có trong đơn chất và hợp chất C.Hiệu độ âm điện nhỏ hơn 0,4 cho biết đó là liên kết cộng hóa trị không cực D.Liên kết giữa kim loại và phi kim luôn là liên kết ion Câu 11: Các nguyên tố X,Y, T(ZX <ZY<ZT) liên tiếp trong một chu kì có tổng số hiệu nguyên tử là 45. Số electron lớp ngoài cùng của các nguyên tử X,Y,T lần lượt là A.4,5,6 B.6,5,4 C.5,6,7 D.2,3,4 Câu 12: Cho 0,45gam một kim loại nhóm IIA tác dụng hoàn toàn với dung dịch HCl thì thu được 4 gam muối. Kim loại có nguyên tử khối là : A.24 B.40 C.137 D.9 Câu 13: Trong dãy oxit sau: Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7. Những oxit có liên kết ion là: A.Na2O, SiO2, P2O5. B.Na2O, MgO, Al2O3. C.MgO, Al2O3, P2O5. D.SO3, Cl2O7, Na2O. Câu 14: Những tính chất nào sau đây biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân ? (a) Bán kính nguyên tử ; (b) Số đơn vị điện tích hạt nhân ; (c) Khối lượng nguyên tử ; (d) Số electron lớp ngoài cùng trong một chu kỳ ; (e) Tính axit, bazơ của oxit và hiđrôxit ; (f) Năng lượng ion hoá thứ nhất. A. a, e, f B. a, b, d C. a, d, e, f D. b, c, e, f Câu 15: X là một nguyên tố thuộc nhóm nhóm VIA. Tỉ số giữa thành phần phần trăm oxi trong oxit cao nhất của X với thành phần phần trăm hiđro trong hợp chất khí với hiđro của X là 51:5. Vậy X là A.S B. C C. Se D.Cr Câu 16: Trong ion Na+: A. số proton nhiều hơn số electron. B. số electron bằng số proton. C. số electron nhiều hơn số proton. D. số electron bằng hai lần số proton Câu 17 : X, Y, Z là các ntố thuộc cùng chu kì trong BTH. Oxit của X tan trong nước tạo thành dd làm đỏ quỳ tím. Y pư với nước tạo thành dd làm quỳ tím hóa xanh. Oxit của Z pư được với cả axit và dd kiềm. Dãy nào sắp xếp các ntố theo chiều tăng dần số hiệu nguyên tử? A. X, Y, Z B. X, Z, Y C. Y, Z, X D. Z , Y, X Câu 18 : Các nguyên tố có cấu hình electron lớp ngoài cùng là: A: 3s1 ; B: 3s2 ; C: 3p1 ; D; 2s1 ; E: 3s23p3 ; F: 4s1 ; H: 3d24s2. Các nguyên tố cùng nhóm là: A. A, B, C, H B. A, C, D, H C. A, C, D, F D. A, D, F, H Câu 19 : Nguyên tố R thuộc chu kì 3, nhóm IIA trong bảng tuần hoàn. Hãy chọn câu phát biểu đúng. A. Nguyên tử R có 2 lớp electron, lớp ngoài cùng có 3 electron. B. Nguyên tử R có cấu hình electron là: 1s2 2s2 2p6 3s2 C. Công thức oxit cao nhất của R là RO2. D. R là nguyên tố kim loại có khuynh hướng nhận thêm 2 electron để đạt cấu hình electron bền vững. Câu 20 : Nguyên tố R là phi kim thuộc nhóm VA. Tỉ lệ giữa thành phần % nguyên tố R trong oxit cao nhất và % nguyên tố R trong hợp chất khí với hiđro là 0,3148. Khối lượng mol nguyên tử và tên gọi R là: A. 14 – Nito B. 31- photpho C. 75-Asen C. 32-luu huỳnh Câu 21 : Y là hiđroxit của nguyên tố M thuộc phân nhóm chính nhóm I, II hay III. Cho 80g dung dịch 5% của Y tác dụng hết với HCl rồi cô cạn thì được 5,85g muối khan. Y là. A. NaOH. B. KOH. C. LiOH. D. KQ khác. II. PHẦN TỰ LUẬN (3đ): Câu 1 : Hãy giải thích tại sao phân tử CH4 có góc liên kết bằng 109028', NH3 có góc liên kết 1070, H2O có góc liên kết 104,50 ? (1,5đ) Câu 2 : M là một nguyên tố nhóm VA , X là hợp chất của M với hiđrô, Y là oxit cao nhất của M. Đốt cháy một lượng X cần vừa đủ 10,24 gam Oxi thu được 11,36 gam Y. Tìm M ? (1,5đ)
Tài liệu đính kèm:
 Kiem_tra_1_tiet_10_nang_cao_bang_tuan_hoan_va_lien_ket.doc
Kiem_tra_1_tiet_10_nang_cao_bang_tuan_hoan_va_lien_ket.doc





