Đề kiểm tra 1 tiết tuần 9 (bài 1 ) môn : Hóa học lớp 8 thời gian : 45 phút
Bạn đang xem tài liệu "Đề kiểm tra 1 tiết tuần 9 (bài 1 ) môn : Hóa học lớp 8 thời gian : 45 phút", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
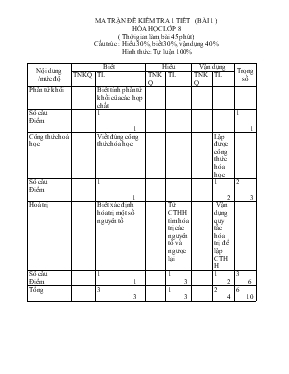
MA TRẬN ĐỀ KIỂM TRA 1 TIẾT (BÀI 1 ) HÓA HỌC LỚP 8 ( Thời gian làm bài 45 phút ) Cấu trúc : Hiểu 30%, biết 30%, vận dụng 40 % Hình thức : Tự luận 100% Nội dung /mức độ Biết Hiểu Vận dụng Trọng số TNKQ TL TNKQ TL TNKQ TL Phân tử khối Biết tính phân tử khối của các hợp chất Số câu Điểm 1 1 1 1 Công thức hoá học Viết đúng công thức hóa học Lập được công thức hóa học Số câu Điểm 1 1 1 2 2 3 Hoá trị Biết xác định hóa trị một số nguyên tố Từ CTHH tìm hóa trị các nguyên tố và ngược lại Vận dụng quy tắc hóa trị để lập CTHH Số câu Điểm 1 1 1 3 1 2 3 6 Tổng 3 3 1 3 2 4 6 10 ĐỀ KIỂM TRA 1 TIẾT TUẦN 9 (BÀI 1 ) Môn : hóa học lớp 8 Thời gian : 45 phút Họ và tên : ..Lớp 8 Trường THCS Bắc Sơn Điểm Lời phê của thầy cô giáo Đề bài Câu 1 : Tính phân tử khối của các phân tử sau : CaCO3 , MgO , CuSO4 , FeO . Câu 2 : Hãy tính hóa trị của nguyên tố Si, Al, Na trong các hợp chất sau: SiO2, Al2 O3, Na2O. Câu 3 : Vận dụng quy tắc hoá trị lập công thức hoá học của các hợp chất tạo bởi: a) S (IV) và O(II) b) K(I) và nhóm (CO3 ) (II) c) Fe( II) và Cl(I) Câu 4 : Cho biết CTHH của hợp chất A với oxi là A2O. nguyên tố B với hidro là H2B. a) Hãy lập công thức hoá học của hợp chất tạo bởi A, B . b) Xác định hai nguyên tố A và B biết : - Phân tử khối của A2O là : 62 - Phân tử khối của H2B là : 34 c) Một hợp chất X gồm các nguyên tố Cu , O có tỉ lệ về khối l ợng là : mCu : mO = 4 : 1. Tìm công thức hoá học của X , biết phân tử khối của X là 80 . ( K = 39, Mn = 55, O = 16, H = 1, Ca = 40, C = 12, S = 32, Mg = 24, Fe = 56, Cu = 64 , Na = 23) Bài làm ĐÁP ÁN MÔN HOÁ HỌC LỚP 8 TUẦN 9 (BÀI 1) Câu Nội dung Điểm 1 (3 điểm) Phân tử khối của CaCO3 là : 100 Phân tử khối của MgO là : 40 Phân tử khối của CuSO4 là : 160 Phân tử khối của FeO là : 72 0,75 0,75 0,75 0,75 2 (1,5 điểm) - Gọi hoá trị của Si là a Suy ra : 1 . a = 2 . II à a = IV Tương tự : - Hoá trị của Al la III - Hoá trị của Na là I 0,5 0,5 0,5 3 (3 điểm) a) Gọi công thức hoá học của hợp chất là SxOy suy ra : x . IV = y . II = = x = 1 , y = 2 . Vậy công thức của hợp chất là : SO2 0,25 0,25 0,25 0,25 b) K2CO3 1,0 c) FeCl2 1,0 4 (2,5 điểm) a) - Từ công thức A2O suy ra : A có hoá trị I - Từ công thức H2B suy ra : B có hoá trị II Vậy công thức hoá học tạo bởi A và B là : A2B 0,5 0,5 b) - Ta có : 2A + 16 = 62 A = 23 A là nguyên tố Na - Ta có : 2 + B = 34 B = 32 B là nguyên tố S 0,25 0,25 c) Gọi CTHH của hợp chất là : CuxOy . 64x : 16y = 4: 1 x : y = 1 : 1 x = 1 , y = 1 Vậy CTHH của X là CuO 0,25 0,25 0,25 0,25 Chú ý : Học sinh làm cách khác đúng vẫn cho điểm tối đa MA TRẬN ĐỀ KIỂM TRA 1 TIẾT (BÀI 2) HÓA HỌC LỚP 8 ( Thời gian làm bài 45 phút ) Cấu trúc : Hiểu 30%, biết 30%, vận dụng 40 % Hình thức : Tự luận 100% Nội dung /mức độ Biết Hiểu Vận dụng Trọng số TNKQ TL TNKQ TL TNKQ TL Phương trình hoá học Biết tính phân tử khối của các hợp chất Số câu Điểm 1 1 1 2 1 3 3 6 Định luật bảo toàn khối lượng Viết đúng công thức hóa học Lập được công thức hóa học Số câu Điểm 1 2 1 1 1 1 3 4 Tổng 2 3 2 3 2 4 6 10 ĐỀ KIỂM TRA 1 TIẾT TUẦN 15(BÀI 2) Môn : hóa học lớp 8 Thời gian : 1 tiết Họ và tên : ..Lớp 8 Trường THCS Bắc Sơn Điểm Lời phê của thầy cô giáo Đề bài Câu 1 : Lập các phương trình phản ứng sau : 1) Na + O2 Na2O 2) Al + Cl2 AlCl3 3) P + O2 P2O5 4) P2O5 + H2O H3PO4 5) Mg + O2 MgO 6) Cu + H2SO4 CuSO4 + SO2 + H2O Câu 2 : Cho sơ đồ phản ứng như sau : Al + CuSO4 Alx(SO4)y + Cu Xác định các chỉ số x và y . Lập phương trình hoá học . cho biết tỉ lệ số nguyên tử của cặp đơn chất kim loại và tỉ lệ số phân tử của cặp hợp chất . Câu 3 : Đốt cháy hoàn toàn một lượng nhôm (Al) trong 48 gam oxi (O2) thu được 102 gam nhôm oxit (Al2O3 ). Viết công thức khối lượng về các chất trong phản ứng . Tính khối lượng nhôm phản ứng. (Al = 27 , O = 16 ) Bài làm ĐÁP ÁN HÓA 8 BÀI 2 Câu Nội dung Điểm 1 (3 điểm) 1) 4Na + O2 2Na2O 2) 2Al + 3Cl2 2AlCl3 3) 4P + 5O2 2P2O5 4) P2O5 + 3H2O 2H3PO4 5) 2Mg + O2 2MgO 6) Cu + 2H2SO4 CuSO4 + SO2 + 2H2O 0,5 0,5 0,5 0,5 0,5 0,5 2 (3 điểm) a) vì Al có hóa trị III, nhóm SO4 hóa trị II . Nên theo quy tắc hóa trị ta có: x= 2, y= 3 0,5 0,75 b) Thay x, y ta được : Al + CuSO4 Al2(SO4)3 + Cu 2Al + 3CuSO4 Al2(SO4)3 + 3Cu Tỉ lệ số nguyên tử Al : số nguyên tử Cu = 2 : 3 Tỉ lệ số phân tử CuSO4 : số phân tử Al2(SO4)3 = 3 : 1 0,25 0,5 0,5 0,5 3 (4 điểm) Công thức khối lượng các chất trong phản ứng: mAl + 2 Theo định luật bảo toàn khối lượng : mAl = 102 – 48 = 54 (g) 2 MA TRẬN ĐỀ KIỂM TRA HỌC KÌ I (BÀI 3) HÓA HỌC LỚP 8 ( Thời gian làm bài 45 phút ) Cấu trúc : Hiểu 30%, biết 30%, vận dụng 40 % Hình thức : Tự luận 100% Nội dung /mức độ Biết Hiểu Vận dụng Trọng số TNKQ TL TNKQ TL TNKQ TL Ph ương trình hoá học Kĩ năng viết PTHH Số câu Điểm 1 1,5 1 1,5 Mol Biêt tính số mol theo số phân tử, khối lượng, thể tích tính số mol theo khối lượng, thể tích Vận dụng tính số mol vào PTHH Số câu Điểm 1 1,5 1 1,5 1 1 3 4 Tính theo công thức hoá học Biết cách tinh thành phần % các nguyên tố Dựa vào phần trăn lập công thức hóa học Số câu Điểm 1 1,5 1 1 2 2,5 Tính theo phương trình hoá học kĩ năng tính toán theo PTHH Số câu Điểm 1 2 1 2 Tổng 2 3 2 3 3 4 7 10 ĐỀ KIỂM TRA HỌC KỲ I (BÀI 3) MÔN : HOA HỌC – LỚP 8 Thời gian: 45phút Họ và tên : ..lớp 8 Trường THCS Bắc Sơn Điểm Lời nhận xét của thầy, cô giáo Câu 1 : (7đ) . Có 3.1023 phân tử SO2. Hãy tính: Số mol SO2 Khối lượng SO2 Thể tích SO2(đktc) . Tính các phép tính sau: Tính thành phần % từng nguyên tố trong hợp chất H2SO4 Lập CTHH của một hợp chất có thành phần % (về khối lượng ) các nguyên tố: 70%Fe , 30% O và khối lượng mol của hợp chất là 160 g. . Cân bằng các phương trình hóa học sau: P + O2 ---> P2O5 KOH + CO2 ---> K2CO3 + H2O Al + HCl ----> AlCl3 + H2 Câu 2 : (3đ) Cho 11.2g Sắt vào dung dịch Axit Clohyđric(HCl) vừa đủ, thu được muối Sắt(II)Clorua (FeCl2) và khí Hidro(đktc) Viết phương trình phản ứng Tính thể tích khí Hiđro(đktc) thu được Tính khối lượng Axit Clohiđric ban đầu(theo 2 cách). ( S = 32, O = 16, H = 1, Fe = 56, Cl = 35.5, C =12.) Bài làm ĐÁP ÁN HÓA 8 HỌC KỲ I (BÀI 3) Câu Nội dung Điểm 1 ( 7 điểm) a. ta cú : b) 0,5 0,5 0,5 .a) Thành phần % từng nguyên tố trong hợp chất H2SO4 %mH = %mS = %mO = 56,29% b) Gọi công thức hóa học của hợp chất là FexOy ta có : x = 2 , y = 3 CTHH : Fe2O3 3. Cân bằng phương trình hóa học 1) 4P + 5O2 2P2O5 (2) 2KOH + CO2 K2CO3 + H2O (3) 4Al + 6HCl 2AlCl3 + 3H2 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 2 (4 điểm) a) PTHH : Fe + 2HCl FeCl2 + H2 b) Ta có : nFe = 11,2 : 56 = 0,2 (mol) Theo PTHH : c) Cách 1 : Theo PTHH : nHCl = 2nFe = 0,4 (mol) mHCl = 0,4 .36,5 = 14,2 (g) Cách 2 : Theo định luật bảo toàn khối lượng mHCl = 0,5 0,5 0,5 0,5 0,5 0,5 Chú ý : Học sinh làm cách khác đúng vẫn cho điểm tối đa MA TRẬN ĐỀ KIỂM TRA 1TIẾT (BÀI 4) H ÓA HỌC LỚ P 8 Thời gian : 45 phút ) Cấu trúc : Hiểu 30%, biết 30%, vận dụng 40 % Hình thức : Tự luận 100% Nội dung /mức độ Biết Hiểu Vận dụng Trọng số TNKQ TL TNKQ TL TNKQ TL Oxit Phân loại được oxit với các chất khác Số câu Điểm 1 2 1 2 Tính chất của oxi Biết tính chất của oxi Hiểu được tính chất của oxi Vận dụng tính chất của oxi viết PTHH Số câu Điểm 1 1,5 1 1 1 3 3 5,5 Các loại phản ứng hóa học Nhận biết các phản ứng hóa học Phân biệt với các phản ứng khác Số câu Điểm 1 1,5 1 1 2 2,5 Tổng 2 3 2 3 2 4 6 10 ĐỀ KIỂM TRA 1 TIẾT TUẦN 27(BÀI 4) Môn : hóa học lớp 8 Thời gian : 1 tiết Họ và tên : ..Lớp 8 Trường THCS Bắc Sơn Điểm Lời phê của thầy cô giáo Đề bài Câu 1 : Cho các chất sau : CO2, MgO,Ag2O, HClO, SO2 . Hãy cho biết chất nào là oxit axit , oxit bazơ . Đọc tên các oxit đó . Câu 2 : Viết phương trình phản ứng cháy xảy ra khi cho các chất tác dụng với oxi : Mg, C , K , Al . Câu 3 : Có các phương trình hóa học sau : 1) 4Na + O2 2Na2O 2) 2NaHCO3 Na2CO3 + CO2 H2O 3) Zn + 2HCl ZnCl2 + H2 4) 2SO 2 + O2 2SO3 5) 2HgO 2Hg + O2 Hãy cho biết phản ứng nào là phản ứng hóa hợp , phản ứng nào là phản ứng phân hủy . vì sao ? Câu 4 : Trong phòng thí nghiệm người ta điều chế oxit sắt từ Fe3O4 bằng cách dùng oxi oxi hóa sắt ở nhiệt độ cao . Tính số gam sắt và số gam oxi cần dùng để điều chế được 2,32 gam oxit sắt từ Dùng lượng khí oxi ở trên để oxi hóa 0,36 gam cacbon(C) . Tính thể tích khí tạo thành (đktc) . (Fe = 56, O = 16, C = 12 ) Bài làm ......................................................................................................................................................................................................................................................................................................................................................................................... ĐÁP ÁN HÓA 8 BÀI 4 Câu Nội dung Điểm 1 (2 điểm) - Oxit axit : CO2 , SO2 + CO2 : Cacbon đioxit + SO2 : Lưu huỳnh đioxit - Oxit bazơ : MgO, Ag2O + MgO : magie oxit + Ag2O : bạc oxit 0,5 0,25 0,25 0,5 0,25 0,25 2 (2 điểm) Các PTHH : 2Mg + O2 2MgO C + O2 CO2 4K + O2 2K2O 4Al + 3O2 2Al2O3 0,5 0,5 0,5 0,5 3 (3 điểm) - Các phản ứng 1,4 là phản ứng hóa hợp + vì chỉ có một sản phẩm tạo thành từ nhiều chất ban đầu Các phản ứng 2,5 là các phản ứng phân hủy + vì có nhiều sản phẩm tạo thành từ một chất ban đầu 1 0,5 1 0,5 4 (3 điểm) a) PTHH : 3Fe + 2O2 Fe3O4 b) Theo PTHH : nFe = 3 .0,1 = 0.3 (mol) Suy ra : mFe = 0,3 . 56 = 16,8 (g ) c) C + O2 CO2 nC = 0,36 : 12 = 0,03 ( mol) Suy ra : 0,5 0,5 0,25 0,25 0,25 0,25 0,25 0,25 0,25 0,25 MA TRẬN ĐỀ KIỂM TRA 1 TIẾT (BÀI 5) ( Thời gian làm bài 45 phút ) Cấu trúc : Hiểu 30%, biết 30%, vận dụng 40 % Hình thức : Tự luận 80%, trắc nghiệm 20% Nội dung /mức độ Biết Hiểu Vận dụng Trọng số TNKQ TL TNKQ TL TNKQ TL Oxit,axit ,bazơ, muối Phân loại được các hợp chất này Số câu Điểm 4 1 4 1 Tính chất của oxi Nhận biết tính chất của oxi Lấy đúng chát tác dụng với oxi Rèn luyện viết PTHH dựa vào tính chất hóa học của oxi Số câu Điểm 1 1 1 (1,5đ) 1 (3đ) 3 5,5 Tính chất của hiđro Lấy đúng chát tác dụng với hiđro Vận dụng vào tính theo PTHH Số câu Điểm 1 1,5 1 (1đ) 2 2,5 Phản ứng hóa học 4 1 4 1 Tổng 8 2 1 1 2 3 2 4 13 10 ĐỀ KIỂM TRA 1 TIẾT (BÀI 5) Môn : hóa học lớp 8 Thời gian : 1 tiết (tiết 58) Họ và tên : ..Lớp 8 Trường THCS Bắc Sơn Điểm Lời phê của thầy cô giáo Đề bài Trắc nghiệm khách quan : (2 điểm ) Câu 1 : Hãy chọn cụm từ thích hợp điền vào chỗ trống trong những câu sau : Phản ứng oxi hóa – khử là phản ứng hóa học trong đó xảy ra đồng thời và .. ..là phản ứng hóa học trong đó nguyên tử của đơn chất thay thế cho nguyên tử của một nguyên tố khác trong hợp chất . ..là phản ứng hóa học trong đó từ một chất sinh ra nhiều chất mới Câu 2 : Dãy chỉ gồm các axit : a) HCl , NaCl, CuO b) MgCl2, HCl, HBr c) HCl ,H2SO4 , HNO3 d) NaOH, H2SO4 , SO2 . Câu 3 : Dãy gồm các bazơ tan : a) NaOH, KOH, Ca(OH)2. b) KOH, Ba(OH)2, Cu(OH)2 c) NaOH, Mg(OH)2, Ca(OH)2. d) Fe(OH)3, KOH, Cu(OH)2. Câu 4 : Dãy gồm các muối : a) NaNO3, CaCO3, NaOH b) Na2S, HCl, CaS. c) FeS, MgCl2, HBr. d) CuSO4, Na2CO3, NaCl. Câu 5 : Dãy gồm các chất tác dụng với nước ở nhiệt độ thường : a) K, Na, CaO b) CuO, CaO, BaO c) Zn, Al2O3, BaO d) Ag2O, K2O, H2CO3 II. Tự luận : ( 8 diểm) Câu 1 : Viết các phương trình hóa học xảy ra (nếu có ) khi cho các chất sau tác dụng với nước : Na, CaO, CO2, Cu, Na2O Câu 2 : Có các chất sau : KOH,CuSO4, Fe(OH)2, HCl. Hãy cho biết chất nào là axit, bazơ, muối. Đọc tên các chất trên . Câu 3 : Hòa tan hoàn toàn 4,6 gam kim loại natri vào nước . Viết phương trình hóa học xảy ra . Tính thể tích khí thu được ở điều kiện tiêu chuẩn. Dẫn toàn bộ lượng khí thu được ở trên qua ống sứ đựng 16 gam CuO nung nóng . Sau khi phản ứng xảy ra hoàn toàn thu được m gam chất rắn.Tính m ( Na = 23, H = 1, O = 16, Cu =64, ) ĐÁP ÁN HÓA 8 BÀI 5 (BÀI 5 ) I – Trắc nghiệm ( 2 điêm ) Câu Nội dung Điểm 1 a- Sự khử - Sự oxi hóa 0,25 0,25 b- Phản ứng thế 0,25 c- Phản ứng phân hủy 0,25 2 c 0,25 3 a 0,25 4 d 0,25 5 a 0,25 II – Tự luận ( 8 điểm) Câu Nội dung Điểm 1 Các phản ứng hóa học xảy ra : 2Na + 2H2O 2NaOH + H2 CaO + H2O Ca(OH)2 CO2 + H2O H2CO3 Na2O + H2O 2NaOH 0,75 0,75 0,75 0,75 2 - Bazơ : KOH Kali hiđroxit Fe(OH)2 Sắt (II) hiđroxit - Muối : CuSO4 Đồng sunfat - Axit : HCl Axit clohiđric 0,5 0,5 0,5 0,5 3 PTHH : 2Na + 2H2O 2NaOH + H2 Ta có : nNa = 4,6 : 23 = 0,2 (mol) Theo PTHH : PTHH : CuO + H2 Cu + H2O Ta có : nCuO = 16 : 160 = 0,1 (mol) Theo PTHH : nCu = nCuO = = 0,1 (mol) Suy ra : mCu = 0,1 . 64 = 6,4 (g) 0,5 0,5 0,5 0,5 0,25 0,25 0,25 0,25 MA TRẬN ĐỀ KIỂM TRA HỌC KÌ II (BÀI 6) HÓA HỌC LỚP 8 ( Thời gian làm bài 45 phút ) Cấu trúc : Hiểu 30%, biết 30%, vận dụng 40 % Hình thức : tự luận 100% Nội dung /mức độ Biết Hiểu Vận dụng Trọng số TNKQ TL TNKQ TL TNKQ TL Oxi – không khí Tính chất của oxi Rèn luyện viết PTHH Số câu Điểm 1 1 1 1 2 2 Hiđro – nước Hiếu tính chất hóa học của hiđro, nước Rèn luyện viết PTHH Số câu Điểm 2 3 1 1 3 4 Dung dịch Biết CT tính nồng độ %,mol Sử dụng nồng độ vào bài tập Số câu Điểm 1 2 1 2 2 4 Tổng 2 3 2 3 3 4 7 10 ĐỀ KIỂM TRA CHẤT LƯỢNG HỌC KÌ II (BÀI 6) Môn : hóa học lớp 8 Thời gian : 45 phút Họ và tên : .Lớp 8 Trường THCS Bắc Sơn Điểm Lời phê của thầy cô giáo Đề bài Câu 1 : Hãy cho biết các chất sau đây chất nào thuộc hợp chất oxit, axit, bazơ, muối : CO2, MgCl2, NaOH ,H2SO4. Câu 2: Cho các chất sau : K, CaO, S. Hãy cho biết chất nào tác dụng với : a) Oxi b) Nước . Viết phương trình hóa học xảy ra . Câu 3 : Xác định độ tan của muối NaCl trong nước ở 200C. Biết rằng ở nhiệt độ này khi hòa tan hết 72 gam NaCl trong 200 gam nước thì được dung dịch bão hòa . Câu 4 : Xác định nồng độ phần trăm của dung dịch khi hòa tan 15 gam HCl vào 45 gam nước . Câu 5 : Hòa tan hết 5,6 gam Fe cần vừa đủ 200 gam dung dịch HCl . Tính thể tích khí H2 thoát ra(đktc) . Tính nồng độ phần trăm của dung dịch HCl cần dùng . Tính nồng độ phần tram của dung dịch sau phản ứng . (Fe = 56, H = 1, Cl = 35,5) Bài làm ........ ĐÁP ÁN KIỂM TRA HỌC KÌ II (BÀI 6) MÔN HÓA HỌC LỚP 8 Câu Nội dung Điểm 1 (1 điểm) Phân loại mỗi hợp chất được 0,25 điểm - Oxit : CO2 - Axit : H2SO4 - Bazơ : NaOH - Muối : MgCl2 0,25 0,25 0,25 0,25 2 (3 điểm) - Các chất tác dụng với oxi : K, S PTHH: 4K + O2 2K2O S + O2 SO2 - Các chất tác dụng với nước : K, CaO . PTHH : 2K + 2H2O 2KOH + H2 CaO + H2O Ca(OH)2 0,5 0,5 0,5 0,5 0,5 0,5 3 (1,5 điểm) SNaCO(18C) = 1,5 4 (1,5 điểm) Khối lượng dung dịch : 15 +45 = 60 gam Nồng độ % của dung dịch : C% = 0,5 1 5(3đ) PTHH : Fe + 2HCl FeCl2 + H2 - nFe = - nH= nFe = 0,1 mol - vH= 0,1 . 22,4 = 2,24 lít b) nHCl = 0,1 . 2 = 0,2 mol C% = c) nFeCl = 0,1 mol mFeCl = 0,1.127= 12,7 gam Khối lượng dung dịch sau phản ứng : 5,6 + 200 – 0,1 .2 = 205,3 gam Nồng độ % của dung dịch sau phản ứng: C%FeCl = 0,25 0,25 0,25 0,5 0,25 0,5 0,25 0,25 0,5
Tài liệu đính kèm:
 Kiem_tra_hoa_8_du.doc
Kiem_tra_hoa_8_du.doc





