Đề kiểm tra 1 tiết (bài số 1) lớp 11 trường PTTH Tháp Chàm năm học: 2014 – 2015 môn: Hóa chương trình: Nâng cao
Bạn đang xem tài liệu "Đề kiểm tra 1 tiết (bài số 1) lớp 11 trường PTTH Tháp Chàm năm học: 2014 – 2015 môn: Hóa chương trình: Nâng cao", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
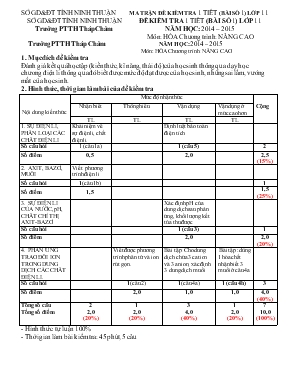
SỞ GD&ĐT TỈNH NINH THUẬN MA TRẬN ĐỀ KIỂM TRA 1 TIẾT (BÀI SỐ 1) LỚP 11 Trường PTTH Tháp Chàm NĂM HỌC: 2014 – 2015 Môn: HÓA Chương trình: NÂNG CAO Nội dung kiến thức Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng Vận dụng ở mức cao hơn TL TL TL TL 1. SỰ ĐIỆN LI, PHÂN LOẠI CÁC CHẤT ĐIỆN LI Khái niệm về sự điện li, chất điện li. Định luật bảo toàn điện tích Số câu hỏi 1 (câu 1a) 1 (câu 5) 2 Số điểm 0,5 2,0 2,5 (15%) 2. AXIT, BAZƠ, MUỐI Viết phương trình điện li Số câu hỏi 1(câu 1b) 1 Số điểm 1,5 1,5 (25%) 3. SỰ ĐIỆN LI CỦA NƯỚC, pH, CHẤT CHỈ THỊ AXIT-BAZƠ. Xác định pH của dung dịch sau phản ứng, khối lượng kết tủa thu được Số câu hỏi 1 (câu 3) 1 Số điểm 2,0 2,0 (20%) 4. PHẢN ỨNG TRAO ĐỔI ION TRONG DUNG DỊCH CÁC CHẤT ĐIỆN LI. Viết được phương trình phân tử và ion rút gọn. Bài tập: Cho dung dịch chứa 3 cation và 3 anion, xác định 3 dung dịch muối Bài tập :dùng 1 hóa chất nhận biết 3 muối ở câu 4a Số câu hỏi 1(câu 2) 1(câu 4a) 1 (câu 4b) 3 Số điểm 2,0 1,0 1,0 4,0 (40%) Tổng số câu Tổng số điểm 2 2,0 (20%) 1 2,0 (20%) 3 4,0 (40%) 1 2,0 (20%) 7 10,0 (100%) 1. Mục đích đề kiểm tra Đánh giá kết quả học tập (kiến thức, kĩ năng, thái độ) của học sinh thông qua dạy học chương điện li thông qua đó biết được mức độ đạt được của học sinh, những sai lầm, vướng mắt của học sinh. 2. Hình thức, thời gian làm bài của đề kiểm tra - Hình thức tự luận 100% - Thời gian làm bài kiểm tra: 45 phút, 5 câu SỞ GD&ĐT TỈNH NINH THUẬN Trường PTTH Tháp Chàm ĐỀ KIỂM TRA 1 TIẾT (BÀI SỐ 1) LỚP 11 NĂM HỌC: 2014 – 2015 Môn: HÓA Chương trình: NÂNG CAO Thời gian làm bài: 45 phút (Không kể thời gian phát, chép đề) Đề: (Đề kiểm tra có 01 trang Câu 1 (2,0 điểm): Cho các chất sau : Zn(OH)2 , C2H6 ,CaCl2 , C2H5OH, Al2O3, (NH4)2SO4, KHCO3. a) Những chất nào là chất điện li ? (1,0đ) b) Viết phương trình điện li của các chất điện li đó. (1,5đ) Câu 2 (2,0 điểm): Viết phương trình phân tử và phương trình ion rút gọn của các phản ứng xảy ra (nếu có) trong dung dịch giữa các cặp chất sau : a) Ca(NO3)2 + Na2CO3 b) Zn(OH)2 (r) + HNO3 c) Fe2O3 + HCl d) NaHSO3 + KOH Câu 3 (2,0 điểm): Trộn 200ml dung dịch chứa đồng thời HCl 0,02M và H2SO4 0,03M với 300ml dung dịch Ba(OH)2 0,035M thu được dung dịch A và kết tủa B. Tính khối lượng kết tủa B và pH của dung dịch A. Câu 4 (2,0 điểm): Trong 3 dung dịch chứa các ion sau (không trùng lập ion trong các dung dịch): Na+, Al3+, Ba2+, NO3-, SO42-, CO32-. Mỗi dung dịch chỉ chứa 1 cation và 1 anion a) Xác định 3 dung dịch trên. b) Chỉ dùng một hóa chất hãy phân biệt các dung dịch đó. Câu 5 (2,0 điểm): Một dung dịch chứa x mol Na+; 0,6 mol NO3-; 0,2 mol Al3+ và y mol SO42-. Tổng khối lượng muối tan trong dung dịch là 56,8g. Xác định x, y. LỜI GIẢI TÓM TẮT Biểu điểm Câu 1: (2,0 điểm) Các chất điện li là : CaCl2, Zn(OH)2 , (NH4)2SO4, KHCO3. 0,5 0,5 0,25 0,25 0,5 Câu 2: (2,0 điểm) Na2CO3 + Ca(NO3)2 → CaCO3 + 2NaCl CO32- + Ca2+ → CaCO3 0,5 Zn(OH)2 + 2HNO3 → Zn(NO3)2 + 2H2O Zn(OH)2 + 2H+ → Zn2+ + 2H2O 0,5 Fe2O3 + 6HCl → 2FeCl3 + 3H2O Fe2O3+ 6H+ → 2Fe3+ + 3H2O 0,5 2NaHSO3 + 2KOH → Na2SO3 + K2SO3 + 2H2O HSO3- + OH- → SO32- + H2O 0,5 Câu 3: (2,0 điểm) Số mol H+ = 0,02.0,2+0,03.0,2.2=0,016 mol Số mol OH- = 0,3.0,035.2=0,021 mol 0,5 H+ + OH- → H2O, Ba2+ + SO42- →BaSO4 0,5 [OH-]=(0,021-1,016):0,5=0,01M, [H+]=10-2M pH=12 0,5 Khối lượng kết tủa=233. 0,006=1,398g 0,5 Câu 4: (2,0 điểm) a) 3 dd: Na2CO3, Al2 (SO4)3, Ba(NO3)2 1,0 b) Thuốc thử : dd H2SO4 - có khí thoát ra là mẫu thử Na2CO3 Na2CO3 + H2SO4→ Na2SO4 + CO2 + H2O - có kết tủa tạo thành là Ba(NO3)2 Ba(NO3)2 + H2SO4 → BaSO4 + 2HNO3 0,5 0,5 Câu 5: (2,0 điểm) Định luất bảo toàn điện tích : x+0,6=0,6+2y Khối lượng muối tan =23x + 96y + 0,2.27 + 0,6.62 = 56,8 x=0,2; y=0,1 1,0 1,0
Tài liệu đính kèm:
 Hoa_ NC_(THAPCHAM)1-11.doc
Hoa_ NC_(THAPCHAM)1-11.doc





