Đề cương ôn tập kiểm tra học kì I . Môn hoá học 9
Bạn đang xem tài liệu "Đề cương ôn tập kiểm tra học kì I . Môn hoá học 9", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
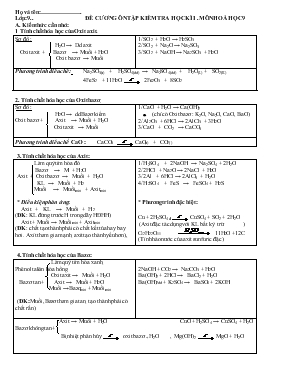
Họ và tên:. Lớp:9.. ĐỀ CƯƠNG ÔN TẬP KIỂM TRA HỌC KÌ I .MÔN HOÁ HỌC 9 A. Kiến thức cần nhớ: 1 Tính chất hóa học của Oxit axit. Sơ đồ : H2O → Dd axit Oxit axit + Bazơ → Muối + H2O Oxit bazơ → Muối 1/ SO2 + H2O → H2SO3 2/ SO2 + Na2O → Na2SO3 3/ SO2 + NaOH → Na2SO3 + H2O Phương trình điều chế: Na2SO3(r) + H2SO4(dd) → Na2SO4(dd) + H2O(L) + SO2(K) 4FeS2 + 11H2O 2Fe2O3 + 8SO2 2. Tính chất hóa học của Oxit bazơ. Sơ đồ : H2O → ddBazơ kiềm Oxit bazơ + Axit → Muối + H2O Oxit axit → Muối 1/ CaO + H2O → Ca(OH)2 (chỉ có Oxitbazơ : K2O, Na2O, CaO, BaO) 2/ Al2O3 + 6HCl → 2AlCl3 + 3H2O 3/ CaO + CO2 → CaCO3 Phương trình điều chế CaO : CaCO3 CaO(r) + CO2( ) 3. Tính chất hóa học của Axit: Làm quỳ tím hóa đỏ Bazơ → M + H2O Axit + Oxit bazơ → Muối + H2O KL → Muối + H2 Muối → Muốimới + Axitmới * Điều kiện phản ứng: Axit + KL → Muối + H2 (ĐK: KL đứng trước H trong dãy HĐHH) Axit + Muối → Muốimới + Axitmới (ĐK: chất tạo thành phải có chất kết tủa hay bay hơi. Axít tham gia mạnh, axít tạo thành yếu hơn), 1/ H2SO4 + 2NaOH → Na2SO4 + 2H2O 2/ 2HCl + Na2O → 2NaCl + H2O 3/ 2Al + 6HCl → 2AlCl3 + H2O 4/ H2SO4 + FeS → FeSO4 + H2S * Phương trình đặc biệt: Cu + 2H2SO4 đ CuSO4 + SO2 + 2H2O (Axit đặc tác dụng với KL bất kỳ trừ ) C12H22O11 11H2O +12C (Tính háo nước của axít sunfuric đặc) 4. Tính chất hóa học của Bazơ: Làm quỳ tím hóa xanh, Phênoltalêin hóa hồng Oxit axit → Muối + H2O Bazơ tan + Axit → Muối + H2O Muối →Bazơmới + Muốimới (ĐK: Muối,Bazơ tham gia tan, tạo thành phải có chất rắn) 2NaOH + CO2 → Na2CO3 + H2O Ba(OH)2 + 2HCl → BaCl2 + H2O Ba(OH)2dd + K2SO4 → BaSO4 + 2KOH Axit → Muối + H2O CuO + H2SO4 → CuSO4 + H2O Bazơ không tan + Bị nhiệt phân hủy oxit bazơ + H2O , Mg(OH)2 MgO + H2O 5/ Tính chất hóa học của muối: KL → Muốimới + KLmới Muối + Axit → Muối mới + Axitmới Muối → 2Muối mới Bazơ → Muốimới + Bazơmới 2AgNO3 + Cu → Cu(NO3)2 + 2Ag FeS + H2SO4→ FeSO4 + H2S AgNO3 + NaCl → NaNO3 + AgCl CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4 Phương trình đặc biệt: CaCO3 CaO + CO2 (Muối Oxit axit + Oxitbazơ) KNO3 KNO2 + O2 (Muối Muốimới + O2) 6/ Thế nào là phản ứng trao đổi, ví dụ: PƯ Trao đổi là PƯHH. Trong đó hai hợp chất tham gia phản ứng trao đổi với nhau những thành phần cấu tạo của chúng để tạo ra những hợp chất mới. ĐK: Chất tham gia ở dạng dung dịch, chất tạo thành có chất không tan hoặc chất khí. BaCl2 + Na2SO4 → BaSO4(r) + 2 NaCl 7/ Tính chất của KL: TCVL: KL có tính dẻo, có ánh kim dẫn nhiệt dẫn điện TCHH: O2 → Oxit bazơ PK KL + PK // (Cl2/S/Br2) → Muối Axit → Muối + H2 Muối → Muốimới + KLmới * PTĐC nhôm: 2Al2O3 → 4Al + 3O2 KL + Axit → Muối + H2 (KL phải đứng trước H) KL + Muối → Muốimới + KLmới (KL phải đứng trước KL trong muối) 3Fe + 2O2 Fe3O4 4Al + 3O2 2Al2O3 2Fe + 3Cl2 2FeCl3 Fe + 2HCl → FeCl2 + H2 2Al + 3H2SO4 → Al2(SO4)3 + 3H2 FeSO4 + Mg → MgSO4 + Fe Fe + CuSO4 → Cu + FeSO4 Al + FeSO4 → Al2(SO4)3 + Fe * PT đặc biệt của nhôm: PƯ với dd kiềm 2Al + 2H2O + 2NaOH → 2NaAlO2 + 2H2 8. Nêu dãy hoạt động hóa học của KL – Ý nghĩa: * DHĐHH: K, Na, Mg, Al, Zn, Fe, Pb, (H), Cu, Ag, Au * Ý nghĩa: 1. Mức độ hoạt động hóa học của KL giảm dần từ trái qua phải. 2. KL đứng trước Mg phản ứng với nước ở nhiệt độ thường tạo ra kiềm và giải phóng khí H2 (2Na + 2H2O → 2NaOH + H2 3. KL đứng trước H phản ứng với axit (HCl, H2SO4) tạo muối và H2 4. Trừ Na, K.. KL đứng trước đẩy được KL đứng sau ra khỏi dd muối. 9. Hợp kim là gì? Gang thép là gì? * Hợp kim: là chất rắn mà thành phần chính là kim loại hóa trộn với một lượng nhỏ KL, hay PK khác Gang Thép Thành phần Là hợp kim của sắt và cacbon với một số nguyên tố khác, trong đó hàm lượng cacbon từ 2 → 5% Là hợp kim của sắt với cacbon và một số nguyên tố khác. Trong đó hàm lượng cacbon < 2% Tính chất Giòn, không rèn, không dát mỏng được. Đàn hồi, dẻo (có thể rèn, dát mỏng, kéo sợi được), cứng. Sản xuất Trong lò cao Nguyên tắc: dùng CO để khử sắt các oxit ở nhiệt độ cao Fe2O3 + 3CO 2Fe + 3O2 Trong lò luyện thép Nguyên tắc: oxi hóa các nguyên tố C, Mn, Si, P có trong gang FeO + C Fe + CO 10. Sự ăn mòn KL là gì? Nguyên nhân? Yếu tố ảnh hưởng? Các biện pháp chống lại sự ăn mòn? Sự phá hủy KL và hợp kim do tác dụng hóa học trong môi trường gọi là sự ăn mòn KL, KL bị ăn mòn do KL tác dụng với các chất như: nước, oxi, không khí và một số chất khác trong môi trường. Yếu tố ảnh hưởng: Sự không ăn mòn hay ăn mòn nhanh hay chậm là tùy thuộc vào các chất có trong môi trường và nhiệt độ của môi trường. Biện pháp chống sự ăn mòn: Ngăn không cho KL tiếp xúc với môi trường bị ăn mòn hoặc chế tạo KL ít bị ăn mòn 11. Tính chất HH của PK TCVL: PK tồn tại ở 3 thể rắn, lỏng, khí. Hầu hết PK không dẫn nhiệt, điện (trừ C) TCHH: PK + KL → M (trừ O2 + KL→Oxitbazơ ) H2 → hợp chất khí O2 → Oxitaxit (P, S, N) * Mức độ hoạt động của PK: PK ( F/O2/Cl2/H2) → là PK hoạt động mạnh PK (S/P/C/Si ) → là PK hoạt động yếu 2Na + Cl2 2NaCl 2Cu + O2 2CuO O2 + 2H2 2H2O Cl2 + H2 2HCl H2 + S H2S S + O2 SO2 4P + 5O2 2P2O5 * Tính chất khác của PK :Cl2 Cl2 + H2O → HCldd + HClOdd Cl2 + 2NaOH → NaCl + NaClO + H2 (vàng lục) (nước Javen không màu) Điều chế khí Cl2: 4HClddđặc + MnO2(r) MnCl2dd + Cl2(k) + H2O (P T Nghiệm) Đen Không màu Vàng lục NaCldd bão hòa + H2O Cl2(k) + H2(k) + 2NaOHdd (Công nghiệm) 12. Các dạng tồn tại của cacbon, TCVL? TCHH? * C có 3 dạng thù hình: Kim cương, than chì, cacbon vô định hình (dạng thù hình là những đơn chất khác nhau do cùng 1 NTHH tạo nên) * TCVL: C có tính hấp thụ cao như than, gỗ * TCHH: C + O2 CO2 + Q 2CuO + C Cu + CO2 Đen đen đỏ không màu (C thể hiện tính khử KL trong oxit, tác dụng với CuO, PbO, ZnO) 13. Tính chất HH của oxit cacbon * Cacbon oxit (CO): là chất khí không màu, không mùi, rất độc, là oxit trung tính, có tính khử mạnh. CO + CuO Cu + CO2 4CO + Fe3O4 4CO2 +3Fe 2CO + O2 2CO2 Cacbon đioxit (CO2): là chất khí không màu, không mùi, nặng hơn không khí, không duy trì sự sống, sự cháy là oxit axit CO2 + H2O → Axit Bazơ → Muối + H2O Oxitbazơ → Muối CO2k + H2O D H2CO3dd * CO2(k) + 2NaOH → Na2CO3dd + H2O * CO2(k) + NaOH dd → NaHCO3dd CO2 + CaO → CaCO3 I.Trắc nghiệm khách quan. 1.Đồng II oxit tác dụng được với: Nước ,sản phẩm là axit. Axit,sản phẩm là muối và nước Nước,sản phẩm là bazơ. Bazơ,sản phẩm là muối và nước 2.0,04 mol K2O tác dụng vừa đủ với: 0,01 mol CO2. 0,08 mol HCl 0,08 mol CaO. 0,01 mol HCl 3.Dãy chất nào tác dụng với dung dịch bazơ. CO2,SO2,P2O5. CaO,CO2,SO2. CaO,K2O,SO2. CO2,CaO,P2O5 4.Chất nào tan trong nước làm quỳ tím: CaO BaO SO3 Na2O 5.Để làm khô một mẫu khí SO2 ẩm ,ta dẫn khí này qua: NaOH đặc. H2SO4 đặc Nước vôi trong dư. Tất cả đều đúng. 6.Chỉ dùng nước có thể phân biệt từng chất rắn trong mỗi cặp sau: Na2O,K2O. Na2O,ZnO. CuO,Al2O3 P2O5,Na2O 7.Các oxit nào tác dụng được với nước: CO2,CO. SO2,SO3. P2O5,CuO. Tất cả đều đúng 8.Số mol KOH cần để trung hòa 1.5mol H2SO4 là đáp số nào sau đây: 0,75 mol 3 mol 1,5mol 6 mol 9.Cacbon đioxit tác dụng với: Nước,sản phẩm là bazơ. Nước,sản phẩm là axit. Axit,sản phẩm là bazơ Bazơ,sản phẩm là axit 10.Sắt III oxit tác dụng với: Bazơ,sản phẩm là muối và nước. Nước ,sản phẩm là bazơ. Axit,sản phẩm là muối và nước. Nước,sản phẩm là axit. 11.0,02 mol CaO tác dụng vừa đủ với: 0,04mol HCl 0,01,mol HCl 0,04 mol BaO 0,04 mol CO2 12.Dãy chất nào tác dụng với nước: CaO,CO2,K2O. CaO,SiO2,BaO. CaO,CuO,K2O. CaO,SO2,CuO 13.Chất nào tan trong nước làm xanh quỳ tím : BaO CO2 SO2 P2O5 14.Dãy nào gồm toàn oxit bazơ: CO2,K2O SO2,CaO CaO,CuO CO2,CaO 15.Chỉ ra chất tác dụng với NaOH: CO,CO2 SO2 ,SO3 FeO,Fe2O3. NO,NO2 16.Chỉ dùng nước có thể phân biệt từng chất rắn trong mỗi câu sau CaO,Na2O. FeO,Al2O3 Fe2O3,CaO SO2,Na2O. 17.Na2O và Fe2O3 cùng phản ứng với: Nước. NaOH. H2SO4 NaCl 18.Dung dịch nào có độ bazơ mạnh nhất trong dung dịch có giá trị pH sau: pH= 7 pH =5 pH = 10 pH = 12 19.Cho 0,2 mol Al tác dụng với dung dịch H2SO4 loãng ,số mol H2 sinh ra có đáp số sau: 0,2 mol 0,1 mol 0,3 mol 0,15 mol 20. Lưu huỳnh đioxit tác dụng với: Nước,sản phẩm là bazơ. Axit,sản phẩm là bazơ. Nước,sản phẩm là axit. Bazơ,sản phẩm là axit. 21.Dãy chất nào tác dụng với dung dịch axit: CaO,CuO,K2O. CaO,K2O,SO2. CaO,C,SO2. CaO,CO2,CuO 22.Chất nào làm đỏ dung dịch phenoltalêin không màu: KOH b.Fe(OH)2 c.Cu(OH)2 d.HNO3 23.Dãy nào gồm toàn oxit axit: SiO2,P2O5. NO,NO2. CO,CO2 SO3,K2O. 24.Chỉ ra điều sai khi nói về CaO: Là oxit bazơ. Tan trong nước tỏa nhiều nhiệt, Tác dụng với oxit axit cho ra muối và nước . Còn được gọi là vôi sống 25.Diêm tiêu là tên gọi của: KCl KNO3 KClO3 KMnO4. 26.Số mol NaOH cần để trung hòa 0.2mol H2SO4 là đáp số nào sau đây: 0,1 mol 0,05 mol 0,2 mol 0,4 mol 27.Chỉ dùng NaOH có thể phân biệt 2 muối nào trong mỗi cặp: KCl, BaCl2. AlCl3,ZnCl2. KNO3, NaCl. MgSO4,Na2SO4 28. Đồng kim loại có thể cho phản ứng với: Dung dịch HCl Dung dịch H2SO4 đặc ,nóng. Dung dịch H2SO4 loãng. Dung dịch NaOH. 29.Chỉ ra những chất nào tác dụng với dung dịch HCl: Zn,ZnO. CaCO3,AgNO3. NaOH,NaHCO3. Tất cả đều đúng 30.Làm đục nước vôi trong: Khí cacbonic. Khí oxi. Khí hiđro clorua. Khí hiđro sunfua 31.Cặp nào sau đây cho phản ứng với axit clohiđric: Zn,Cu Na2CO3,AgNO3 Al,Ag. CaO,NO 32.Loại phân bón nào là phân kép. KNO3. KCl. NH4NO3. (NH2)2SO4. 33.Công thức của vôi sống : Ca. CaO. CaCO3. Ca(OH)2. 34.NaOH cho phản ứng hóa học với: a.Cu,CuCl2,HCl b.MgCl2,HCl,H2SO4. c.CuO,CuSO4,Al. d.CO2,CO,SO2. 35.Hãy chỉ ra phân đạm . KCl,NH4NO3. Ca3(PO4)2 (NH4)2SO4,(NH4)2CO (NH4)2HPO4,NH4Cl. 36.Chỉ ra các chất kiềm : KOH,Mg(OH)2. Cu(OH)2,Al(OH)3. NaOH,Ba(OH)2 KOH,Zn(OH)2. 37.Kim loại nào có thể tác dụng với dung dịch Cu(NO3)2 tạo ra đồng kim loại. Al,Zn,Fe. Mg,Fe,Ag. Zn,Pb,Au. Na,Mg,Al. 38.Chỉ ra chất tác dụng với dung dịch BaCl2. KNO3. NaCl. K2SO4. Ca(NO3)2. 39.Không dùng natri để đẩy sắt ra khỏi dung dịch FeSO4 vì: Phản ứng không xảy ra. Natri là kim loại đứng trước nhôm. Natri hoạt động hóa học yếu hơn sắt. Natri là kim loại tác dụng với nước. 40.Phản ứng giữa dung dịch Ba(OH)2 và dung dịch H2SO4 phải xảy ra hoàn toàn vì: Có sự tạo kết tủa BaSO4. H2SO4 là axit mạnh Đây là phản ứng trung hòa. Ba(OH)2 là bazơ mạnh. 41.Đơn chất tác dụng với H2SO4 loãng giải phóng khí là: Đồng Lưu huỳnh Kẽm Thủy ngân. 42.Dung dịch Cu(NO3)2 bị lẫn AgNO3.có thể làm sạch dung dịch Cu(NO3)2 trên bằng kim loại : Zn Al Ag Cu 43.Chỉ dùng nước có thể phân biệt được 2 chất nào trong mỗi cặp chất sau: Na và K Na và Mg FeO và CuO Na2O và BaO 44.Dữ kiện nào dưới đây cho thấy nhôm hoạt động hóa học mạnh hơn sắt: Al,Fe đều không phản ứng với HNO3 đặc ,nguội. Nhôm đẩy được sắt ra khỏi dung dịch muối sắt. Nhôm có phản ứng với dung dịch kiềm. Chỉ có sắt bị nam châm hút. 45.Kim loại nào dưới đây vừa tác dụng với dung dịch HCl,vừa tác dụng với dung dịch NaOH. a.Fe b.Cu c.Al d.Ag 46.Muối nào bị phân hủy bởi nhiệt. CaCO3,Na2SO4 MgCO3,KClO3 NaCl, AgNO3. KCl, KMnO4 47.Có thể sản xuất NaOH trong công nghiệp bằng cách. Cho natri tác dụng với nước. Điện phân dung dịch NaCl bão hòa trong lò điện phân có vách ngăn. Cho nước vôi trong phản ứng vừa đủ với dung dịch Na2CO3. Tất cả đều đúng . 48.Chọn cách sắp xếp các kim loại theo chiều hoạt động hóa học tăng dần. K Mg Al Cu Ag Na Mg Al Cu Au Ag Zn Al Na K Au Cu Al Na Mg 49.Chỉ ra điều sai khi nói về lưu huỳnh đioxit: Là chất khí không màu,mùi hắc. Tác dụng với bazơ,oxitbazơ. Tác dụng với nước cho ra dung dịch axit sufuric. Có thể điều chế được bằng đun H2SO4 đặc với Cu 50.Chọn cách sắp xếp các kim loại theo chiều hoạt động hóa học giảm dần. K Mg Al Cu Ag Na Mg Al Cu Au Ag Zn Al Na K Au Cu Al Na Mg Câu 51: (biết) Sản phẩm được tạo ra của phi kim với chất nào là muối? A.Kim loại B.Oxy C.Hiđro D.Phi kim khác Câu 52: (biết) Hai phi kim tác dụng với nhau tạo sản phẩm không làm đổi màu giấy quỳ ẩm là : A.Hiđro và clo B.Lưu huỳnh và oxy C.Hiđro và oxy D.Photpho và oxy Câu 53: (biết) Mức độ hoạt động hoá học mạnh hay yếu của phi kim là căn cứ vào khả năng và mức độ phản ứng của phi kim đó với: A.Nhiều kim loại và phi kim B.Nhiều kim loại và hiđro C.Nhiều kim loại và oxy D.Nhiều kim loại và clo Câu 54: ( Hiểu ) Có những chất khí: H2,O2,CO2 , SO2 , Cl2 .Những khí cùng tồn tại trong một bình chứa để nơi có nhiệt độ cao mà không có phản ứng hoá học là: A.H2 , O2 , CO2 B.Cl2 , SO2 , O2 C.H2 , CO2 , Cl2 D.CO2 , SO2 , H2 Câu 55: (biết) Phi kim tác dụng được với dung dịch NaOH là: A.Photpho B.hiđro C.Clo D.Lưu huỳnh Câu 56: (biết) Phi kim tác dụng trực tiếp với nước tạo ra axit là: A.Photpho B.Hiđro C.Clo D.Lưu huỳnh Câu 57: (biết) Phi kim tác dụng được với cả Fe , O2 , H2 A.Clo B.Cacbon C.Nitơ D.Photpho Câu 58: (hiểu) Chất A vừa tác dụng được với clo tạo chất rắn có màu nâu đỏ,vừa tác dụng được với axit là: A.Sắt B.Đồng C.Hiđro D.Natri hiđroxit Câu 59: (vận dụng) Muối có hàm lượng clo cao nhất: A.săt(II)clorua B.Đồng clorua C.canxi clorua D.Magiê clorua Câu 60: (biết) Dùng làm chất khử một số kim loại ở nhiệt độ cao là: A.Oxy B.Cacbon C.Lưu huỳnh D.Photpho Câu 61: (biết) Trong tự nhiên phi kim tạo nhiều đơn chất nhất: A.Oxy B.Cacbon C.Lưu huỳnh D.Photpho Câu 62: (biết) Phi kim có khả năng dẫn điện: A.Oxy B.Cacbon C.Lưu huỳnh D.Photpho Câu 63 ( Hiểu ) Để khẳng định một chất bột là cacbon hay oxit sắt , cách làm nào sau đây là đúng? A.Cho mỗi loại vào muỗng sắt đun trên ngọn lửa đèn cồn B. .Cho mỗi loại tác dụng với H2 ở nhiệt độ cao. C.Đun nóng mỗi loại bột trong chén sứ D. Cả 3 cách đều đúng Câu 64: (Biết) Cacbon mono oxit là oxit: A.Oxit axit. B.Oxit bazơ. C.Oxit lưỡng tính. D.Oxit trung tính. Câu 65: (Biết ) Cacbon đi oxit tác dụng được với dãy chất nào sau đây: A.Nước, dung dịch bazơ, oxit bazơ. B.Nước, dung dịch axit, oxit bazơ. C.Nước, oxit axit, oxit bazơ. D.Nước, dung dịch bazơ, oxit axit. II.BÀI TẬP ỨNG DUNG: 1. Lập công thức oxít: natri oxit, bari oxit, kẽm oxit, nhôm oxit, magiê oxit, bạc oxit, lưu huỳnh đioxit, lưu huỳnh trioxit, nitơ đioxit, cacbon đioxit, sắt (III) oxit, nitơ (IV)oxit, 2. Hoàn thành các phương trình phản ứng sau: K2O + H2O → H2O + CaO → H2SO4 + CuO → Al2O3 + HCl → Fe2O3 + H2SO4 → Na2O + HCl → CO2 + KOH → Ca(OH)2 + SO3 → N2O5 + NaOH → Ba(OH)2 + CO2 → MgO + HNO3 → P2O5 + KOH → SO3 + H2O → Al2O3 → HNO3 + Na2O → Ba(OH)2 + SO3 → 3. Hoàn thành các chuỗi biến hoá sau: a) CaCO3 → CaO → Ca(OH)2 → CaCl2 → Ca(NO3)2 → CaCl2 b) Na → Na2O →NaOH → Na2SO4 → NaCl → NaOH → Na2 CO3 → CO2 c) S → SO2 → SO3 → H2SO4→ CuSO4 → Cu → CuO → Cu → CuCl2 d) Fe → FeCl3 → Fe(OH)3 → Fe2(SO4)3 → Fe(NO3)3 → Fe → FeCl2 e) Al → Al2O3→ Al → Al2(SO4)3 → AlCl3 → Al(NO3)3 → Al f) Cu(OH)2 → CuO → Cu → CuS → CuCl2 → Cu(NO3)2 → Cu → CuCl2 4.Hoàn thành phương trình. Ca(OH)2 + ..→ CaCO3 + Cu(NO3)2 + ..→ NaNO3 + .. HCl + ..→ CuCl2 +. NaCl + .→ NaNO3 + ZnSO4 + ..→BaSO4 +. Al(OH)3 +..→AlCl3 +. Na2SO3 + . → .. + SO2 + H2O CuCl2 + .→ ZnCl2 + .. BaCl2 + .→ HCl + . + H2SO4 → CuSO4 + . Fe + → FeSO4 + Cu Al + .→ Al2O3 Fe + → FeCl3 Na + .→ Na2S 5.Cho các chất sau: CO2, Na2O, ZnO, Al2O3, FeCl3, Al, Cu Nước Dd HCl. Dd NaOH Dd AgNO3 Bài tập: 1.Hòa tan hoàn toàn 2,4g Mg vào 200ml dung dịch HCl ta được dung dịch A và V lít khí bay ra (đktc). Tính thể tích khí và nồng độ mol dung dịch HCl. Tính khối lượng dung dịch A. 2.Cho 16g CuO tác dụng với lượng H2SO4 10%. a.Tính nồng độ phần trăm của dung dịch muối thu . b.Để tác dụng hết với lượng muối trên phải dùng bao nhiêu ml dung dịch NaOH 2M.Tính khối lượng kết tủa thu được. 3. Cho 400g dung dịch H2SO4 9,8% tác dụng với dung dịch Na2CO3 10%.sau phản ứng người ta thu được dung dịch A và khí B. Tính khối lượng dung dịch Na2CO3 tham gia phản ứng. Tính thể tích khí B thu được sau phản ứng (đktc) Tính nồng độ phần trăm dung dịch A 4. Để trung hòa 50g dung dịch H2SO4 19,6% cần vừa đủ 25g dung dịch NaOH C%. Tính C% của dung dịch NaOH đã dùng . Tính C% của dung dịch thu được sau phản ứng. 5. Cho 16g hỗn hợp gồm Cu,Fe vào 300ml HCl 1,5M phản ứng xong thu được 4,48l khí (đktc). Viết PTHH Tính khối lượng mỗi kim loại có trong hỗn hợp ban đầu. Tính nồng độ mol của chất thu được sau phản ứng (coi như thể tích dung dịch sau phản ứng không đổi). 6. Trung hòa 300ml dung dịch H2SO4 0,5M với dung dịch KOH 0,2M Tính khối lượng muối tạo ra. Tính thể tích dung dịch KOH cần . Tính nồng độ mol dung dịch muối trong dung dịch sau phản ứng.ĐS;0,08M 7. Hòa tan 11,2g sắt vào dung dịch HCl 14,6%. Viết phương trình phản ứng xảy ra. Tính thể tích khí sinh ra (đktc). Tính lượng dung dịch HCl cần dùng . Tính nồng độ phần trăm của chất trong dung dịch sau phản ứng.ĐS;22.8% 8. Cho 250g dung dịch AgNO3 vào dung dịch CuCl2 13,5%.sau phản ứng thu được 37,6g muối tan. Viết phương trình phản ứng . Tính lượng chất kết tủa tão ra. Tính lượng dung dịch CuCl2 cần dùng. Tính nồng độ phần trăm muối tan sau phản ứng. 9. Cho 1.11g CaCl2 tác dụng với 250ml dd có chứa 0.85g AgNO3 a. Tính khối lượng chất rắn AgCl sinh ra b. Tính nồng mol của dd Ca(NO3)2. 10. Hòa tan 11g hổn hợp hai kim loại sắt và nhôm bằng 1lượng dung dịch H2SO4 2M (vừa đủ) người ta thu được 8,96 lít khí (đktc).Hãy tính : a / Thành phần trăm khối lượng mỗi kim loại trong hỗn hợp b/ Tính thể tích dung dịch axit đã dùng. 11.Cho 5,4g 1 kim loại có hóa trị (III) tác dụng với clo dư thu được 26,7g muối.Xác định kim loại đem phản ứng. 12.Cho 4,8g kim loại M (có hóa trị II trong hchất)tác dụng vừa đủ với 4,48li1t khí clo(ở đktc).sau phản ứng thu được m gam muối . a/ Xác định kim loại M b/ Tính m. 12.Cho 0,54g kim loại R (có hóa trị III) tác dụng với dd HCl thu được 0,672 lít khí hiđro. a/ Xác định kim loại R? b/ Viết PTHH c/ Tính khối lượng muối tạo thành. 13.Nhung thanh kẽm vào 200ml dd AgNO3.sau phản ứng cân thì thấy khối lượng thanh kẽm tăng 7,55g a/ Tính khối lượng kẽm đã phản ứng b/ Tính nồng độ mol/l của dd AgNO3 . 14.Cho lá kẽm có khối lượng 25g vào dd đồng sufat.sau khi phản ứng kết thúc đem tấm kim loại ra rửa nhẹ,làm khô cân được 24,96g a/ Viết PTHH b/ Tính khối lượng kẽm phản ứng. c/ Tính khối lượng đồng sunfat có trong dung dịch. 15. Hòa tan 2,84g hỗn hợp hai muối CaCO3 và MgCO3 bằng dung dịch HCl thấy bay ra 0,672 lít khí CO2 (đktc).Tính thành phần trăm về khối lượng của hỗn hợp muối ban đầu. 16.Cho 0,83g hỗn hợp gồm nhôm và sắt tác dụng với dung dịch H2SO4 loãng dư.Sau phản ứng thu được 0,56 lít khí ở đktc. a/ Viết PTHH b/ Tính thành phần phần trăm theo khối lượng của mỗi kim loại trong hỗn hợp ban đầu. 17.Cho 112ml khí SO2(đktc) lội qua 700ml dung dịch Ca(OH)2 0,01M.Khối lượng các chất sau phản ứng 18.Cho 100g dung dịch Na2CO316,96% tác dụng với 200g dung dịch BaCl2 10,4% .sau phản ứng,lọc bỏ kết tủa được dung dịch A.Tính nồng độ % các chất trong dung dịch A.
Tài liệu đính kèm:
 De_cuong_on_thi_hk1_hoa_9.doc
De_cuong_on_thi_hk1_hoa_9.doc





