Đề cương ôn tập học kỳ 1 môn hóa học 9
Bạn đang xem tài liệu "Đề cương ôn tập học kỳ 1 môn hóa học 9", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
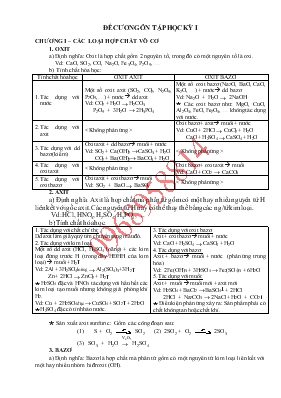
ĐỀ CƯƠNG ễN TẬP HỌC KỲ I CHƯƠNG I – CÁC LOẠI HỢP CHẤT Vễ CƠ 1. OXIT a) Định nghĩa: Oxit là hợp chất gồm 2 nguyờn tố, trong đú cú một nguyờn tố là oxi. Vd: CaO, SO2, CO, Na2O, Fe3O4, P2O5, b) Tớnh chất húa học: Tớnh chất húa học OXIT AXIT OXIT BAZƠ Tỏc dụng với nước Một số oxit axit (SO2, CO2, N2O5, P2O5, ) + nước à dd axit Vd: CO2 + H2O đ H2CO3 P2O5 + 3H2O đ 2H3PO4 Một số oxit bazơ (Na2O, BaO, CaO, K2O, ) + nước à dd bazơ Vd: Na2O + H2O đ 2NaOH ỉ Cỏc oxit bazơ như: MgO, CuO, Al2O3, FeO, Fe2O3, khụng tỏc dụng với nước. Tỏc dụng với axit Oxit bazơ + axit à muối + nước Vd: CuO + 2HCl đ CuCl2 + H2O CaO + H2SO4 đ CaSO4 + H2O Tỏc dụng với dd bazơ (kiềm) Oxit axit + dd bazơ à muối + nước Vd: SO2 + Ca(OH)2 đ CaSO3 + H2O CO2 + Ba(OH)2đ BaCO3 + H2O Tỏc dụng với oxit axit Oxit bazơ + oxit axit à muối Vd: CaO + CO2 đ CaCO3 Tỏc dụng với oxit bazơ Oxit axit + oxit bazơ à muối Vd: SO2 + BaO đ BaSO3 2. AXIT a) Định nghĩa: Axit là hợp chất mà phõn tử gồm cú một hay nhiều nguyờn tử H liờn kết với gốc axit. Cỏc nguyờn tử H này cú thể thay thế bằng cỏc ng/tử kim loại. Vd: HCl, HNO3, H2SO4, H3PO4, b) Tớnh chất húa học: Tỏc dụng với chất chỉ thị: Dd axit làm giấy quỳ tớm chuyển sang màu đỏ. Tỏc dụng với kim loại: Một số dd axit (HCl, H2SO4 loóng) + cỏc kim loại đứng trước H (trong dóy HĐHH của kim loại) à muối + H2 Vd: 2Al + 3H2SO4loóng đ Al2(SO4)3 +3H2 Zn + 2HCl đ ZnCl2 + H2 ỉ H2SO4 đặc và HNO3 tỏc dụng với hầu hết cỏc kim loại tạo muối nhưng khụng giải phúng khớ H2. Vd: Cu + 2H2 SO4đặc đ CuSO4 + SO2 + 2H2O ỉ H2SO4 đặc cú tớnh hỏo nước. Tỏc dụng với oxit bazơ: Axit + oxit bazơ à muối + nước Vd: CaO + H2SO4 đ CaSO4 + H2O Tỏc dụng với bazơ: Axit + bazơ à muối + nước (phản ứng trung hũa) Vd: 2Fe(OH)3 + 3H2SO4 đ Fe2(SO4)3 + 6H2O Tỏc dụng với muối: Axit + muối à muối mới + axit mới Vd: H2SO4 + BaCl2 đ BaSO4 + 2HCl 2HCl + Na2CO 3 đ 2NaCl + H2O + CO2 ỉ Điều kiện phản ứng xảy ra: Sản phẩm phải cú chất khụng tan hoặc chất khớ. ỉ Sản xuất axit sunfuric: Gồm cỏc cụng đoạn sau: (1) S + O2 SO2 (2) 2SO2 + O2 2SO3 V2O5 (3) SO3 + H2O đ H2SO4 3. BAZƠ a) Định nghĩa: Bazơ là hợp chất mà phõn tử gồm cú một nguyờn tử kim loại liờn kết với một hay nhiều nhúm hiđroxit (OH). Vd: KOH, NaOH, Ba(OH)2 , Al(OH)3, b) Tớnh chất húa học: Tỏc dụng với chất chỉ thị: Dd bazơ làm giấy quỳ tớm chuyển sang màu xanh, dd phenolphtalein chuyển sang màu đỏ. Tỏc dụng với oxit axit: Dd bazơ + oxit axit à muối + nước Vd: Ca(OH)2 + SO3 đ CaSO4 + H2O Tỏc dụng với axit: Bazơ + axit à muối + nước (phản ứng trung hũa) Vd: NaOH + HCl đ NaCl + H2O Tỏc dụng với muối: Dd bazơ + dd muối à muối mới + bazơ mới Vd: Ba(OH) 2 + CuSO4 đ BaSO4 + Cu(OH)2 3NaOH + FeCl3 đ Fe(OH)3 + 3NaCl ỉ Điều kiện phản ứng xảy ra: Sản phẩm phải cú chất khụng tan. t0 Phản ứng nhiệt phõn: t0 Bazơ khụng tan à oxit bazơ + nước Vd: Cu(OH)2 đ CuO + H2 O Điện phõn dd cú màng ngăn ỉ Sản xuất natri hiđroxit: 2NaCl + H2O 2NaOH + Cl2 + H2 c) Thang pH: Dựng để biểu thị độ axit hoặc độ bazơ của một dung dịch: pH = 7: trung tớnh ; pH 7: tớnh bazơ 4. MUỐI a) Định nghĩa: Muối là hợp chất mà phõn tử cú một hay nhiều nguyờn tử kim loại liờn kết với một hay nhiều gốc axit. Vd: NaCl, MgSO4, Fe(NO3)2, BaCO3, b) Tớnh chất húa học: 1. Tỏc dụng với kim loại: Muối + kim loại à muối mới + kim loại mới Vd: Fe + CuSO4 đ FeSO4 + Cu Cu + 2AgNO3 đ Cu(NO3)2 + 2Ag ỉ Lưu ý: Kim loại đứng trước (trừ K, Na, Ca, ) đẩy kim loại đứng sau (trong dóy HĐHH của kim loại) ra khỏi dung dịch muối của chỳng. 2. Tỏc dụng với axit: Muối + axit à muối mới + axit mới Vd: BaCl2 + H2SO4 đ BaSO4 + 2HCl Na2CO 3 + 2HCl đ 2NaCl + H2O + CO2 ỉ Điều kiện phản ứng xảy ra: Sản phẩm phải cú chất khụng tan hoặc chất khớ. 3. Tỏc dụng với bazơ: Dd muối + dd bazơ à muối mới + bazơ mới Vd: CuSO4 + 2NaOH đ Cu(OH)2 + Na2SO4 ỉ Điều kiện phản ứng xảy ra: Sản phẩm phải cú chất khụng tan. 4. Tỏc dụng với muối: Muối + muối à 2 muối mới Vd: NaCl + AgNO3 đ AgCl + NaNO3 ỉ Điều kiện phản ứng xảy ra: Sản phẩm phải cú chất khụng tan. 5. Phản ứng nhiệt phõn hủy: t0 Một số muối bị phõn hủy ở nhiệt độ cao: Vd: CaCO3 đ CaO + CO2 c) Phản ứng trao đổi: Định nghĩa: Là phản ứng húa học, trong đú hai hợp chất tham gia phản ứng trao đổi với nhau những thành phần cấu tạo của chỳng để tạo ra những hợp chất mới. Vd: BaCl2 + H2SO4 đ BaSO4 + 2HCl Na2CO 3 + 2HCl đ 2NaCl + H2O + CO2 CuSO4 + 2NaOH đ Cu(OH)2 + Na2SO4 NaCl + AgNO3 đ AgCl + NaNO3 Điều kiện để phản ứng trao đổi xảy ra: Phản ứng trao đổi trong dung dịch của cỏc chất chỉ xảy ra nếu sản phẩm tạo thành cú chất khụng tan hoặc chất khớ. ỉ Lưu ý: Phản ứng trung hũa cũng là phản ứng trao đổi và luụn xảy ra. Vd: NaOH + HCl đ NaCl + H2O CHƯƠNG II – KIM LOẠI: 1. TÍNH CHẤT CHUNG CỦA KIM LOẠI a) Tớnh chất vật lý: Cú tớnh dẻo, dễ dỏt mỏng và dễ kộo sợi. Dẫn điện và dẫn nhiệt tốt. (Ag là kim loại dẫn điện và dẫn nhiệt tốt nhất, tiếp theo là Cu, Al, Fe, ) Cú ỏnh kim. b) Tớnh chất húa học: Tỏc dụng với phi kim: Thường ở nhiệt độ cao. ư Với khớ oxi: Tạo oxit. t0 Vd: 3Fe + 2O2 đ Fe3O4 ư Với cỏc phi kim khỏc (Cl2, S, ): Tạo muối. t0 t0 Vd: 2Na + Cl2 đ 2NaCl ; Fe + S đ FeS Tỏc dụng với dd axit: Kim loại đứng trước H (trong dóy HĐHH của kim loại) + dd axit (HCl, H2SO4 loóng) à muối + H2 Vd: 2Al + 3H2SO4loóng đ Al2(SO4)3 +3H2 ỉ H2SO4 đặc, núng và HNO3 tỏc dụng với hầu hết cỏc kim loại (trừ Pt, Au) tạo thành muối nhưng khụng giải phúng hidro Tỏc dụng với nước: Một số kim loại (Na, K, ...) + nước à dd kiềm + H2 Vd: 2Na +2H2O đ 2NaOH + H2 Tỏc dụng với muối: Muối + kim loại à muối mới + kim loại mới Vd: Fe + CuSO4 đ FeSO4 + Cu Cu + 2AgNO3 đ Cu(NO3)2 + 2Ag ỉ Lưu ý: Kim loại đứng trước (trừ K, Na, Ca, ) đẩy kim loại đứng sau (trong dóy HĐHH của kim loại) ra khỏi dung dịch muối của chỳng. ỉ SO SÁNH TÍNH CHẤT CỦA NHễM VÀ SẮT: Tớnh chất NHễM (Al = 27) SẮT (Fe = 56) Tớnh chất vật lý Là kim loại nhẹ, màu trắng, dẻo, cú ỏnh kim, dẫn điện và dẫn nhiệt tốt. Nhiệt độ núng chảy 6600C. Là kim loại nặng, màu trắng xỏm, dẻo, cú ỏnh kim, dẫn điện, dẫn nhiệt tốt (kộm Al). Nhiệt độ núng chảy 15390C. - Cú tớnh nhiễm từ. Tớnh chất húa học t0 t0 Tỏc dụng với phi kim 2Al + 3S đ Al2S3 2Fe + 3Cl2 đ 2FeCl3 Tỏc dụng với axit 2Al + 6HCl đ 2AlCl3 + 3H2 Fe + H2SO4 đ FeSO4 + H2 ỉ Lưu ý: Al và Fe khụng phản ứng với HNO3 đặc nguội và H2SO4 đặc nguội. Tỏc dụng với dd muối 2Al + 3CuSO4 đ Al2(SO4)3 + 3Cu Fe + 2AgNO3 đ Fe(NO3)2 + 2Ag Tớnh chất khỏc Tỏc dụng với dd kiềm Nhụm + dd kiềm à H2 Trong cỏc phản ứng: Al luụn cú húa trị III. Trong cỏc phản ứng: Fe cú hai húa trị: II, III. ỉ Sản xuất nhụm: Nguyờn liệu: quặng boxit (thành phần chủ yếu là Al2O3), than cốc, khơng khớ. Điện ph núng chảy criolit Phương phỏp: điện phõn núng chảy. 2Al2O3 4Al + 3O2 2. DÃY HOẠT ĐỘNG HểA HỌC CỦA KIM LOẠI Theo chiều giảm dần độ hoạt động của kim loại: K, Na, Ca, Mg, Al, Zn, Fe, Pb, (H), Cu, Ag, Au í nghĩa dy hoạt động húa học của kim loại: Mức độ họat động húa học của kim loại giảm dần từ trỏi qua phải. Kim loại đứng trước Mg tỏc dụng với nước ở điều kiện thường à kiềm và khớ hiđro. Kim loại đứng trước H phản ứng với một số dd axit (HCl, H2SO4 loóng, ) à khớ H2. Kim loại đứng trước (trừ Na, K) đẩy kim loại đứng sau ra khỏi dung dịch muối. 3. HỢP CHẤT SẮT: GANG, THẫP a) Hợp kim: Là chất rắn thu được sau khi làm nguội hỗn hợp núng chảy của nhiều kim loại khỏc nhau hoặc hỗn hợp kim loại và phi kim. b) Thành phần, tớnh chất và sản xuất gang, thộp: Hợp kim GANG THẫP Thành phần Hàm lượng cacbon 2 – 5%; 1 – 3% cỏc nguyờn tố P, Si, S, Mn; cũn lại là Fe. Hàm lượng cacbon dưới 2%; dưới 0,8% cỏc nguyờn tố P, S, Mn; cũn lại là Fe. Tớnh chất Giũn, khụng rốn, khụng dỏt mỏng được. Đàn hồi, dẻo (rốn, dỏt mỏng, kộo sợi được), cứng. Sản xuất Trong lũ cao. Nguyờn tắc: CO khử cỏc oxit sắt ở t0 cao.3CO + Fe2O3 đ 3CO2 + 2Fe Trong lũ luyện thộp. Nguyờn tắc: Oxi húa cỏc nguyờn tố C, Mn, Si, S, P, cú trong gang. FeO + C đ Fe + CO CHƯƠNG III – PHI KIM: 1. TÍNH CHẤT CHUNG CỦA PHI KIM a) Tớnh chất vật lý: Ở điều kiện thường, phi kim tồn tại ở cả 3 trạng thỏi: rắn (S, P, ...) ; lỏng (Br2) ; khớ (Cl2, O2, N2, H2, ...). Phần lớn cỏc nguyờn tố phi kim khụng cú ỏnh kim, dẫn điện, dẫn nhiệt kộm; Nhiệt độ núng chảy thấp. Một số phi kim độc như: Cl2, Br2, I2. b) Tớnh chất húa học: Tỏc dụng với kim loại: t0 ư Nhiều phi kim + kim loại à muối: Vd: 2Na + Cl2 đ 2NaCl t0 ư Oxi + kim loại à oxit: Vd: 2Cu + O2 đ 2CuO Tỏc dụng với hiđro: ư Oxi + khớ hiđro à hơi nước 2H2 + O2 đ 2H2O t0 ư Clo + khớ hiđro à khớ hiđro clorua H2 + Cl2 đ 2HCl ư Nhiều phi kim khỏc (C, S, Br2, ...) phản ứng với khớ hiđro tạo thành hợp chất khớ. Tỏc dụng với oxi: t0 Nhiều phi kim + khớ oxi à oxit axit t0 Vd: S + O2 đ SO2 4P + 5O2 đ 2P2O5 Mức độ hoạt động húa học của phi kim: Mức độ hoạt động húa học mạnh hay yếu của phi kim thường được xột căn cứ vào khả năng và mức độ phản ứng của phi kim đú với kim loại và hiđro. Flo, oxi, clo là những phi kim hoạt động mạnh (flo là phi kim hoạt động mạnh nhất). Lưu huỳnh, photpho, cacbon, silic là những phi kim hoạt động yếu hơn. 2. SO SÁNH TÍNH CHẤT CỦA CLO VÀ CACBON Tớnh chất CLO CACBON (than vụ định hỡnh) Tớnh chất vật lý Clo là chất khớ, màu vàng lục. Clo là khớ rất độc, nặng gấp 2,5 lần khụng khớ. Cacbon ở trạng thỏi rắn, màu đen. Than cú tớnh hấp phụ màu, chất tan trong dung dịch. Tớnh chất húa học 5000C t0 Tỏc dụng với H2 H2 + Cl2 đ 2HCl t0 C + 2H2 CH4 Tỏc dụng với oxi Clo khụng phản ứng trực tiếp với oxi. t0 C + O2 đ CO2 Tỏc dụng với oxit bazơ t0 2CuO + C đ 2Cu + CO2 Tỏc dụng với kim loại 2Fe + 3Cl2 đ 2FeCl3 Tỏc dụng với nước Cl2 + H2O D HCl + HClO Tỏc dụng với dd kiềm Cl2 + 2NaOHđNaCl + NaClO +H2O ỉ Điều chế clo: Trong phũng thớ nghiệm: MnO2 + HClđặcđ MnCl2 + Cl2 + H2O Điện phõn cú màng ngăn Trong cụng nghiệp: 2NaCl + H2O 2NaOH + Cl2 + H2 3. CÁC OXIT CỦA CACBON Tớnh chất CACBON OXIT (CO) CACBON ĐIOXIT (CO2) Tớnh chất vật lý CO là khớ khụng màu, khụng mựi. CO là khớ rất độc. CO2 là khớ khụng màu, nặng hơn khụng khớ. Khớ CO2 khụng duy trỡ sự sống, sự chỏy. Tớnh chất húa học Tỏc dụng với H2O Khụng phản ứng ở nhiệt độ thường. CO2 + H 2O D H2CO3 Tỏc dụng với dd kiềm CO2 + 2NaOH đ Na2CO3 + H2O CO2 + NaOH đ NaHCO3 Tỏc dụng với oxit bazơ t0 Ở nhiệt độ cao: CO là chất khử: 3CO + Fe2O3 đ 3CO2 + 2Fe CO2 + CaO đ CaCO3 Ứng dụng Dựng làm nhiờn liệu, nguyờn liệu, chất khử trong cụng nghiệp húa học. Dựng trong sản xuất nước giải khỏt cú gaz, bảo quản thực phẩm, dập tắt đỏm chỏy, ... ỉ TÍNH TAN TRONG NƯỚC CỦA MỘT SỐ DUNG DỊCH BAZƠ, MUỐI: Bazơ tan KOH, NaOH, Ba(OH)2, Ca(OH)2 ớt tan. Bazơ khụng tan Mg(OH)2, Fe(OH)2, Fe(OH)3, Zn(OH)2, Cu(OH)2, Al(OH)3, Pb(OH)2 Muối Sunfat (=SO4) Hầu hết tan (trừ BaSO4, PbSO4 khụng tan). Muối Sunfit (=SO3) Hầu hết khụng tan (trừ K2SO3 , Na2SO3 tan). Muối Nitrat (-NO3) Tất cả đều tan. Muối Photphat (ºPO4) Hầu hết khụng tan (trừ K3PO4 , Na3PO4 tan ). Muối Cacbonat (=CO3) Hầu hết khụng tan (trừ K2CO3 , Na2CO3 tan). Muối Clorua (-Cl ) Hầu hết đều tan (trừ AgCl khụng tan). ỉ HểA TRỊ CỦA MỘT SỐ NGUYấN TỐ VÀ NHểM NGUYấN TỬ: Húa trị (I) Húa trị (II) Húa trị (III) Kim loại Na, K, Ag Ca , Ba , Mg , Zn, Fe, Pb, Cu, Hg Al, Fe Nhúm nguyờn tử -NO3 ; (OH) (I) =CO3 ; =SO3 ; =SO4 PO4 Phi kim Cl , H , F O Cỏc phi kim khỏc: S (IV,VI ) ; C (IV) ; N (V) ; P (V).
Tài liệu đính kèm:
 de_cuong_on_tap_HKI_hoa_9.doc
de_cuong_on_tap_HKI_hoa_9.doc





